Күкірт қышқылын өндірудің физика-химиялық негіздері және өндірістік процестері


Мазмұны
Кіріспе 2
1. Күкірт қышқылының халық шаруашылығындағы маңызы 3
2. Күкірт қышқылын өндіру кезіндегі физика-химиялық негіздері 4
3. Өндіріс жағдайында өтетін химиялық және физика-химиялық
Процестер 11
4. Жылулық және материалдық балансы 20
5. Қорытынды 24
Кіріспе
Күкірт қышқылы түзсіз, май тәрізді ауыр сұйық зат.
Күкірт қышқылын күкірт үштотығының бір молекуласы H 2 SO 4 (күкірт қышқылының ангидриді) мен судың бір молекуласының қосылысы қажет; демек, сусыз күкірт қышқылының құрамында 81, 63% SO 3 және 18, 37% H 2 O бар.
Техникада кұкірт ретінде күкірт үштотығының сумен кез келген қоспасын түзеді. Егер SO 3 -тың 1 молінен кем болса, онда бұл күкірт ангидридінің күкірт қышқылындағы ерітіндісі, оларды олеум немесе түтіндейтін күкірт қышқылы деп атайды.
Күкірт қышқылының судағы ерітінділерінің құрамы H 2 SO 4 немесе SO 3 (%-пен) мөлшерімен сипатталады.
Күкірт қышқылы - ең қарқынды (күшті) бейорганикалық қышқылдарының бірі. Шоғырлы күкірт қышқылы активтік қатарда сутектен бұрын да, кейін де тұрған металдардың көпшілігімен әрекеттеседі. Ол барлық дерлік металдармен және олардың тотықтарымен әрекеттеседі, алмасу ыдырау реакцияларына түседі, сумен өте қарқынды қосылады, тотықтырғыш және басқа да маңызды химиялық қасиеттері бар. Күкірт қышқылының жоғары химиялық беосенділігі оның өнеркәсіптің түрлі салаларына кеңінен қолданылуына жағдай жасады. Сусыз күкірт қышқылы 20°C түссіз майлы сұйықтық түрінде болады, 10, 37°C кристалданады.
1 Халық шаруашылығындағы маңызы күкірт қышқылының
Күкірт қышқылы - химия өнеркәсібінің негізгі және аса маңыздыларының бір өнімі болып табылады. Оларға : қышқылдар, сілтілер, тұздар, минералдық тыңайтқыштар мен хлор өндіру кіреді. Күкірт қышқылының негізгі тұтынушысы минералдық тыңайтқыштар өндірісі болып табылады. Оны сонымен қатар көп мөлшерде органикалық синтезде, керосинді тазалау үшін, мұнай майлары және коксохимия өндірісде (бензил, толуол), бояу дайындауда, қара металлургияда металды суғару үшін қолданады.
Бірде-бір химиялық лаборатория жұмыс істей алмайды. Күкірт қышқылын өндіру үш сатыдан тұрады:
- Күкірт оксидін (SO2) алу және тазарту;
- Күкірт оксидін (SO2-ні) күкірт триоксидіне (SO3-ге) тотықтыру;
- Күкірт триоксидін (SO3-ті) абсорбциялап күкірт қышқылына айналдыру. Күкірт қышқылын алудың екі әдісі бар: контакт және нитроза әдістері.
Күкірт қышқылының сорттары
Күкірт қышқылының түрлі сорттарының сапасына қойылатын талаптар стандарттарымен регламенттелінеді және жүйелі түрде қышқылды өндіру техникасының, оны тұтынушылардың мұқтаждарының өзгеруне сәйкес қайта қарастырылады.
Күкірт қышқылының тасымалдау және сақтау кезінде кристалдану мүмкіндігін азайту күкірт қышқылының товарлы сорттарына оның шоғырларының ең төмен кристалдану температураларына сәйкес стандарттар бекітілген:
%H 2 SO 4 %SO 3 T крист. °С
Мұнаралық қышқыл 75 -29, 5
Контактілі қышқыл 92, 5 -22, 0
Олеум 104, 5 20 +2
Жоғары процентті олеум 114, 6 65 -0, 35
Күкірт қышқылының техникалық сорттарының кристалдану температурасы таза күкірт қышқылының кристалдану температурасынан біршама төмен және қоспалардың мөлшері жоғарылаған сайын бұл айырмашылық ұлғаяды.
КҮКІРТ ҚЫШҚЫЛЫНЫҢ ҚОЛДАНЫЛУЫ
ӨНДІРІСТЕРДЕ Сульфат өндірісінде Минералды Сульфат аммони
K2Cr2O7 и Na2Cr2O7 Na, K, Fe, Cu, Zn, Al и др тыңайтқышта (NH4) 2SO4
Жарылғыш Травление
заттарда металлов
Спирт, Металлургия:
қышқыл, эфир Күкірт қышқылы Al, Mg, Cu, Hg,
және басқа орг H2SO4 Сo, Ni, Au и др.
заттар алуда қолд.
Органикалық Минералды
бояғыштар қышқылдарда
HF, H3PO4, H3BO3
Глюкоза Химические Мұнай өнімін
өндірісінде волокна, және минералды Минералды
текстильная майларды пигменттер
промышленность тазалау
2. 1. Өндіру кезіндегі күкірт қышқылын физика-химимлық негіздері
Күкірт қышқылын өндіру, контакт және нитрозды әдістермен өткізіледі де, олардың жалпы сатысына SO 3 газын алу және оны қоспалардан тазалауы жатады. Одан соң түйісу әдісімен күкірт қышқылын өндіру келесі сатылардан жинақталады:
-SO 2 газын катализаторда тотықтырып SO 3 газын алу;
-SO 3 газын абсорбциялау;
-күкірт қышқылын алуы.
Техникада күкіртті газ деп - құрамында күкірт қостотығы бар газды қоспаларды атайды; күкіртті газдың құрамдастарының (SO 2 , O 2 , N 2 және т. б. ) шоғыры бастапқы шикізаттың құрамы мен оны күйдіру әдістеріне байланысты түрлі болады.
Күкірт құрамдас шикізаттың жану реакциясы. Колчеданды күйдіру кезінде бірнеше реакция өтеді. Алдымен теиір сульфиді FeS түзіліп және күкірт булары бөлінуімен өтетін темір қос сульфидінің термиялық ыдырауы жүреді:
2FeS 2 →2FeS+S 2 -Q (1)
Күкірттің бөлінуі 500°C шамасында басталып, температура жоғарылаған сайын жылдамдайды. Содан соң күкірт қос тотық түзілуімен жанады:
S (газ) +O 2(газ) =SO 2(газ) +Q (2)
Мұндай реакция элементті күкіртті жаққанда да жүреді. Темір сульфидінің жануының бірнеше жуық үлгісі ұсынылған. Солардың біреуі бойынша FeS тотығуының бірінші сатысы болып темір сульфаты түзіледі де, одан соң ол темір тотығына дейін ыдырайды. Басқа үлгілер бойынша FeS тікелей темір тотықтарына дейін тотығады.
Колчеданның жануының жалпы процесі не Fe 2 O 3
4FeS 2 +11O 2 =2Fe 2 O 3 +8SO 2 +Q (3)
не Fe 3 O 4 түзілуімен өтеді:
3FeS 2 +8O 2 =2Fe 3 O 4 +6SO 2 +Q (4)
Fe 3 O 4 түзілуіне қолайлы жағдай болып жоғары температура, газдағы SO 2 жоғары мөлшері мен күймеген колчеданның салыстырмалы көп мөлшері саналады. Колчедандағы түрлі-түсті металдардың сульфидтері күйдіру жағдайына байланысты (температураға, газдағы оттегі мөлшеріне және т. б. ) тотықтар немесе сульфаттарға айналады.
Көмірлі колчеданды күйдіргенде күкіртпен бірге онда көміртегі келесі реакция бойынша жанады:
C+O 2 =CO 2 +Q (5)
Осының салдарынан күйдіру газындағы оттегі мөлшері азайып, катализатордағы SO 2 тотығу процесінің жылдамдығы төмендейді.
Колчеданды балқындымен тотықтырғанда (процесс температурасы 800°C жуық) жоғары шоғырлы SO 2 алынады:
FeS 2 +16Fe 2 O 3 =11Fe 3 O 4 +2SO 2 - Q (6)
Түзілетін тотық Fe 3 O 4 ауа оттегісімен тотығып (900°C) процеске қайтарылады.
11Fe 2 O 4 +2, 75O 2 =16, 5Fe 2 O 3 +Q (7)
(6) және (7) реакцияларының жалпы жылу эффектісі 828, 4 кДж(197, 7ккал) құрайды да, SO 2 -ні осы тәсілмен алу процесінің автотермиялығын қамтамасыз етеді.
Мырыш жалғанышын күйдіргенде тотығу процесі келесі реакция бойынша жүреді:
2ZnS+3O 2 =2ZnO+2SO 2 +Q (8)
Күкіртсутегі жанғанда SO 2 мен су булары түзіледі:
2H 2 S+3O 2 =2SO 2 +2H 2 O+Q (9)
Гипсты (CaSO 4 •2H 2 O) қыздырғанда алдымен кристаллизациялық су бөлінеді, сонан соң калий сульфаты (ангидрит) ыдырайды.
CaSO 4 =CaO+SO 2 +0, 5O 2 - Q (10)
Оның толық ыдырауы 1400-1500°C өтеді; ыдырау температурасын көміртегі (көмір) қатысуымен едәуір төмендетуге болады:
2CaSO 4 +C=2CaO+2SO 2 +CO 2 - Q (11)
CaSO 4 ыдырау температурасын сонымен бірге шихтаға кремнезем, алюминий және темір тотықтарын қосу арқылы да төмендетеді.
Күкіртқұрамдас шикізаттың жану жылуы
4FeS 2 +11O 2 =2Fe 2 O 3 +8SO 2 +3415, 7 кДж (12)
Реакцияның теңдеуінен көрініп тұрғаны бойы, 4 моль темір қоссульфиді (молекулалық салмағы 119, 97) жанғанда 3415, 7 кДж жылу бөлінеді. Демек, химиялық таза FeS
2
жану жылуы
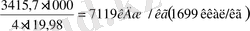 құрайды.
құрайды.
Колчедан жанғанда бөлінетін жылу мөлшері күкірттің жану дәрежесінде тәуелді және төмендегі жолмен анықталады:
Q=
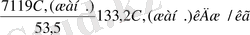 Equation. 3 немесе 31, 8C
S(жан)
шкал /кг (13)
Equation. 3 немесе 31, 8C
S(жан)
шкал /кг (13)
мұндағы С S(жан. ) - күкірттің жанып кету дәрежесі, %; 53, 5-FeS-дегі күкірттің мөлшері.
Ал күкірттің жанып кету дәрежесі келесі теңдеуімен анықталады:
С S(жан) =С S(нақты) - β С S(б. к. ) (14)
бұл жердегі С S(нақты) - колчедандағы күкірт мөлшері, %; β - түзілетін балқындының мөлшері; С S(б. к. ) - балқынды қалдық күкірттің мөлшері; %;
β
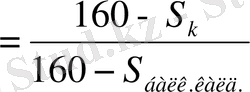 (15)
(15)
бұл жерде S k колчедандағы күкірт мазмұны, S балк. калд. - балқындағы қалдықтағы күкірттің шоғыры.
Балқынды қалдықтың шығымын анықтағанда, оның пештен шығарылатын мөлшерін ғана емес, сонымен бірге күйдіру газымен кететін шаң мөлшерін де ескеру қажет.
Балқынды қалдықпен кететін шығынын (пешке салынған күкірт мөлшерінен %) келесі формула бойынша анықталады:
П=
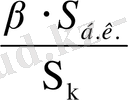 (16)
(16)
Осылайша түрлі шикізатты жаққанда бөлінетін жылу мөлшерін қалдықтағы күкірт мазмұны анықтауға арналған формуланы шығаруға болады, колчеданның
3FeS 2 +8O 2 =Fe 3 O 4 +6O 2 +2438, 2 кДж (17)
реакция бойынша жанған кезде
Q=126, 5C S(жан) кДж /кг (30, 2 C S(жан) ккал/кг )
Күкірт жанған кезде
Q=92, 6 C S(жан) кДж/кг (22, 11 C S(жан) ккал/кг)
Мырышты күйдігенде
Q=146, 7 C S(жан) кДж/кг (35 C S(жан) ккал/кг)
Күкірт құрамдас шикізатты күйдіру температурасы. SO 2 бөлініп пиритті жайлап тотығуы 170-260°C басталады, ал колчеданның түрлі сорттарының тұтану температурасы 290-дан 420°C-қа дейін ауытқиды. Колчеданның түйіршіктері майда болған сайын, оның тұтану температурасы да төмендейді. Мысалы, кейбір деректер бойынша, түйіршік өлшемдері 0, 00-0, 05, 0, 08-1 және 1-2 мм болғанда тұтану температурасы сәйкесінше 290, 405 және 428°C тең. Кремнезем қоспалары колчеданның тұтану температурасын жоғарылатады, ал органикалық өнім қоспалары оны төмендетеді.
Жанар газдарды сұйық сіңіргіштермен тазалау (ылғалды әдістер) әдістерімен алынатын күкіртсутекті газ көптеген жағдайда H 2 S-тің жоғары шоғырымен анықталады. Мұндай газдың құрамында балласты азот көп ауа қоспасымен жаққанның өзінде өте жоғары температурада дамиды да, ол жағылатын газдағы күкіртсутегінің шоғыры көптеу болып және артықша ауа аздау болған сайын жоғарылайды. Күкіртсутекті жоғары температурада жаққан тиімді, өйткені бұл жағдайда жану жылдамдығы өзгереді және жылуды пайдалану жағдайы жақсарады. Алайда жану темепратурасы 1200°C арқасында пешті жасайтын маериалдарды таңдауға қиындықтар туындайды.
Күкіртсутегінің ауамен немесе оттегімен қоспалары бегілі қатынастарда қыздырғанда өздігінен жану қабілетіне ие. Күкіртсутегімен оттегі қоспасының тұтану температурасы 220-235°C құрайды.
Күкіртқұрамдас шикізаттың жану жылдамдығы. Колчедан жанғанда келесі процестер жүреді:
1) 2FeS 2 =2FeS+S 2 -103, 9 кДж реакция бойынша FeS 2 ыдырауы;
2) O 2 газды фазадан колчедан түйіршік бетіне жеткізу;
3) S газ +O 2 газ = SO 2 газ +362, 4 кДж реакция бойынша күкірттің тотығуы;
4) FeS, SO 2 және Fe 2 O 3 пайда болып тотығуы;
5) тотығу кезінде бөлінетін жылудың колчедан түйіршіктерінен газға өтуі;
6) SO 2 -нің реакция аймағынан газды фазаға өтуі.
Күйдіру жағдайының (температураға, түйіршіктер өлшемдеріне, газ ағынының жылдамдығына) байланысына сәйкес процестің жалпы жылдамдығына ықпалы әртүрлі. Колчеданның жану жылдамдығы көбірек дәрежеде оның химиялық және минерологиялық құрамына, сонымен бірге кристалдың құрылысына тәуелді. Төменгі температурада (3, 4, процестер) химиялық реакциялардың жылдамдығы диффузиялық процестердің жылдамдығынан төмен, сондықтан процестің жалпы жылдамдығы 27, 29 және 30 реакциялардың жүруімен аяқталады, яғни процесс кинетикалық облыста өтеді.
Колчеданды қозғалмайтын қабатта күйдіргенде 2, 5 және 6 процестер өте жай өтеді(масса және жылу беру процестері), яғни процесс диффузиялық режимде жүреді.
Өндірістік жағдайлардағы күйдіру кезіндегі жанып жатқан материалдың жімдесуі (шлактануы) үлкен қиындықтарды туғызады. Температура жоғарылаған сайын колчеданның жімдесуі күшейеді, ол колчеданның құрамына (сортына) да байланысты. Құрамында 35% жуық S бар колчедан күшейеді 800°C балқынды кесектенеді, ал колчедандардың көпшілік бос бөлшегі 900°C балқып кесектенеді.
Колчеданды шаңтәрізді күйдіру және қайнау қабаты пештерінде күйдіргенде колчеданның жімдесуіне жол бермеу керек, себебі пайда болған жімдес кесектері қалқыма күйдегі колчеданның жану процесін бұзады. Қайнау қабатында құрамында азғана күкірт бар балқындының болуы салдарынан, мұндай пештерде жімдесу механикалық пештер мен шаңтәрізді күйдіру пештерінде қарағанда жоғары температурада жүреді.
Дегенмен, барлық жағдайда колчеданның жімдесу мүмкіндігін азайту үшін күйдіру температурасын төмендетеді.
2. 2. Күкірт үштотығының қасиеттері және SO 3 абсорциясының физика-химиялық негіздері
Күкірт үштотығы SO 3 немесе күкірт ангидриді қалыпты жағдайда түссіз газ оның молекулалық салмағы 80, 056. Cу буымен бірден әрекеттесіп тұман пайда етеді. Газ тәрізді SO 3 44, 75°C-та сұйылтылып, түссіз сұйықтыққа айналады.
Қатты SO
3
бірнеше -ά, β, γ түрлерінде болуы мүмкін, олардың балқу температуралары 16, 8; 31, 5 және 62, 2°C-ге сәйкесті тең.
 -түрі құрамы бойы SO
3
-ке сәйкес, ал басқа қалыптары күкірт үштотығының полимерлену өнімдері болып табылады. SO
3
-тің басқа да жоғары молекулалы қосылыстары болуы мүмкін.
-түрі құрамы бойы SO
3
-ке сәйкес, ал басқа қалыптары күкірт үштотығының полимерлену өнімдері болып табылады. SO
3
-тің басқа да жоғары молекулалы қосылыстары болуы мүмкін.
SO 3 -тің түрлері бір-бірінен кристалдық торының құрылысымен, буларының қысымымен, химиялық белсенділігімен және басқа да қасиеттерімен ерекшеленуі мүмкін.
Күкірт үштотығының буларының қысымдарын p(Па-мен) келесі теңдеулер арқылы анықтауға болады.
lg=8, 7820-154, 9/T-331650/T(сұйық
 -форма)
-форма)
lg=14, 3595-2916/T(қатты
 -форма)
-форма)
lg=14, 6865-3040/T(қатты
 -форма)
-форма)
Күкірт ангидридінің кристалданғанда және полимерленгенде жылудың түрі мөлшері бөлінеді:
кДж/моль ккал/моль
SO
3(сұйық)
→
 - SO
3(қатты)
7, 081 1, 69
- SO
3(қатты)
7, 081 1, 69
 -SO
3(сұйық)
→β - SO
3(қатты)
3, 478 0, 83
-SO
3(сұйық)
→β - SO
3(қатты)
3, 478 0, 83
 -SO
3(сұйық)
→γ - SO
3(қатты)
14, 33 3, 42
-SO
3(сұйық)
→γ - SO
3(қатты)
14, 33 3, 42
Күкірт үштотығының қатты полимерлі түрлері қыздырғанда диссоциацияланады. SO 3 сумен өте қарқынды әрекеттесіп, күкірт қышқылын түзеді және көп мөлшерде жылу бөлінеді.
SO 3(сұйық) +H 2 O=H 2 SO 4(сұйық) +131, 1кДж(31, 29) (12)
Осыған SO 3 -тің суды тартып алу қасиетіне негізделген; күкірт үштотығы күшті тотықтырғыш болып табылады. Күкіртті фосфорды, көмірсутектерді және басқа да заттарды тотықтырып SO 3 -ны SO 2 -ге дейін тотықсызданады. Күкірт үштотығының жоғары полимерлі формалары инертті; олар сумен нашарлау әрекеттеседі, ауада әлсіз түтіндейді және олардың күйдіргіштік әрекеті азғана дәрежеде білінеді.
Сұйық күкірт ангидриді SO 3 -мен кез-келген қатынаста араласады, қатты күкірт ангидриді сұйық SO 3 -ге химиялық қосылыстар түзбей ериді. Сүйық SO 3 азот қышқылымен барлық қатынастарда араласады.
Күкірт үштотығы сонымен бірге азоттың тотықтарымен мышьякты ангидридпен, негізгі тотықтар және негіздермен қарқынды әрекеттеседі.
Газ тәрізді SO 3 хлорлы сутекпен әрекеттескенде хлорсульфонды қышқыл пайда болады - SO 2 (OH) Cl; SO 3 аммиакпен әрекеттескенде аммонийдің амидосульфонаты NH 2 SO 2 CNH 4 алуға болады.
Түйісу тәсілі бойынша күкірт қышқылын өндіру процесіндегі соңғы сатысы, күкірт үштотығын газ қоспасынан алу және оны күкірт қышқылына айналдыруы. Түйісу аппаратына кірердегі газдың кептірілетіндігі, болмаса кептірілмейтіндігіне байланысты SO 3 бөлу процесінің механизмі әртүрлі. Бірінші жағдайда ол күкірт қышқылымен абцорбцияланады, ал екіншіде, күкірт қышқылының сұйықталынуы өтеді. Өндірістердің көбіне газ кептіріледі де SO 3 мұнараларда және абсорберлерге күкірт қышқылымен абсорбцияланады. Күкірт қышқылында күкірт үштотығы ериді де, ал содан соң ондағы сумен әсерлеседі:
nSO 3 +H 2 O=H 2 SO 4 +(n - 1) SO 3
SO 3 және су қатысының мөлшеріне байланысты әртүрлі шоғырлы күкірт қышқылы алынады.
Абсорбциядан соң газ қоспасы сумен сорылып алынбаған күкірт ангидридімен бірге атмосфераға шығарылып тасталады. SO 3 -тің қайтымды газдармен бірге жоғалмауы үшін, абсорбциялық бөлімде оның сіңірілуі толықтай өтуі керек.
Түйісу қондырғылары барлық өнімдері олеум түріне шығаруға дайын болуы керек, яғни басқа қышқыл түріне қарағанда, ол ең бағалы өнім. Олеумге сұраныс жоқ болған жағдайда оны моногидрат абсорберлерінің құрамына жіберіледі, ал моногидратты кептіргіш мұнарысының жинағышына беріп, одан 93-95% H 2 SO 4 күкірт қышқылына дейін шоғырсыздандырады. Олеум алу үшін SO 3 бар газ олеуммен суарылатын абсорберден өткізіледі. Олеумді абсорберге SO 3 -тің бөлшегі жұтылады да, толық жұтылуы моногидратпен суарылатын абсорберге өтеді. Олеумнің шоғыры жоғарылауына байланысты моногидратты абсорберден оған қышқыл қосады да, артық түзілетін олеум қоймаға беріледі.
Өнімдік олеумде 19% кем емес SO 3 болуы стандартпен қарастырылған және онымен олеумдік абсорберді суғарады. Моногидратты абсорберде суғаратын H 2 SO 4 шоғыры 98, 3% шамасында болуы қажет. Мұндай шоғырлы қышқыл күкірттің үштотытығын SO 3 буының және оның үстіндегі судың қысымы өте аз болғандықтан жақсы абсорбциялайды.
Шығарылатын олеум мөлшері күкірт ангидридінің қандай бөлігі олеум абсорберінде жұтылатындығымен және абсорберге тазалау бөлімінің кептірілген қышқылмен түсетін су көлеміне байланысты.
Күкірт қышқылын ылғал катализатор әдісімен алу кезінде, түйісу бөлімінен шығатын газда H 2 SO 4 түзеді де олар мұнарада сұйылтылады. Осылайша ылғал катализі әдісіндегі процесте SO 3 абсорбциясы емес, күкірт қышқылының буының сұйытылуы өтеді. Жоғарыда бу шоғырлануымен қатар тұман түзетін көлемді бу сұйытылуы байқалады да, олар электрсүзгіде бөлініп шығады.
Егер күкірт қышқылы цехінің өнімі 95% H 2 SO 4 кем күкірт қышқылы түрінде шығарса, күкірттің үштотығын бөліп шығаруы қажетті түрде, SO 3 абцорбциясынан үлкен жылдамдықпен жүретін H 2 SO 4 буын жолымен өткезеді. Бұдан сұйылту процесі жоғары температурада жүреді де, бұл газдың жылуын шығаруға және оны пайдалануына жеңілдік жасайды.
Газ тәріздес күкірт үштотығы 98, 3% күкірт қышқылымен толық абсорбцияланады. Қышқылдың шоғыры 98, 3%-тен төмен немесе жоғары кезінде оның жұтқыштық қасиеті кемиді. Мұндай тәуелділік 98, 3% күкірт қышқылының үстінде H
2
SO
4
тепе-теңдік SO
3
қысымы елеусіз (
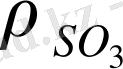 ≈0), ал су буының қысымы (
≈0), ал су буының қысымы (
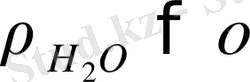 ) көп, сондықтан күкірт қышқылының үстінде су молекулаларының булануы жүреді.
) көп, сондықтан күкірт қышқылының үстінде су молекулаларының булануы жүреді.
Түйісу зауытының абсорциялық бөлімі
Абсорберлерде күкірт қышқылы газды қоспадан тек күкірт үштотығын сорып алады, ал газдың қалған бөлігі абсорберден өтіп атмосфераға жайылады. Әдетте SO 3 екі кезектен қосылатын абсорберлерде жұтылады: бірінші - олеумді және екіншіде - моногидратты.
Технологиялық үлгі бойы түйісу бөлімінен шыққан газ ангидридті түйісу салқындатқышқа келіп түседі де, одан кейін олеумді абсорберге түседі. Олеум күкірт ангидридін жұта отырып, H 2 SO 4 түзілу жылу реакциясы себебінен жылиды. Ыстық шоғырланған олеум 2 поз. абсорберден суаруға беріледі.
Олеумнің бір бөлігі үздіксіз қоймаға жіберіледі немесе шоғырлы қышқыл алу үшін қолданады.
2 поз. олеумді абсорберден газ 98, 3%-ті күкіртті қышқылмен сарылатын 3 поз. абсорберлерден моногидрат жинаққа ағып түседі де, сол жинаққа оны шоғырсыздану үшін кептірілген мұнарадан қышқыл немесе су беріледі. Ыстық қышқыл жинақтан суытылу үшін 4 поз. суландыру салқындатқышқа құйылады да, қайтадан 3 поз. моногидратты абсорберді суару үшін келіп түседі. Моногидраттың бір бөлігі үздіксіз олеумді жинақ пен кептіргіш мұнараға беріледі. Моногидратты абсорберден кейін газдар 1 поз. сүзгіден тамшы және күкіртті қышқыл тұманын бөлу үшін өтеді де, атмосфераға шығарылып тасталады.
Теменде көрсетілген есептеме бойы стандартты олеум түріне барлық өнімді шығару үшін олеумді абсорберде жұтылатын күкірт үштотығының үлесі SO 3 - тің барлық сананың 31%-тің құруы қажет.
А
0
=
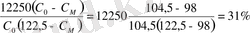
Бұл жерде, С 0 -олеум шоғыры, 104, 5%, C M -моногидрат шоғыры 98%-ке тең.
Шын мәнінде олеумді абсорберде SO 3 -тің 70%-не дейін жұтылады. Осының нәтижесінде моногидратты абсорберге түсетін күш төмендейді, бірақ онда олеумді қосу арқылы және оның берілген шоғырын ұстап тұруға қажетті күкірт қышқылы аз түзіледі. Абсорбцияның белгіленген тәртібін бұзбау үшін олеумнің бір бөлігін моногидрат шоғырына дейін шоғырсыздандырады.
Абсорбция бөлімінің жұмысының негізгі көрсеткіші -SO 3 абсорбциясының толықтылығы; моногидратты абсорбердің оптимальді тәртібіне кететін газдар тіпті мөп-мөлдір және онда тек күкірт қышқылының іздері ғана мазмұндайды. Моногидратты абсорберді суаратын қышқылдың шоғыры H 2 SO 4 -тің 98, 3%-інен төмен немесе көп кезінде тұман түзіледі де және кететін газдар көзге көрінетін болады. Моногидратты абсорберде тұман тағы да газдың тым жоғары ылғалдануынан да пайда болады. Әдетте кептіргіш мұналардан соң газға 0, 01% су буы қалады. Түйісу аппаратынан соң, газда SO 3 -тің үлкен мөлшері мазмұндайды да, газдың суы кезінде су булары толығымен H 2 SO 4 буына айналады және оның шоғыры 0, 01% немесе 0, 437г/м 2 жинақталады.
Күкірт қышқылының булары абсорбер қондырмасының бетінде конденсацияланады. Суару қышқылдың өте төмен температурасында, немесе газдың жоғары ылғалдылығы кезінде күкірт қышқылының буының бір бөлігі көлемде тұманның пайда болуымен сұйытылады да, ол абсорберлерде тұнбаланбай атмосфераға тасталынады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz