Химиялық термодинамика және тепе-теңдік: реакция жылдамдығы, Ле-Шателье принципі және тепе-теңдік константасы


Реакцияларды басқару
Химиялық термодинамика көмегімен күрделі эксперименттерге жүгінбей-ақ, сол немесе басқа химиялық реакцияның қандай жағдай кезінде жүретіндігін, алынған заттардың қанша мөлшері бізге қажетті өнімге айналатындығын, сол немесе басқа бағытта реакцияны қалай бағыттау керектігін есептеуге болады.
14. Химиялық тепе-теңдік
Химиялық реакция жылдамдығы жайлы еске түсірейік. Заттардың химиялық әрекеттесуі осы зат молекулаларының соқтығысуы кезінде туындайды. Сәтті соқтығысулар саны көлем бірлігіндей молекулалар мөлшеріне, сондай-ақ концентрацияға пропорционалды (баламалы) . Реакция процесі кезінде заттар концентрациясы өзгереді: әрекеттесуші заттар концентрациясы азайып, реакция өнімдерінің концентрациясы - ұлғаяды.
Химиялық реакция жылдамдығы ретінде әрекеттесуші заттардыңбірінің немесе өзгеріссіз көлемде уақыт бірлігіндей реакция өнімдерінің бірінің концентрацияларының өзгерісі түсіндіріледі. Бұл кезде реакцияға қатысушы заттардың қандай екендігі жайлы әңгіме болуында ерекшелік жоқ; олардың барлығы өзара реакция теңдеуімен байланысты, ал өйткені заттардың бірінің концентрацияларының өзгеруі бойынша қалған барлықтарының концентрацияларының сәйкесінше өзгерістері жайлы пікір айтуға болады.
Негізінен концентрацияны литрге мольмен (моль/л), ал уақытты секундпен немесе минутпен өрнектейді.
Реакция жылдамдығы әрекеттесуші заттар табиғатына, олардың концентрацияларына, температураға, катализатордың болуына, сондай-ақ кейбір бірқатар себептерге: радиоактивтік сәулеленуге, газдармен арадағы реакция жағдайында - қысымға, қатты заттар кезінде - әрекеттесуші заттардың бетіне тәуелді болады. Қатты заттар тек беттерімен ғана әрекеттесетіндіктен, бұл жағдайдағы реакция жылдамдығы концентрацияға емес, қатты зат бетінің шамасына байланысты.
d және B екі затының өзара әрекеттесуі кезінде реакция жылдамдығы (v) мына теңдеумен есептеледі: v=k·c A ·c B , мұндағы k- реакция жылдамдығының константасы деп аталатын және әрекеттесуші заттар табиғаты мен реакция температурасын есептейтін пропорционалдық коэффициенті; c A және c B - заттардың молярлық концентрациялары.
Егер А затының m молекуласына В затының n молекуласы келетіндей қатынаста екі зат өзара әрекеттесетін болса, онда mA+nBәрекеттесуі үшін реакция жылдамдығы мына теңдеумен өрнектеледі: v=k·c m A ·c n B , сондай-ақ реакция жылдамдығы әрекеттесуші заттардың концентрацияларының туындыларына пропорционалды. Дегенмен, практикалық тұрғыдан, осы дәрежелер жиынтығы үштен көп болмайды және де бір мезгілде үштен көп белсенді молекулалар соқтығысуы үшін соқтығысу реакцияға алып келеді деп ұйғарым жасау қиын. Практикалық мәліметтер мұндай болатын сәйкессіздік көптеген реакциялардың бірнеше сатыдан тұрып, бірнеше қарапайым бірізді процестерге ыдырайтындығымен түсіндіріледі. Олардың әрқайсысы үшін жекелей алғанда келтірілген теңдеулер әділ болып табылады.
Енді химиялық тепе-теңдік жайлы.
Бір бағытта жүретін және қалыпты жағдайда практикалық тұрғыдан аяғына дейін жүретін реакциялар қайтымсыз деп аталады. Олар соншалықты көп емес.
Бір мезгілде екі өзара қарама-қарсы бағытта жүретін реакциялар қайтымды деп аталады.
Иодсутек ыдырауы кезінде 2HJ⬄H 2 + J 2 алдымен иод және сутегі түзілгенімен, олардың молекулалары ретсіз соқтығыса отырып, қайтадан иодсутек береді. Жылдамдық тура (HJ ыдырауы) және қайтымды (HJ түуілуі) болған кезде реакцияға теңдей болып, химиялық тепе-теңдік күйі орнайды.
Химиялық тепе-теңдік - тура және кері реакция жылдамдықтары өзара тең болған кездегі әрекеттесуші заттардың жүйесінің осындай күйі.
Сондықтан мұндай тепе-теңдік қозғалмалы немесе динамикалы тепе-теңдік деп аталады. Әрекеттесуші қоспада көрінетін өзгерістер болмайды: бастапқы заттар секілді, түзілген әрекеттесуші заттар концентрациясы қатаң түрде тұрақты болып, олар тепе-теңдікті деп аталады.
Химиялық тепе-теңдік жағдайына әрекеттесуші заттар концентрациясы, газтектес заттар үшін температура мен қысым әсер етеді. Осы параметрлердің бірінің өзгерісі кезінде тепе-теңдік бұзылып, барлық әрекеттесуші заттар концентрациясы тепе-теңдік концентрациясының басқа мәні кезінде химиялық тепе-теңдік орнағанша өзгеретін болады. Реакциялық жүйенің бір тепе-теңдік күйден екіншісіне ұқсас өтуі химиялық тепе-теңдіктің ығысуы (немесе қозғалуы) деп аталады.
Концентрация, температура мен қысым өзгерісі кезіндегі химиялық тепе-теңдіктің ығысу бағыты Ле-Шателье принципімен анықталады. Осы принципке сай, егер қайтымды химиялық реакция тепе-теңдік күйде болған кездегі жағдайлардың бірін өзгертсек, онда тепе-теңдік осы өзгеруге қарама-қарсы әсер ететін реакция бағытына қарай ығысады. Егер иодсутек ыдырауының эндотермиялық реакциясының температурасын көтерсе, онда тепе-теңдік оңға, сутегі мен иод түзілетін жаққа ығысады. Егер де температураны төмендетсе тепе-теңдік солға ығысып, иодсутек концентрациясы өседі.
2SO 2 +O 2 ⬄2SO 3 теңдеуімен бейнеленетін реакция экзотермиялық - SO 3 күкірт (VI) оксиді түзілу кезінде жылу бөлінеді. Жоғары температура кезінде тепе-теңдік солға ығысып, кері реакция жүретін (күкірт (IV) оксиді мен оттегінің түзілуі жүреді), ал температура төмендеуі кезінде - тура реакция орын алып, ол тепе-теңдік орнағанға дейін жүреді. Қысым жоғарылауы кезінде тепе-теңдік сол температура кезінде кіші көлем алатын зат түзілетін жаққа ығысып, бұл кезде қысым төмендейді.
Қысым өзгерісі егер реакция газтектес күйде жүретін болса, онда тек осы жағдайда ғана тепе-теңдіктің едәуір ғысуын тудыратындығы белгілі.
Тұрақты температура кезіндегі жабық (оқшау) кеңістікте (мысалы, жабық реакторда, ыдыста, аппаратта) қысым өзгерісі реакция нәтижесінде тек егер реакция газтектес заттардың мөлдерінің жалпы сандарының өзгерісі кезінде жүрсе ғана жүзеге асуы мүмкін. Егер реакцияға түскенге қарағанда газтектес заттардың аз молекуласы түзілсе, онда бұл реакциялық кеңістіктегі қысым төмендеуін тудырады.
Ле Шанбелье принципіне сай, егер біз газды сығар болсақ, онда реакция газтектес заттар молекулаларының аз санының түзілуі жағына қарай жүретін болады. Егер газтектес заттар молекулаларының сандары реакция кезінде ұлғаятын болса, онда газды сыну кезінде кері реакция жүреді. Тепе-теңдік ығысуына қысым өзгерісінің қалай әсер ететінін шешу үшін теңдеудің сол және оң жақ бөлігіндегі газ молекулаларының санын есептеу керек: 2SO 2 +O 2 ⬄2SO 3 .
Күкірт (ІІІ) оксидінің тотығуының келтірілген мысалдарындағы қысым ұлғаюы молекулалар санының азаюымен жүретін процеске оң ықпал жасап, тепе-теңдікті оңға ығыстырады. Қысым азаюы тепе-теңдікті солға ығыстырып, молекулалар санының ұлғаюы қысым азаюымен туындайтын әсерді әлсіретеді. Иодсутек ыдырауы реакциясы жағдайында қысым тепе-теңдік ығысуына әсер етпей, теңдеудің сол жақ және оң жақ бөлігіндегі газ молекулаларының саны бірдей болады.
Ле Шателье принципі өнеркәсіпте әртүрлі өнімдерді алу кезінде басшылыққа алынады. Сутек пен азоттан аммиак синтездеу
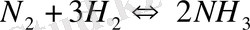 -реакциясы экзотермиялық әрі қайтымды. Температура төмендеуі тепе-теңдікті аммиактың түзілу жағына ығыстырады. Дегенмен төмен температура кезінде барлық реакция жылдамдықтары барынша төмен.
-реакциясы экзотермиялық әрі қайтымды. Температура төмендеуі тепе-теңдікті аммиактың түзілу жағына ығыстырады. Дегенмен төмен температура кезінде барлық реакция жылдамдықтары барынша төмен.
Сондықтан аммиак синтезін 450-500
0
С кезінде жүргізуде тура келеді. Температураның жоғарылауы тепе-теңдікті солға ығыстырып, катализатор тура және кері реакцияны бірдей жылдамдатады, ал жоғарылатылған температура әсерінің қарсы әрекеті үшін жоғары температураны пайдалану керек. Негізінен аппаратура материалы шыдатйын 80 МПа-ға дейінгі қысым қолданылады. Әртүрлі органикалық өнімдерді, мысалы металциклогександы денгидрлеу толуолын алу кезінде С
7
Н
14
 С
7
Н
8
+3Н
2
, қысым төмен ұсталынады, бұл үлкен толуал шығымын алуға мүмкіндік береді.
С
7
Н
8
+3Н
2
, қысым төмен ұсталынады, бұл үлкен толуал шығымын алуға мүмкіндік береді.
Ле Шателье принципі жағдай өзгерісі кезіндегі реакция бағыты жайлы сауал сапалы түрде шешуге мүмкіндік береді. Сандық есептеуді тепе-теңдік константасын пайдалана отырып жүргізуге болады.
Реакция жылдамдығы әрекеттесуші заттардың стехиометриялық коэффициенттерінің дәрежесіне келтірілген осы заттар концентрацияларының туындысына пропорционалды. Реакция теңдеуін мына түрде жазамыз:
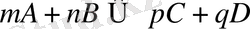 әрекеттесуші заттар концентрацияларын (литрге мольмен) сәйкесінше С
А
, С
В
, С
С
, С
Д
бегілеп, тура және кері реакция жылдамдықтарын
әрекеттесуші заттар концентрацияларын (литрге мольмен) сәйкесінше С
А
, С
В
, С
С
, С
Д
бегілеп, тура және кері реакция жылдамдықтарын
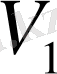 және
және
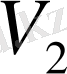 арқылы өрнектей отырып, мынаны аламыз:
арқылы өрнектей отырып, мынаны аламыз:
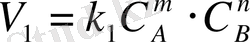 және
және
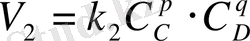 мұндағы
мұндағы
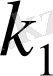 және
және
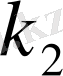 реакция жылдамдығының константалары.
реакция жылдамдығының константалары.
Химиялық тепе-теңдік орнау кезіндегі тура реакция жылдамдығы кері реакция жылдамдығына тең:
 демек,
демек,
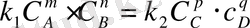 бірдей температуралар кезіндегі бұл реакция үшін
бірдей температуралар кезіндегі бұл реакция үшін
 , және
, және
 - тұрақты шамалар, сонда олардың
- тұрақты шамалар, сонда олардың
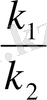 қатынасын К тұрақты шамасымен алмастыруға болады:
қатынасын К тұрақты шамасымен алмастыруға болады:
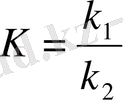 , немесе
, немесе
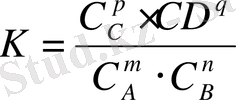 , мұндағы К-химиялық тепе-теңдік константасы. Ол температура мен әрекеттесуші заттар табиғатына тәуелді болғанымен, олардың концентрацияларына байланысты емес. Шындығында да, егер, мысалы, Сс ұлғайтсақ, онда СД азайып, С
А
және С
В
ұлғаюы тиіс, сондай-ақ, бұл тепе-теңдіктің солға ығысуына алып келеді. Жаңа тепе-теңдік арнайды. Жаңа тепе-теңдік концентрациялар басқа да сандық мәндерге ие болғанымен, сәйкес дәрежелерде келтірілген олардың туындыларының қатынасы тұрақты шама болып табылады. Тепе-теңдік константасы тура және кері реакция константаларына тең болса
, мұндағы К-химиялық тепе-теңдік константасы. Ол температура мен әрекеттесуші заттар табиғатына тәуелді болғанымен, олардың концентрацияларына байланысты емес. Шындығында да, егер, мысалы, Сс ұлғайтсақ, онда СД азайып, С
А
және С
В
ұлғаюы тиіс, сондай-ақ, бұл тепе-теңдіктің солға ығысуына алып келеді. Жаңа тепе-теңдік арнайды. Жаңа тепе-теңдік концентрациялар басқа да сандық мәндерге ие болғанымен, сәйкес дәрежелерде келтірілген олардың туындыларының қатынасы тұрақты шама болып табылады. Тепе-теңдік константасы тура және кері реакция константаларына тең болса
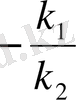 ол егер әрбір әрекеттесуші заттар концентрациясы 1 моль/л-ге тең болғандағы тура реакция жылдамдығының кері реакция жылдамдығынан неше есес үлкен екендігін көрсетеджі. Осы константаның физикалық мәні осында.
ол егер әрбір әрекеттесуші заттар концентрациясы 1 моль/л-ге тең болғандағы тура реакция жылдамдығының кері реакция жылдамдығынан неше есес үлкен екендігін көрсетеджі. Осы константаның физикалық мәні осында.
Егер реакция ерітіндіде жүретін болса, онда нақты есептеуі кезінде К-ны белсенділікте, нақ соның ішінде мынада көрсетуге болады:
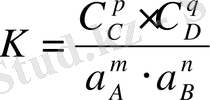 ;
;
Концетрацияларды қолдануға тек өте сұйытылған ерітінділер реакциясы жағдайында ғана мүмкін болады. Егер реакцияға қатты зат қатысса, оған концентрация түсінігін қолдаға болмайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz