Статистикалық және термодинамикалық зерттеу әдістері: идеал газ теңдеуі, универсал газ тұрақтысы және молекула-кинетикалық теория


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
Қ. А. Ясауи атындағы Халықаралық қазақ-түрік университеті
« Ақпараттық технологиялар және Инженерлік факультеті»
«Бағдарламамен қамтамасыздандыру кафедрасы»
Тақырыбы: Статистика және термодинамика.
Орындаған: Ыстыбаев Н
Тобы: ААЖ - 011
Қабылдаған: Жайдақбаева Д
Түркістан 2011ж
Жоспар:
- Статистикалық және термодинамикалық зерттеу әдістері.
- Идеал газ күйінің теңдеуі
- Универсал газ тұрақтысы
- Молекула - кинетикалық теоряның негізгі қағидалары
Статистикалық және термодинамикалық зерттеу әдістері.
Сансыз көп атомдар мен молекулалардан тұратын денелердегі макромкопиялық процестерді зерттейтін физиканың бөлімі - молекулалық физика және термодинамика деп аталады. Бұл процестерді зерттеу үшін бір-бірінен сапалық айырмашылығы бар. Бірақ бір-бірін толықтыратын статистикалық (молекулалық-кинетикалық) және термодинамикалық екі әдісті қолданады. Сансыз көп молекулалардың қалпы (тыныштық немесе қозғалыс күйі) статистикалық әдіспен зерттеледі. Бұл әдіс бойынша макроскопиялық жүйенің қасиеті сол жүйені құрайтын бөлшектердің қасиеті мен қозғалысының ерекшеліктері, жылдамдық, энергия тағы басқа шамаларының орташа мәндері мен анықталады. Мысалы, дененің температурасы оның молекуласының ретсіз қозғалысының жылдамдылығына тәуелді. Бірақ бір уақытта әртүрлі молекуланың жылдамдығы түрліше болғандықтан температура сол молекулалардың орташа арифметикалық м»німен анықталады. әрине бір молекуланың температурасы туралы сөз болуы мүмкін емес. Олай болса денелерді макроскопиялық сипаттау тек оны құрайтын молеклаларының саны көп болғанда ғана орынды.
Идеал газ күйінің теңдеуі.
Массасы кез-келген газдың күйі оның термодинамикалық параметрі - көлем (V), қысым (P) және температура (t) арқылы сипатталады. Идеал газдың моделі бойынша, молекулалар қозғалысының кинетикалық энергиясының қосындысы, олардың өзара әсерлесуінің потенциалдық энергиясына қарағанда әлдеқайда көп болады.
Идеал газдың күйі Менделеев-Клапейрон теңдеуімен сипатталады:
 (1)
(1)
R
= 8. 31
 универсал газ тұрақтысы.
универсал газ тұрақтысы.
Менделеев-Клапейрон теңдеуінде тәжірибе жүзінде анықталған барлық газ заңдары бар.
Бойль-Мариот заңы : Белгілі бір газдың, берілген массасында, оның температурасы өзгермеген жағдайда, газ қысымы P мен көлемінің V көбейтіндісі тұрақты болады
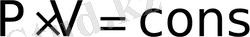
P-V диаграммасында Бойль-Мариот заңының графигі изотерма деп аталады және ол гипербола түрінде болады.
Гей-Люссак заңы : Белгілі бір газдың, берілген массадағы V көлемі, қысым тұрақты болғанда термодинамикалық температураға T пропорционал
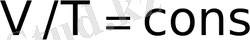
T-V диаграммасында Гей-Люссак заңының графигі изобара деп аталады және координата басы арқылы өтетін түзу сызықтар болып табылады.
Шарль заңы: Белгілі бір газдың, тұрақты көлемде, берілген массасының қысымы термодинамикалық температураға пропорционал
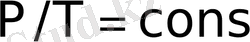
P-T диаграммасында Шарль заңының графигін изохора деп атайды, олар координатаның басы арқылы өтетін түзу сызықтар блып табылады Жоғары жеке-жеке процестерде (изотермиялық, изобаралық, изахоралық) бір параметр тұрақты болып қалған екеуінің арасындағы байланыс қарастырылып еді. Ал көп жағдайларда осы үш параметр бірдей өзгертетін күй кездеседі.
Газдың алғашқы күйінің, параметрлерін Р 1 , V 1 , Т 1 деп екінші күйінің параметрін Р 2 , V 2 , Т 2 деп белгілейік. Бірақ бірінші күйден екінші күйгк төмендегідей сатылы түрде көшсін делік:
А) алдымен (T 1 температураны өзгертпей (T 1 =const) ) қысымды Р 1 ден Р 2 -ге дейін өзгертелік. Осы кезде газ көлемі V болсын. Т 1 =const болғандықтан Бойль Мариотт заңы бойынша:
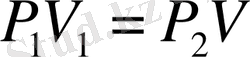 бұдан
бұдан
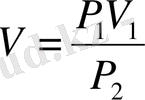 (8-1)
(8-1)
Б) енді қысымды өзгертпей (P 2 =const), газ температурасы Т 1 -ден Т 2 дейін өзгертелік. Онда көлем де өзгеріп, оның да мәні V 1 -дан V 2 -ге артады не кемиді. P 2 =const болғандықтан Гей Люссак заңы бойынша:
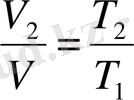 бұдан
бұдан
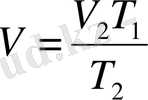 (8-2)
(8-2)
(8-1), (8-2) теңдіктерден
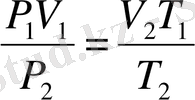 бұдан
бұдан
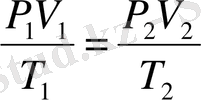 (8-3) яғни,
газ қысымының көлеміне көбейтіндісінің оның абсолют температурасына қатынасы, газдың берілген массасы үшін тұрақты:
(8-3) яғни,
газ қысымының көлеміне көбейтіндісінің оның абсолют температурасына қатынасы, газдың берілген массасы үшін тұрақты:
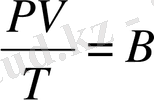 (8-4)
(8-4)
Қысым мен температура өзгергенде, оған сәйкес көлем де өзгереді, бірақ (8-4) қатынастың мәні өзгермейді де газ тұрақтысы деп аталатын В шамасына тең болады. Бұл коэффициенттің шамасы газдың массасына және газ табиғатына байланысты.
(8-4) теңдеуінен:
PV=BT шығады (8-4a) .
Бұл өрнекті газ күйінің теңдеуі немесе Б. Клапейрон теңдігі деп атайды.
Универсал газ тұрақтысы.
Әдетте (B) газ тұрақтысын меншікті газ тұрақтысы және универсал газ түрақтысы деп екіге бөледі.
Егер газ массасы М болса, онда оның көлемі
 ,
,
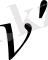 - газдың меншікті көлемі.
- газдың меншікті көлемі.
Осыны (8-4а) -ға қойсақ:
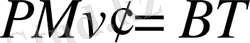 немесе
немесе
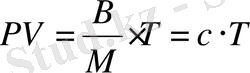 (8-5)
(8-5)
мұнда
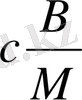 газдың бірлік (бір өлшем) массасына сәйкес келетін газ тұрақтысы. Оны
меншікті газ тұрақтысы
деп атайды және ол газ массасына (M) тәуелсіз, өйткені
газдың бірлік (бір өлшем) массасына сәйкес келетін газ тұрақтысы. Оны
меншікті газ тұрақтысы
деп атайды және ол газ массасына (M) тәуелсіз, өйткені
Р, v`, Т да газ массасына (M) байланысты емес.
Килограмм - молекула, немесе
килограммоль (кмоль)
деп заттың килограммен алынған массасы сан жағынан оның молекулалық салмағына
μ
тең (M=
μ
) болғандағы заттың мөлшерін айтады.
Граммен өлшенген зат массасы
сан жағынан оның молекулалық салмағына тең болса ондай зат мөлшерін грамм - молекула, немесе
гармм-моль (гмоль)
деп атайды. Бір килограмм - мольдағы молекула саны N
A
бір молекула массасының
μ
килограмме өлшенген (бір молекуланың массасының m қатынасына тең) :
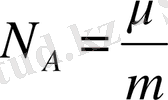 .
.
Молекулалық салмақтың анықтамасынан әртүрлі екі зат үшін:
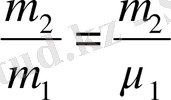 және
және
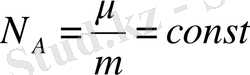 болады.
болады.
Олай болса
әртүрлі заттардың 1 килограмм - моліден молекула саны бірдей,
оны
Авогардо саны
деп атайды деген қорытындыға келеміз. (N
A
=6, 023⋅10
26 1
/моль, бір мольдегі молекуланың саны да осыған тең) . Бір килограмм-мольдің көлемін V
0
деп белгілеп, меншікті газ көлемі v` арқылы
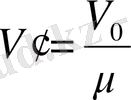 деп жазамыз да, оны (8-5) -ке қойсақ:
деп жазамыз да, оны (8-5) -ке қойсақ:
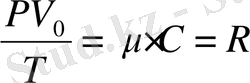 ,
,
 (8-6)
(8-6)
Соңғы Клапейрон - Менделеев теңдеуі деп атайды, өйткені газ күйінің теңдеуін алғаш 1843 жылы француз инженер-физигі Клапейрон өрнектеді, ал оны газдың 1 кмоль күйі үшін Менделеев өзгертті.
1811 ж. А. Авогардо бірдей қысым мен температурада әртүрлі газдардың бір килограмм-молінің көлемі бірдей деген заң ашты (V=22, 415 м 2 ) .
Осы заңға сүйене отырып және (8-6) теңдіктен газдың мольдық тұрақтысы R барлық газдар үшін бірдей, сондықтан оны универсал газ тұрақтысы деп атайды.
Клапейрон-Менделеев теңдеуін кез-келген m массалы газ үшін жазуға болады. 1 моль газдың көлемі V
0
болса, 1 кг газдың көлемі
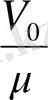 болады,
μ
- газдың мольдық массасы. Онда массасы М газдың көлемі
болады,
μ
- газдың мольдық массасы. Онда массасы М газдың көлемі
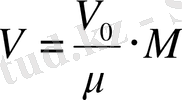 , мұнда M/
μ
- газдың бір килоиолінің саны. (8-6) теңдіктің екі жағын да M/
μ
- газ киломолінің санына көбейтсек:
, мұнда M/
μ
- газдың бір килоиолінің саны. (8-6) теңдіктің екі жағын да M/
μ
- газ киломолінің санына көбейтсек:
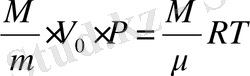 ,
,
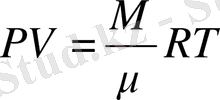 (8-7) .
(8-7) .
Мұны массасы кез-келген газ үшін жазылған Клапейрон-Менделеев теңдеуінің жалпы түрі дейді.
Молекула - кинетикалық теоряның негізгі қағидалары.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz