Электрометаллургиялық үрдістер теориясы: металлургия мамандығының зертханалық жұмыстарына арналған әдістемелік нұсқаулықтар


Қазақстан Республикасының білім және ғылым министрлігі
С. Торайғыров атындағы Павлодар мемлекеттік университеті
Металлургия, машина жасау және көлік факультеті
Металлургия кафедрасы
ЭЛЕКТРОМЕТАЛЛУРГИЯЛЫҚ ҮРДІСТЕР ТЕОРИЯСЫ
Металлургия мамандықтары бойынша күндіз және сырттай оқитын тәлімгерлердің зертханалық жұмыстарына арналған әдістемелік нұсқаулықтар
Павлодар
Кереку
2008
УДК 669. 02/. 09(07)
ББК 34. 314я7
Э 46
С. Торайғыров атындағы ПМУ-ның ММжК факультеті металлургия кафедрасының отырысымен басылымға ұсынылған
Пікірсарапшы: т. ғ. к., профессор Сүйіндіков М. М.
Құрастырушылар: Каршигина З. Б., Байділдаева Г. Б.
Э 46 Электрометаллургиялық үрдістер теориясы. Металлургиялық
мамандықтар тәлімгерлеріне арналған зертханалық
жұмыстарына әдістемелік нұсқаулықтар / құрастырушылар:
Каршигина З. Б., Байділдаева Г. Б. - Павлодар: Кереку, 2008. -
40 б.
Әдістемелік нұсқаулыққа электролиттердің сулы ерітінді электролизі кезінде ток бойынша шығымды анықтауға, гальваникалық элементтердің ЭҚҚ және электродтардың потенциалдарын өлшеуге, электролиз кезіндегі электрод үрдістерінің кинетикасын зерделеулерге арналған жұмыстары енгізілген. Жұмысты орындау барысында, тәлімгердің дайындығын жеңілдету үшін, әрбір жұмыста теориялық түсініктемесі бар.
Әдістемелік нұсқаулықтар 050709 «Металлургия» мамандығын оқытудың ҚР МЖМБС 3. 08. 335-2006 мемлекеттік стандарты негізінде әзірленді.
УДК 669. 02/. 09(07)
ББК 34. 314я7
© Каршигина З. Б., Байділдаева Г. Б., 2008
© С. Торайғыров атындағы Павлодар мемлекеттік университеті, 2008
Кіріспе
Электролиздің ашылуы әдеттегі химиялық әдістермен іске асыру қиын болатын тотығу-тотықсыздану үрдістерін оңай өткізуге мүмкіндік берді.
Электролиз техникасының дамуы металдардың табиғи қосындыларын тотықсыздандыру үшін катодтағы электр тогын пайдаланатын электрометаллургияны дүниеге әкелді.
Құрамында металдар бар су ерітінділерінен электролиз арқылы металдарды алу деп аталады. электролиттік тазарту және электроэкстракцияға бөлінеді.
Электроэкстракциялау кезінде технологияның аралық өнімдерін немесе құрамында металл бар кен материалдарын сілтілеудің нәтижесінде алынған ерітіндіден металды бөліп алады.
Электролиттік тазарту металды қосындылардан тазарту үшін пайдаланылады. Электролиз үрдісі кезінде тазартуға арналған металдан жасалған электродтардың біреуі тотығып, иондар түрінде ерітіндіге өтеді, сонан соң металдың осы иондары келесі электродта тотықсызданады.
Су ерітінділерін электролиздеу үрдістерін әлемдегі барлық елдерде шығарылатын мысты және никельдің, мырыштың, алтынның, күмістің, кадмийдің көпшілігін, сурьманың, қорғасынның, қалайының және басқа түсті және сирек металдардың едәуір бөлігін алу кезінде пайдаланады.
Балқытылған тұздарды электролиздеу таза химиялық тотықсыздануы үлкен қиыншылыққа әкелетін металдарды тотықсыздандыруға мүмкіндік берді.
Cондықтан, металдардың электролиттік әдіспен бөлінуі жайлы негізгі теориялық білім алуы, тәлімгерлердің электролиз үрдісінің ғылыми талдауы жайлы мағлұмат және тәжірибе жинауы өте маңызды деп табылады.
1 Зертханалық жұмыс. Су ерітінділері электролизі кезіндегі ауыр металдардың токтық және энергиялық шығымын анықтау
1. 1 Теориялық негіздер
Электролизден өткен токтың және электродта алынатын зат мөлшерінің арасындағы сандық байланыс Фарадеймен бекітілген.
Фарадей заңы бойынша электродта алынған заттың мөлшері, электролизден өткен ток мөлшеріне пропорционал
g = q∙J∙τ (1)
мұндағы g - электродта бөлінген заттың мөлшері (г)
q - коэффициент (электрохимиялық эквивалент) :
J∙τ = 1 А∙сағ, g = c болғанда.
Әрбір заттың бір грамм-эквивалентінің электролиттік бөлінуі үшін 96500 кулон немесе 26, 8 А∙сағ қажет.
Олай болса
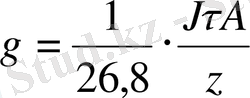 (2)
(2)
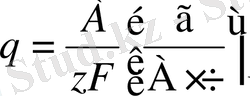 (3)
(3)
мұндағы А - бөлінетін заттың атомдық салмағы;
z - реакцияға қатысатын электрон саны.
Электролизда өтетін барлық сандық өзгерістер Фарадей заңымен сәйкес өтсе де, тәжірибеде бұл заңнан ауытқулар көрінеді. Бұл ауытқулар электролиз кезіндегі жанама электрохимиялық және екінші ретті химиялық реакцияның өтуімен негізделген, олар негізгі үрдістегі токтың пайдалануын азайтады.
Электролиз кезіндегі токты пайдаланудың ПӘК-і, токтық шығыммен сипатталады
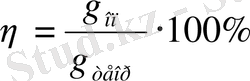 (4)
(4)
мұндағы g on - электродтағы бөлінген заттың мөлшері;
g теор - Фарадей заңы бойынша (теориялық тұрғыда)
сол мөлшерде өткізілген ток кезінде бөлінуі
тиіс болған заттың мөлшері.
Негізгі электролизбен қоса жүретін жанама электрохимиялық реакциялар электрлігі оң қоспаларының иондарының тотықсыздану үрдістері бола алады. Мысалы, мырыш электролизі кезінде, зиянды қоспалар мышьяк, мыс, никель, кобальт, сутегі иондары болады.
Бірнеше тотығу дәрежесін беретін металл тұздарының электролитте қатысуы, электролиз үрдісіне қатты зиян келтіреді. Бұл металдардың иондары катод жанында тотықсызданады (мысалы - темір ионы) .
Электролитте тотықтырғыштардың қатысуы да (мысалы, мырыш электролизі кезіндегі марганец иондары) токтық шығымның азаюына әкеледі.
Электродтарда алынған өнімдер, электродты құраушыларымен әрекеттесуге кіруі мүмкін. Кіші полюсаралық қашықтықтар кезінде, электролиз өнімдерінің өздері бір-бірімен әрекеттесе алады. Осының барлығы токтық шығымды азайтады. Электролиздің техникалық өткізілуі кезінде токтың және энергияның толығырақ пайдалануын қамтамасыз ету өте маңызды. Энергияны үнемдеу үшін былаудағы кернеуді мүмкіндігін азайтуға ұмтылу керек. Былаудағы кернеу электролит және электродтардың омдық кедергі арқылы, ыдырау кернеуімен (U нр ), электрод поляризациясымен (∆U пол ), және кернеудің түсуімен анықталады (ΣJR)
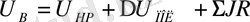 (5)
(5)
Кернеу ыдырауының шамасы электролит концентрациясымен және электродта тотықсызданатын заттардың физика-химиялық қасиеттерімен анықталады. Электролиттегі электрөткізгіштікті жоғарлату үшін, оған иондарының қозғалысы жоғары тұздар немесе қышқылдар енгізіледі.
Электродтардың жақындауы ΣJR шамасын азайтады. Бірақ, сонымен бірге электролиз өнімдерінің әрекеттесу мүмкіндігі жоғарлайды.
Электролит температурасының жоғарлауы U нр және ΣJR төмендеуіне әсер тигізеді, бірақ сутегі бөлуінің асқын кернеуін төмендетеді.
Электролиттің белсенді араластырылуын қамтамасыз ету арқылы, концентрациялық поляризацияның шамасын азайтуға болады.
Токтың тығыздығын анықталған шектерде ұлғайту, электролиз үрдісін қарқындатады, бірақ сонымен қатар поляризацияның ұлғаюына соқтырады.
Сонымен, электролиздің әрбір параметрі оң және теріс әсеріне қарай оптималды таңдалады. Бір грамм заттың электролизбен бөліну үрдісінің энергия шығыны осы теңдеумен анықталады
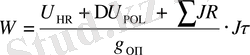 ; [
; [
 ] (6)
] (6)
Ерімейтін анодпен электролиз жағдайы үшін энергияның пайдалану дәрежесі немесе энергиялық шығым келесі теңдеумен беріледі
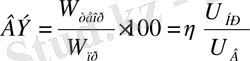 (7)
(7)
Металды электролиттік тазарту үрдісі кезінде, егер анод пен катодтың құрамы жақын және электродтардағы токтық шығым бірдей болса, онда катодта бөлінген металдың мөлшері, анодта ерігенге эквивалентті болады. Былаудағы кернеу мына шамалармен анықталады
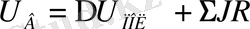 (8)
(8)
осы жағдайда ыдырау кернеуі нөлге тең болғандықтан. Сондықтан, тазарту үрдісі энергияның шығу қатынасымен бағаланбайды да, энергиялық шығыммен есептеледі.
1. 2 Жұмыстың мазмұны
- кадмий, мыс немесе мырыш ерітіндісінің электролизін және мыстың электролиттік тазартуын жүргізу;
- токтық және энергиялық шығымын анықтау;
- энергияның меншікті шығынын есептеу.
1. 3 Жұмыстың орындалу әдістемесі
Оқытушының тапсырмасы бойынша ерітіндіден мыстың, мырыштың немесе кадмийдің электролиттік тұндыруын жүргізу. Мысты электролиттік жол арқылы тазарту еритін мыс анодымен және құрамында 85 г/л мыс сульфаты және 225 г/л бос күкірт қышқылы бар электролиттегі алюминий катодымен және еритін мыс анодымен жүргізіледі. Қандай болса да металды ерітіндіден электролиттік алу берілген ток тығыздығы кезінде сәйкес ерітіндіден ерімейтін қорғасын анодпен және алюминий катодымен жүргізіледі. Электролиз және тазарту бір уақытта тізбектеліп қосылған екі электролиздегіште өтеді. Электрлік тізбекке өткен электрдің мөлшерін анықтау үшін электролиздегішпен тізбекті мыс кулонометрін қосады. Кулонометрде анод ретінде мыс пластинкасы болады, катод мыстан немесе алюминийден жасалынған бола алады. Кулонометрдегі ерітіндіге электродты батыру тереңдігі токтың катодты тығыздығының оптималды мөлшеріне (1-2 А/дм 2 ) қарап есептелінеді. Құрамында CuSO 4 ∙ 5H 2 O - 150 г/дм 3 ; этил спирті - 50г/дм 3 ; H 2 SO 4 (1, 84) - 50г/дм 3 «кулонометрге арналған» электролитпен кулонометрді толтырады.
Тәжірибені өткізгеннен кейін кулонометрге арналған ерітіндіні, ерітінділерді сақтауға арналған, ыдысқа қайта құяды. Кулонометр және электролизер катодтарының бетін тәжірибе алдында жұқа қайрақ қағазбен тазартады, сода ерітіндісімен майсыздандырады, сумен жуып, кептіреді және өлшейді.
Егер алюминий катодтарының бетінде оның алдындағы тәжірибеден қандай да бір металл тұнбасы қалса, онда оны тазарту алдында азот қышқылында улау қажет. Сұлбаның дұрыс жиналғанын тексергеннен кейін және реостатты енгізгеннен кейін электродтарды ерітіндіге батырады, ток көзін қосып, қажетті ток мөлшерін белгілейді. Тәжірибе барысында белгіленген тұрақты ток күшін сақтайды.
Былаулардағы кернеуді әр 10 минут сайынғы интервалмен тіркейді. Электролиз аяқталғаннан кейін, катодты тұнбалардың электролитте еруін алдын алу үшін, ток жүктемесін алмай, катодтарды бір уақытта суырып алады. Катодтар сумен жуылып кептіріледі және өлшенеді. Токтық шығым электролиздегіш катодтарының және кулонометр өсімі бойынша анықталады.
Фарадей заңына сәйкес, катодта бөлінуге тиіс болатын металл мөлшерін мыс кулонометрі катодының өсімімен есептеледі
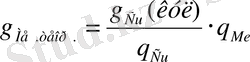 (9)
(9)
және токтық шығым
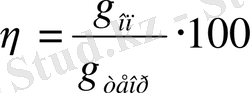 (10)
(10)
Сәйкес металды бөлу үшін меншікті энергия шығынын есептейді
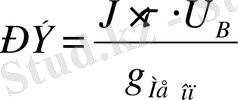 ; [Bт∙ч/г] (11)
; [Bт∙ч/г] (11)
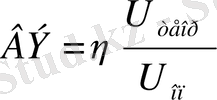 (12)
(12)
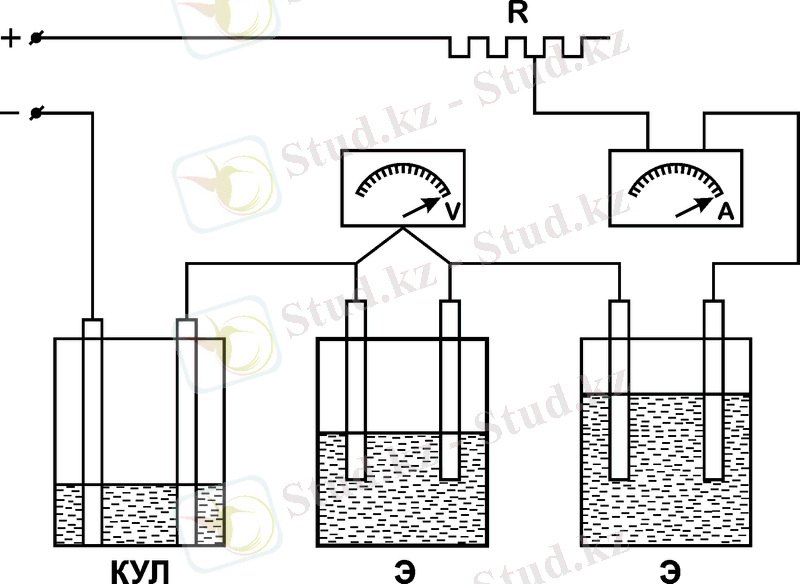
1 сурет - Сулы ерітіндіден ауыр металдарды электролиттік тұндыру қондырғысының сұлбасы
Жұмысты орындау үшін білуге қажетті сұрақтар
1 Фарадей заңдары.
2 Токтық және энергиялық шығым.
3 Электролиз кезіндегі электродтардағы үрдістер.
4 Ыдырау кернеуі, былаудағы кернеу.
5 Кулонометрдің құрылғысы және қолдануы.
6 Тазарту кезіндегі электродтардағы үрдістер.
2 Зертханалық жұмыс. Өтеу (компенсация) әдісі бойынша гальврникалық элементтің электр қозғаушы күшін өлшеу
2. 1 Теориялық негіздер
Металды өз тұзының ертіндісіне тиегенде кристалды тордың торабында орналасқан металл иондарына, едәуірі дипольді моменті бар еріткіштің молекулалары әсер етеді. Судың полярлы молекулалары, беттегі сәйкес металл катионына бағдар алып, олардың ертіндіге өтуін қамтамасыз етеді
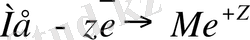 (13)
(13)
Катионның ертіндіге ауысуы металл мен ерітіндінің электрлік бейтараптығын бұзады: металл беті артық теріс, ал ерітінді - оң немесе керісінше заряд алады.
Ерітіндіге ауысқан катион ерітіндінің көлемінде жылжымайды, себебі ол электростатикалық арақатынас арқылы теріс зарядталған пластина бетінде ұсталынады. Металл бетіндегі катиондардың концентрацияларының ұлғаюымен және металдың заряд өлшемінің бір уақытта өсуі катионның металѓа ауысуына кепілдік береді. Металл зарядының белгілі бір өлшемінде металл катионының ертіндіге ауысуы және оның металдағы тотықсыздануы бірқалыпты болуы мүмкін, яғни мына реакция бойынша
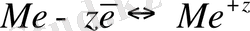 (14)
(14)
қайтымды және олар бірдей жылдамдықпен жүреді. Егер тотығу реакциясының жылдамдығын V ок деп белгілесек, ал кері реакцияның жылдамдығын V вост , онда тепе-теңдік кезінде V ок = V вост . Бұл жүйедегі үрдістердің тоқталмайтындығын, яғни тотығу мен тотықсызданудың кері үрдістері бірдей жылдамдықпен және металл мен оған қатысты электролит қабатының потенциалдарының әр түрлілігімен сипатталатынын көрсетеді.
Тепе-теңдікке жауап беретін концентрациядағы металл бетінде жинақталған катиондар, металл бетіндегі артық электрондармен ерітіндінің тереңдігіне кете алмайды. Соның нәтижесінде қосарланған электрлік қабат түзіледі, ол 2-суретте сұлба түрінде көрсетілген
- + + + -
- + + - +
- + - + -
- + + -
δ 0 λ
ψ ψ 1
μ
φ
2 сурет- Қосарланған электрлі қабаттың сұлбалық көрінісі
Катиондардың біршама мөлшері металл бетінің қабатына жақын орналасады; мұнда потенциалдың барлық ауытқуы жүреді /
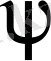 /. Потенциалдың жалпы түсуі
/. Потенциалдың жалпы түсуі
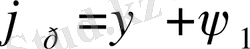 . Тепе-теңдік потенциалы Нернст теңдеуімен анықталады
. Тепе-теңдік потенциалы Нернст теңдеуімен анықталады
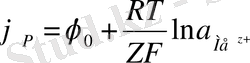 (15)
(15)
Стандартты потенциал
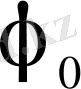 көрсеткіші константамен анықталады, бұл берілген электродқа тән. Ол өз тұзының электролитіне енгізілген, белсенділігі а=1 болғанда, мұнда а-электролиттегі металл иондарының белсенділігі
көрсеткіші константамен анықталады, бұл берілген электродқа тән. Ол өз тұзының электролитіне енгізілген, белсенділігі а=1 болғанда, мұнда а-электролиттегі металл иондарының белсенділігі
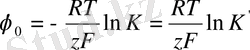 (16)
(16)
мұндағы
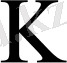 - реакцияның тепе-теңдік константасы.
- реакцияның тепе-теңдік константасы.
 =
=
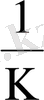
Катионға қатысты қайтымды электрод потенциалы қарастырылады, оны бірінші типті электрод дейді. Тепе-теңдік потенциалы анионның электродты реакциясына ортақ анионы бар жақсы және қиын еритін тұздың қатысу кезінде пайда болатын, электродтарды қарастырайық. Бұл электрод потенциалының қайтымдылығы катионға ғана қатысты емес, ол анионға да қатысты. Мұндай электродтар екінші типті электродтар деп аталады және оның тепе-теңдік потенциалы мына формуламен анықталады
 =
=
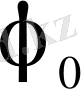 -
-
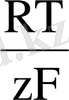 ln
ln
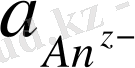 (17)
(17)
Электролитке батырылған кез-келген екі электрод электрохимиялық тізбек түзуі мүмкін. Осындай тізбектің ЕҚК -і
Е=
 (18)
(18)
2. 2 Жұмыстың мазмұны
Гальваникалық элементтердің ЕҚК- ін өлшеу, тепе-теңдік потенциалын есептеу.
2. 3 Жұмыстың орындалу әдістемесі
Гальваникалық элементті құрайды. Компенсациалық сұлбаны жинау және ЕҚК -ін өлшеу.
Металды электродтарды тотықтардан қайрау қағазымен тазартады да 30 сек уақыт аралығында азот қышқылына батырады, содан соң электродты тазартылған сумен шайып, оны сүзгілік қағазбен сүртеді де басқа қайрақ қағазбен жылтырлатылады.
Жарты элементтер үшін ыдысқа электродтарды тығыз орналастырады, сол ыдыс алдын ала хромды қоспамен жуылады (сумен араластырмайды) . Оны жуғаннан кейін ертіндіні хромды қоспасы бар ыдысқа қайта құяды да, дистиллденген сумен шайып кептіреді. Ертінділер мен электродтар оқытушының тапсырмасымен ғана беріледі. Таза құрғақ кішкентай стақанға құйып, мысалы ZnSO 4 ерітіндісін, одан сол жарты элементке ертіндіні тартады, мұнда мырышты электрод орналастырылады. Ерітінді ыдыстың 2/3 бөлігін толтыруы қажет. Толтыру кезінде жарты элементтің ұшында ауа көпіршіктерінің тұрып қалуын болдырмау керек. Қайткенімен бұл жағдай орын алса, онда ерітіндіні үрлеу және тарту арқылы оны жарты элементтен кішкентай стақанға қайтарады. Дәл сол сияқты мыс электродты жарты элементті CuSO 4 ерітіндісімен толтырады. Аралық кішкентай стақанды қаныққан KCl ерітіндісімен толтырып, оған мырыш және мысты жарты элементтің ұштарын тиейді. Құрылғының сұлбасы 3-суретте көрсетілген.
Аккумуляторлы батареядан 2В кернеуін шешіп, дайындалған элементтің химиялық тізбегін ауыстырып қосқыштың клеммасына қосады. Осы кезде оң электрод аккумулятордың оң полюсына қарсы орналасуы керек. Осы тізбекке паралельді түрде Вестон нормальді элементін қосады да, содан кейін қысқа уақытқа «К» кілтімен токты қосып, гальванометр тілшесінің ауытқуын бақылайды. Кілттің қысқа уақытты тұйықталуы кезінде «С» контактін қозғалтады, сол арқылы гальванометр тізбегіндегі токтың жоғалуына қол жеткізеді. Компенсацияға сәйкес «С» контакты қалпын жазып алады. Содан кейін ауыстырып қосқыш «П» өлшенбелі тізбекке қосылады; сондай-ақ компенсацияға ұмтылады және реохордтағы «С» контактінің орналасуын белгілейді.
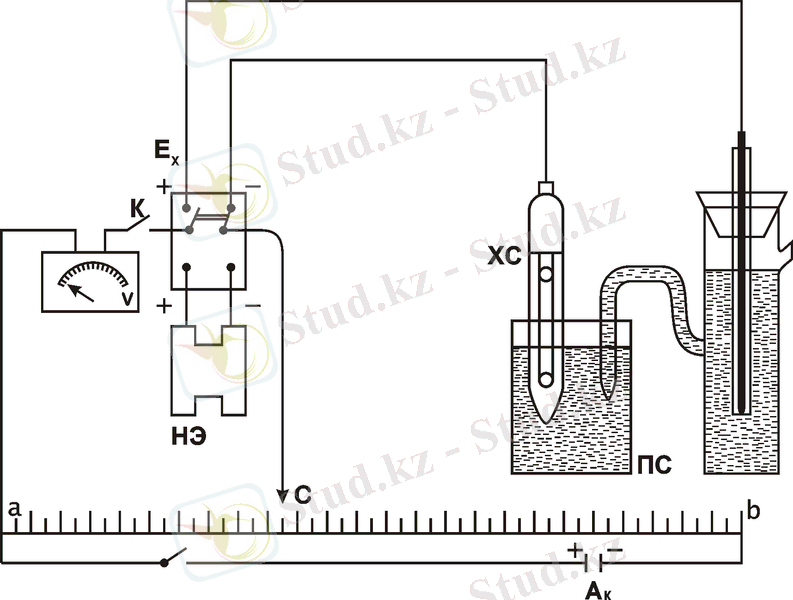
3 сурет- Компенсация әдісі арқылы гальваникалық элементтің электрқозғаушы күшін өлшеуге арналған сұлба
Егер нормальді элементі бар тізбекті компенсациялау кезінде «С» контактін АС кесіндісімен белгілесек, ал компенсация кезіндегі өлшенбелі тізбекті АС / кесіндісі деп алсақ, онда
Е
х
=Е
н
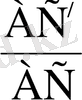 (19)
(19)
мұнда Е н - нормальді элементтің ЕҚҚ- і;
Е х - өлшенбелі тізбектің ЕҚҚ- і.
Алынған мәліметтерді кестеге енгізеді.
1- кесте - Алынған мәліметтердің нәтижелері
Гальваникалық
элемент
Электродты потенциалдарды анықтау үшін салыстыру электроды ретінде хлоркүмісті жарты элементін қолданады.
Жартылай элементтің бірін сұлбадан ажыратып, оның орнына салыстыру электродын орнатады, одан кейін АС пен АС΄-ті қайта анықтайды. Бұл жаңа жұп үшін Е х шамасын есептейді. Анықталған өлшем нәтижелерін кестеге енгізеді. Е х шамасынан хлоркүмісті электрод потенциалын біліп
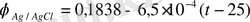 , (20)
, (20)
екінші электрод потенциалын есептейміз. Ол үшін екінші тізбектегі электродтардың қайсысы оң, қайсысы теріс екенін білу қажет. Гальваникалық элементтің ЕҚК-і, оның электродтарының потенциал айырмасы болып табылады Е=
 . Соған ұқсас өлшеулер мен есептеулер барлық жарты элементтер үшін жүргізіледі. Алынған мәндерге сәйкес екі жарты элементтің (электродтардың) электрод потенциалын есептеп, сұлба бойынша тікелей өлшеніп алынған және теңдік бойынша есептелген элементтің ЕҚК-ін салыстырады. Бұл есептеу кесте бойынша және теңдеумен анықталуы қажет. Мысалы, Сu-Zn тізбегі үшін өлшенген ЕҚК-інің элементін Е=
. Соған ұқсас өлшеулер мен есептеулер барлық жарты элементтер үшін жүргізіледі. Алынған мәндерге сәйкес екі жарты элементтің (электродтардың) электрод потенциалын есептеп, сұлба бойынша тікелей өлшеніп алынған және теңдік бойынша есептелген элементтің ЕҚК-ін салыстырады. Бұл есептеу кесте бойынша және теңдеумен анықталуы қажет. Мысалы, Сu-Zn тізбегі үшін өлшенген ЕҚК-інің элементін Е=
 теңдеуі арқылы есептелген ЕҚК-імен салыстырады. Егер жұмыс барысында компенсация нүктесі табылмаса, онда элементтегі полюстілікті алмастырады да, оның ЕҚК-ін өлшейді: сұлбадағы оң полюске қосылған электродты теріс және керісінше қосамыз. Оқытушы берген өлшемдер әр түрлі температурадағы металдармен және түрлі концентрациядағы ерітінділермен жүргізуге болады.
теңдеуі арқылы есептелген ЕҚК-імен салыстырады. Егер жұмыс барысында компенсация нүктесі табылмаса, онда элементтегі полюстілікті алмастырады да, оның ЕҚК-ін өлшейді: сұлбадағы оң полюске қосылған электродты теріс және керісінше қосамыз. Оқытушы берген өлшемдер әр түрлі температурадағы металдармен және түрлі концентрациядағы ерітінділермен жүргізуге болады.
Реохордты қолданылып жүргізілетін жұмыстың әдістемелік мақсаты бар, мұнда студент сұлбаны құрастыруды үйреніп біледі. Қалған жұмыстар потенциометрдің көмегімен жүргізіледі.
Жұмысты орындау үшін білуге қажетті сұрақтар
1 Нормальді және тепе-теңдікті электрод потенциалдары.
2 Гальваникалық элементтің ЕҚК-і .
3 Тепе-теңдік потенциалдар мен гальваникалық элементтің ЕҚК-ін
өлшеу.
4 Нормальді элементтің және хлоркүмісті жарты элементтің
құрылғысы.
5 Электрохимиялық тізбектердің түрлері.
3 Зертханалық жұмыс. Ауыр металдар тұздарының сулы ерітіндісінің ыдырау кернеуін өлшеу
3. 1 Теориялық негізідер
Металл электродының тепе-теңдік потенциалы, термодинамикада белгілі Нернст теңдеуі бойынша анықталады
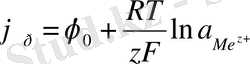 (21)
(21)
мұндағы φ 0 - стандартты электрод потенциалы;
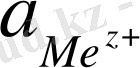 - берілген металл иондарының ерітіндідегі белсенділігі.
- берілген металл иондарының ерітіндідегі белсенділігі.
Тұрақты тепе-теңдік потенциал секірісінің болуы кенет өзгеруінің екі фаза арасындағы динамикалқ тепе-теңдікпен, яғни тотығу және тотықсыздану реакцияларының жылдамдықтарының теңдігімен, сипатталады.
Егер электродқа сыртқы тоқ көзінен тепе-теңдік потенциалынан ерекшеленетін потенциал беретін болса, онда тепе-теңдік потенциалына қарағанда артығырак оң потенциалды салу кезінде электродтың (анодтың) еруі жүреді. Ал тепе-теңдікке қарағанда потенциалы теріс болғанда, онда катодта ерітіндідегі иондардың тотықсыздануы жүреді. Осыдан өзге металл тұзы мен инертті платиналы электродымен металл тұздарының электролизі үшін, катодты металл потенциалы - ертіндіге (φ к ) дейін және анодты оттекті потенциалы - ерітіндіге (φ а ) дейін поляризациялау үшін жететін, қайсібір белгілі кернеуді қосу қажет, (анион ОН + тотықсыздану жағдайында) .
Электролиз өнімдерін тұрақты алуы үшін инертті электродтармен электролиз жүргізе алатын минималды кернеу, ыдырау кернеуі болып табылады.
Электродтарға қосылған кернеу тепе-теңдік потенциалдарының қосындысынан үлкенірек шексіз аз шама болғаннан кейін ғана электолиздің өтуі мүмкін болады. 4-суретте ертінді (J) арқылы өтіп жатқан токтың берілген потенциалдар айырмасынан (U) тәуелділігі көрсетілген.
4-суретте көрінгендей, белгілі мәнге дейінгі потенциалдар айырмасының қисығы J-U, U осінің тұсынам өтеді және осында электолиз құбылысы байқалмайды. Жүйеде қалдық деп аталатын ток өтеді. Оның пайда болуы катодтаға белсенді иондардың тотықсыздануымен түсіндіріледі, олар ертінділерде аз мөлшерлерде болады; одан басқа, катодта тотықсыздану реакциясы болуы мүмкін. О
2
→
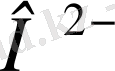 - нөлге жақын. Анодта осы реакция болуы мүмкін
- нөлге жақын. Анодта осы реакция болуы мүмкін
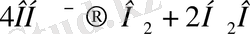 (22)
(22)
Пайда болған оттегінің электролитте еруі, (22) реакцияға қарағанда, потенциалдың төмендеуіне әкеп соғады. (22) реакцияда қосымша қуатты, қажет ететін жаңа газды фаза пайда болады, яғни потенциалдың жоғарылауы болады.
Орнатылған потенциалдар айырмасы ыдырау кернеуіне жеткеннен кейін J-U қисығы күрт жоғары көтеріледі. Осы сәттен еріген тұз электролизге ұшырап, электродтарда электролиз өнімі көп бөлінеді. Токтың электролизер арқылы өтуі, электродтардың қайтымсыздығына және олардың поляризациясына әкеледі.
J
U HP ΣJR ∆U пол
U HP U
4 сурет - Ерітінді арқылы өткен токтың салынған потенциалдар айырмасынан тәуелділігі
Ток өткен кезде электродтардың потенциалдары өзгереді: олар тепе-теңдік және стационарлы мәндерге қарағанда, катодтың потенциалы теріс, ал анод потенциалы оң болады (5 сурет) .
Тепе-тендік потенциалдардың алгебралық қосындысы қайтымды кернеу деп аталады
U обр = φ ра - φ рк (23)
Электролиз жүре алатын минималды потенциалдардың алгебралық қосындысы - ыдырау кернеуі деп аталады
U нр = φ ра + Δφ а - (φ рк - Δφ к ) (24)
Δφ → 0 болғанда.
Осылай электролиз кезінде балаудығы кернеу ыдырау кернуінен, концентрациялық және химиялық поляризациядан, электрод пен электролитте кернеудің төмендеуінен құрылады
U
в
= U
нр
+ U
пол
+
 (25)
(25)
5 сурет - Электролиз жүруін түсіндіретін поляризациялық қисықтарының сұлбалық көрінісі
Бір металдан шыққан және сол металдың тұзды ертіндісіне батырылған, потенциалдары бірдей (тепе-тендік) екі электродтарға сырттан біраз кернеу салынған жағдайларды қарастырайық. Теориялық тұрғыдан анодты және катодты үрдістер қайтымды болған кезде ерікті аз кернеу болғанда электролиз басталуы тиіс. Тепе-теңдік потенциалдарының теңдігін ескере отырып, катод пен анодта ыдырау кернеуі нөлге тең болған жағдайда, ал электролиз кезіндегі кернеу, омдық кедергі арқылы кернеудің төмендеуі және поляриациялық құбылыстар арқылы анықталады. Осы жағдай металдарды электролиттік тазарту кезінде көрінеді.
3. 2 Жұмыстың мазмұны
Электролиздегіштің клеммаларындағы кернеуді екі ерітіндімен (әр түрлі немесе түрлі концентрациялы) түрлі тоқ тығыздығы кезінде өлшеп, сол бойынша сызба салып, тұздардың ыдырау кернеуін анықтау. Қондырғы сұлбасы 6-суретте көрсетілген.
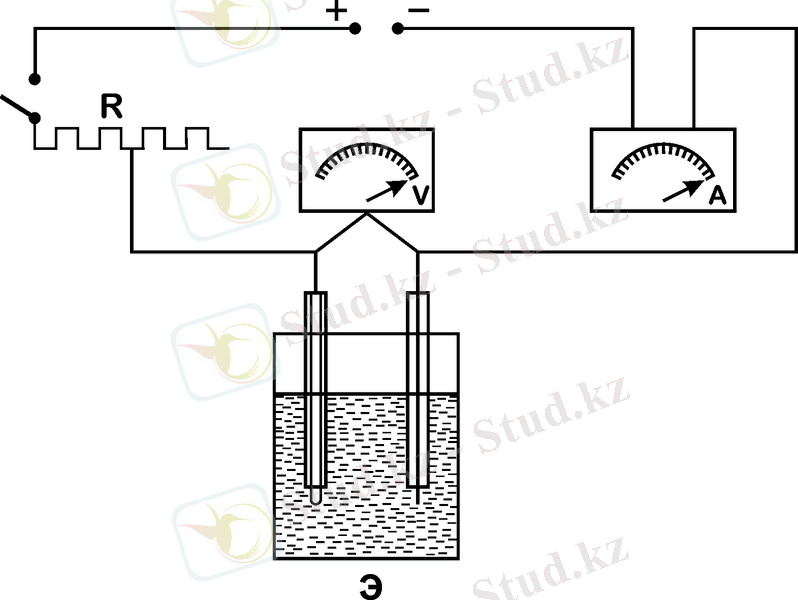
6-сурет - Ауыр металл тұздарының сулы ерітіндісінің ыдырау кернеуін өлшеуге арналған қондырғы сұлбасы
3. 2 Жұмыстың орындалу әдістемесі
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz