Аммиак пен аммоний тұздарын алу: шығу тарихы, физико-химиялық қасиеттері және өндіріс технологиясы


Аммиак және аммоний тұздарын алу.
Мазмұны.
- Шығу тарихы . . .
Негізгі бөлім.
2. 1. Физикалық, химиялық қасиеттері . . .
2. 2. Аммиак өндірісінің химиялық негізі . . .
2. 3. Алынуы.
2. 5. Аммоний тұздары және олардың қасиеттері . . .
2. 6. Аммоний ионының сапалық реакциясы . . .
. Пайдаланылған әдебиеттер . . .
Шығу тарихы.
Ауада азот бар екендігі Қытайда VIII ғасырда Мао - Хоаның жұмыстарында жазылған. Европада, азоттың ашылуы ауаның күрделі қоспа екендігін білумен қабат жүрді. Осы бағытта азот алған 1772 жылы зерттеген Даниэль Резерфорд оның дем алуға, жануға жәрдемсіз екендігін анықтап «улы ауа» деп атаған, сол жылы, ағылшынның екінші ғалымы Пристин азотты басқаша жолмен алып «флогистонданған ауа» деп ат қойған. 1773 жылы Карл Вильгелм Шееле ауаның екі газдан тұратынын оның бірі «бұзылған ауа» екендігін анықтайды. Сол уақытта Кавендиш те (Англия) сондай қорытындығы келеді. 1776 жылы Антуан Лоран Лавуазье осы айтылған «улы», «флогистонданған», «бұзылған ауаны» тексеріп соның барлығы бір заттың екендігіне көзі жетіп ауаның бұл бөлігін азот «грекше «а» өзінен кейінгі сөзді теріс мағынаға аударатын жоқ екендігін бөлек «зоэ» - тіршілік») тіршіліксіз деп, азотсыз тіршіліктің жоқ екендігін білмегендіктен. Лавуазе азотқа қате ат қойған. Азотты ангио-саксон тілінде сөйлейтін елдерде Nitrogen «селитра жуғызушы» неміс тілінде Stickstoff - «тұншықтырғыш» материя» деп атайды.
Аммиак.
Молекула құрылысы. Азот сутегімен бірнеше қосылыс түзеді, олардың ішіндегі ең маңыздысы аммиак болып саналады. Аммиактың молекуласының электронды формуласы мынадай:
Н
N : H
H
Азоттағы төрт электрондық жұптың үшеуі жалпы байланыстырғыш, ал біреуі бөлінбеген байланыстырмайтын екендігі көрініп тұр.
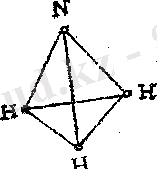
NH 3 молекуласының құрылысы бұрынырақ қарастырылған. (3. 4-сурет қара) . Оның пішіні пирамида тәрізді. Химиялық байланыс N-H полюсті оң заряд сутегі атомдарында, теріс-азот атомында топтасқан. Осының нәтижесінде аммиак молекулаларының арасында сутектік байланыс түзіледі, оны мына түрде бейнелеуге болады:
 -
-
 H
H
H N: . . . H -N:
H H
1сурет. NH 3 -молекуласындағы химиялық байланыстың түзілу схемасы.
Сутекті байланысының арқасында аммиактың қайнау және балқу температурасы, сол сияқты булану жылуы бір шама жоғары болады, оңай сұйылады.
Органикалық заттардың шіруі нәтижесінде түзіліп бөлініп шығады, ауада әрдайым аз ғана мөлшерде араласқан түрде, әсіресе халық тұратын жерде болады.
Аммиакты алудың бірнеше әдісі бар, олардың ішінде маңыздысы, әрі осы кезде көп қолданылатыны - аммиак синтезі деп аталатын азот пен сутекті тікелей қосатын әдіс:
N
2
+ 3H
2
 2NH
3
2NH
3
 H
0
=-92, 04кДж/моль.
H
0
=-92, 04кДж/моль.
Бұл тепе-теңдікті аммиак шығатын жаққа қарай аудару үшін үлкен қысым керек: аммиак шығатын жақтың реакциясы экзотермиялық болғандықтан, жоғары температура қолайлы болмайды. Көп зерттеулерден кейін қолайлы деп табылған жағдайдың бірі -10 7 =10 8 Па, 400-500 о С, К 2 О және AI 2 O 3 араластырылған темір катализатор. Соның өзінде аммиактың шығымы 15-20%; түзілген аммиакты ажыратып алу үшін газдар қоспасын салқындатып, аммиакты конденсациялайды. Реакцияласып үлгірмеген азот-сутек қоспасына қажетті мөлшерде азот пен сутекті қосып процеске қайта жібереді (рециркуляция) (Аммиактың синтезінің технологиясы орта мектеп оқулығында біраз толық жазылған) . Аммиак алудың екінші бір әдісі цианамид әдісі, ол кальций карбидінің азотпен тікелей қосыла алатындығына негізделген.
Алдымен кальций карбидін алу үшін кальций оксидін (СаО) не әктасын (СаСО 3 ), таскөмірмен араластырып электр пеште қыздырады:
СаО + 3С=СаС 2 + СО
Қыздырған кальций карбидінің бір жеріне туралап азотты үрлейді. Сол арада карбид пен азот реакцияласады.
СаС
2
+N
2
= CаСN
2
+C
 H
0
=-289, 5кДж/моль.
H
0
=-289, 5кДж/моль.
Реакциядан бөлініп шығатын көп жылу айналадағы карбид массасын қыздырып реакция қуалап, карбид реакцияласп болған кезде ғана тоқтайды.
Кальций цианамиді қара сұр түсті ұнтақ: осыған 110 о С -қыздырылған және 600 кПа қысылған су буын жіберсе мынадай реакция жүреді:
СаСN
2
+ 3H
2
O = CaCO
3
+ 2NH
3
 H
0
=-75, 3кДж/моль.
H
0
=-75, 3кДж/моль.
1904 жылдан 1920 жылдарға дзейін аммиакты ционамид әдісімен алып келеді, одан бергі жерде аммиак алатын заводтердың барлығы, алғаш 1913 жылы шыққан синтез әдісіне сәйкес салынады.
Лабароторияда аммиакты мына реакция бойынша алады.
Са(ОН) 2 + 2NH 4 CI = CaCI 2 + 2NH 3 +2H 2 O:
Жер жүзінде өндірілетін аммиактың 75 проценті тыңайтқыш жасауға жұмсалады, фосфор және кальийден гөрі азот тыңайтқыштарының қолданылуының күшті дамуы аммиак алудың арзан жолдары аммиакты: а) мұнай өңдейтін заводтардың риформингторынан шығатын газдардан. б) кокс пештерінің газдарынан. в) табиғи газдардан алу.
Лабароториялық жағдайда аммиакты алюминий хлориді мен сөндірілген әктің қоспасын әлсіз қыздырып алады.
2NH
4
CI + Ca(OH)
2
= CACI
2
+ 2NH
3
 +2H
2
O
+2H
2
O
Бұл реакция гидроксид - иондарын қосқандағы аммиактың сумен әрекеттескендігі тепе-теңдіктің ығысуына негізделген.
NH
4
+
+OH
 NH
3
NH
3
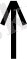 + H
2
O
+ H
2
O
Аммиакты алудың негізгі өндірістік әдісі оны азот пен сутегінен синтездеу болып есептеледі. Бұл қайтымды және экзотермиялық реакция
N
2
+ 3H
2
 2NH
3
2NH
3
 H
0
=-92, 4кДж.
H
0
=-92, 4кДж.
Бұл тек қана құрамында активаторлар - алюминий, калий, кальций, кремний оксидтері бар кеуек темір катализатор қатысқанда жүреді. Бастапқы өнімдер: азотты - сұйық ауадан, сутегіні - конверциялық әдіспен немесе судан алады.
Конверция әдісімен басында су буын 1000 0 С-дейін қыздырған кокс арқылы өткізіп су газын алады.
С + Н 2 О = CO + H 2
Одан кейін су газы мен су буының артық мөлшерінен қоспасын 400-450 0 С дейін қыздырылған катализатор Fe 2 O 3 арқылы өткізіп көміртегі (ІІ) оксидін көміртегі (ІҮ) оксидіне дейін тотықтырады.
СО +(Н 2 ) + Н 2 О = CO 2 + H 2 + (H 2 )
Түзілетін көміртегі (ІҮ) оксидін сумен сіңіреді. Бұл әдіспен өндірістік сутегінің 50% астамын алады.
Аммиактың көп мөлшері азот қышқылын, азоты бар тұздар, мочевина, аммиак әдісімен соданы алуға болады. Оңай сұйылуына және одан әрі жылу сіңіре булануына сай оны тоңазытқыш ісінде қолданылуы негізделген. Сұйық аммиак және оның сулы ерітінділері сұйық тоңазытқыш ретінде қолданылады.
Аммиак өндірісінің химиялық негізі.
Жай заттардан аммиакты синтездеу теориясы біршама күрделі. Бұл жерде химиялық тепе-теңдіктің ығысу принципіне негізделген процестің оптималы жағдайы көрсетілген.
Бұл реакция экзотермиялық болғандықтан тамператураның төмендегі тепе-теңдіктің (ығысу принципіне негізделген) аммиактың түзілу бағытына қарай ығыстырылады. Бірақ мұнда бұл кезде реакция жылдамдығы күшті азаяды. Сондықтан да аммиакты синтездеуі 500-550 0 С және катализатор қатынасқанда жүргізуге тура келеді. Катализатор тіке және кері реакцияның жылдамдығын бірдей арттыратындықтан, ал температураның жоғарлауы тепе-теңдікті алғашқы заттар бағытына ығыстырғандықтан бұл жағдайлар өнеркәсіптік өндіріске тиімсіз. Демек, тепе-теңдіктің Ле Шателье принципі бойынша жоғары температураның әсеріне қарсы жоғары қысымды қолдану керек. Аммиак синтездеу үшін 15 тең 100МПа дейін қысым қолданады. Қолданылатын қысымға сай синтетикалық аммиакты алудың үш әдісі бар:
- төменгі 10-15МПа
- орташа 25-30Мпа
- жоғарғы 50-100 Мпа қысымды. Кең тарағаны орташа қысымды алу.
Аммиактың түзілу жылдамдығына зиянды қоспалар: күкіртсутек
көміртек (ІІ) оксиді су және тағы басқа теріс әсер етеді. Олар катализатордың активтігін төмендетеді. Сондықтан, азот-сутек қоспасын, әсіресе күкіртті қосылыстарынан ұқыптап тазартады.
Бірақ та бұл жағдайларда тек қана азот-сутек қоспасының белгілі ғана бөлігі аммиакқа айналады. Бастапқы заттарды толық пайдалану үшін түзілген аммиакты сұйылтып, төменгі температурада ал азот-сутек қоспасының әрекеттеспеген бөлігін қайтадан реакторға жібереді.
Реакция өнімімен әрекеттеспеген заттарды боліп алатын, оны одан әрі қарай қолдану үшін реакция апаратына қайтадан жіберетін технологиялық процесті циркулцилық процесс деп атайды.
Осындай циркуляцияның нәтижесінде азот-сутек қоспасының қолдануын 95%-ға дейін жеткізуге болады.
Аммиак синтездеу атмосфералық азотты байланыстырудың негізгі тәсілі болып саналады.
103-сурет. Синтетикалық аммиак өндірісінің схемасы көрсетілген. Сутегінің 3 көлемі мен азоттың 1 көлемі компресермен (1) сорылып қажетті қысымға дейін қысылады. Одан кейін азот сутекті қоспа май бөлшекке (2) (майлардың бөлшерін бөліп алуға) және қатты қыздырған көміртек толтырылған фильтрге барады. Тазартылған қоспаны катализаторы (алюминий, калий, калций, кремний, оксидтері бар кеуек темір) бар контакты аппаратына (4) жібереді, мұнда аммиак түзіледі: 3/2Н
2
+1/2Н
2
 NH
3
NH
3
 H
0
=-46кДж/моль.
H
0
=-46кДж/моль.
Системаны жіберер алдында контакт аппаратын 400-500 0 С дейін қыздырады, ал одан кейін системаның температурасын реакция нәтижесінде бөлініп шығатын жылумен ұстап тұрады. Аммиактың түзілу процесі қайтымды болғандықтан кантакт аппаратынан шығатын газ қоспасының құрамында 20-30% аммиак болады. Бұл қоспаны турбалы салқындатқышқа (5) жібереді. Мұнда аммиак қысымының әсерінен сұйылады.
Реакцияға қатыспаған азот пен сутегі қайтадан циркуляциялық насос арқылы контакт аппаратына (4) жібереді, ал сұйық аммиак жинағышқа (6) жиналады.
Аммиактың физикалық қасиеті.
Аммиак - түссіз, ерекше өткір иісі бар, ауадан екі еседей ауыр газ. Қысымды арттырғанда немесе суытқанда ол оңай сұйылып түссіз сұйықтыққа айналады қайнау температурасы - 33, 4 0 С. Аммиак суда өте жақсы ериді 20 0 С-де судың бір көлемінде NH 3 - тің 700-дей көлемі ериді. Аммиактың молекуласы үш бұрышты пирамида тәрізді. Пирамиданың табанындағы үшбұрыштың бір жағы 0, 16нм пирамиданың биіктігі 0, 038 нм, d(NH) = 0, 102 нм аммиак аудан жеңілірек 1 литр салмағы 0, 77 г. Аммиакты сақтағанда тасығанда, сұйық түрі 6-7*10 5 Па қысымды болат баллондарда ұстайды. Суда өте жақсы ериді: 20градуста 1:700; 0 градуста 1:1200 көлем. Аммиактың суда жақсы еруі, NH 3 пен Н 2 О молекуласының арасында сутектік байланыс түзілуімен түсіндіріледі.
Ерігенде жылу бөлініп шығады. (33, 47кДж/моль) су
 H
0
=-92, 4кДж.
H
0
=-92, 4кДж.
 ерітіндісін кейде мусатыр спирті деп атайды.
ерітіндісін кейде мусатыр спирті деп атайды.
Сатудағы концентрленген еріндісі 25% болады, оның р =0, 91. Қыздырғанда ерігіштігі кемиді. Төмен температурада да ерітіндісінен NH 3 , H 2 O, NH 3, 2H 2 O кристаллогидраттын бөліп шығаруға болады.
Молекуладағы орталық атом түзетін байланысының саны төрттен кем болса да sp 3 гибридизациясы болуы мүмкін бірақ ол атомда бөлінбеген дербес электрон жұбы болуы керек. NH 3 молекуласында Н - N арасындағы байланыс, N атомының p- орбиталдарының таза өзінен емес, аздап sp 3 - гибридизацияға ұшыраған орбиталдардан түзілген. Осының салдарынан азот атомының бөлінбеген 2s - электрон жұбы кеңістіктің бас жағына қарай бағытталады.
Сондықтан NH
3
молекуласы донорлы-акцепторлы әрекеттесуге бейімділік көрсетіп, онда донор қызметін атқарады, өзі әжептәуір полюсті молекула болып (
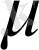 = 1, 46
= 1, 46
 ) табылады.
) табылады.
Бөлінбеген электрон жұбының болуы және Н - N байланысының полюсті болуы, N 3 N молекулаларының арасында сутектік байланыс тудырады.
Сондықтан сұйық аммиакта, аммиактың молекулалары, сутектік байланыс арқылы ассоцияланған. Сұйық аммиактың ассоциациялануымен байланысты, газға айналу жылуы өте үлкен (23, 4 кДж/моль) аммиактың кризис температурасы да жоғары (+133 0 ) сондықтан сұйық аммиак газға айналғанда, ол айналадан көп жылу тартып алады, аммиактың осы қасиетін тоңазытқыш машиналарды пайдаланады.
Аммиактың химиялық қасиеттері.
Аммиактың суда жақсы еруі олардың молекулаларының арасында сутекті байланыстың түзілуіне тәуелді.
H
3
N: +H-O:
 H
3
N: …H -O:
H
3
N: …H -O:
H H
Бірақта аммиактың мұндай гидраттарынан басқа аз мөлшерде аммоний иондарымен түзіледі:
H
3
N: …H-O:
 [NH
4
]
+
+[OH] -
[NH
4
]
+
+[OH] -
H
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz