Тұздардың гидролизі (Бренстед-Лоури теориясы), гидролиз дәрежесі мен константасы және буфер ерітінділерінің рН-ын есептеу


ТҰЗДАРДЫҢ ГИДРОЛИЗІ
Бренстед және Лоури теориясы бойынша барлық қышқылдар (негіздер) еріткішпен қосарласқан қышқыл мен негіз түзе отырып әрекеттеседі. Бұл жағдайда еріткіштің ионизациялану процесінің тепе-теңдігі бұзылып, реакция ортасы өзгереді. Көбінесе еріткіш ионизациялану тепе-теңдігінің күшті ығысуы, мысалы судың, әлсіз қышқылдардың қосарласқан негіздерін немесе әлсіз негіздердің қосарласқан қышқылдарын туғызады:
CN - + HOH HCN + OH -
[Al( H 2 O) 6 ] 3+ + H 2 O H 3 O + + [Al(OH) ( H 2 O) 5 ] 2+
орта қышқыл
Бренстед және Лоури теориясы бойынша қышқылдар мен негіздердің сумен әрекеттесу негізгі қағидаларына гидролиз түсінігі кіреді. Аррениустың ертеректегі электролиттік диссоциациясының классикалық теориясында әлсіз қышқыл немесе әлсіз негіз тұздарының сумен әрекеттесуі гидролиз түсінігін берген, оны судың ерекше қасиеті деп түсіндірген. Сулы ерітіндіде қышқылдық өзгерту аналитикалық реакция жолын өзгертетін болғандықтан, бұл құбылыстың - гидролиздің аналитикалық химия үшін мағынасын қарастырамыз.
Гидролиз негіздерін теориялық тұрғыдан білу, сапалық талдау тәжірибесінде сәйкес аналитикалық реактив әсерінен күткен қосылыс неліктен тұнбаға түспейтінін түсінуге мүмкіндік береді.
Сонымен, соңына дейін жүретін гидролиз нәтижесінде күткен алюминий, хром және титан сульфидтерінің орнына олардың тұздарының ерітінділеріне күкіртсутек әсер еткенде осы катиондардың гидроксидтері түседі.
Кейбір катиондар үшін гидролиз реакциясы олардың ерітіндіде бар екендігін дәлелдейді. Яғни, бериллий, висмут және стибилдің хлорлы қосылыстары гидролиз нәтижесінде хлорлы бериллий, хлорлы висмут және хлорлы стибил тұнбасын түзеді, осы нәтиже бойынша олардың ерітіндіде бар екенін анықтайды:
Bi 3+ + 2HOH Bi(OH) 2 + + 2H +
Bi(OH) 2 + = BiO + + H 2 O
Sb 3+ + 2HOH Sb (OH) 2 + + 2H +
Sb (OH) 2 + → SbO + + H 2 O
Кремний қышқылының тұздарына NH 4 Cl- мен әсер еткенде гидролиз нәтижесінде суда ерімейтін және оның тұзынан шығарып тастайтын кремний қышқылы түзіледі:
NH 4 + + H 2 O H 3 O + + NH 3
Na 2 SiO 3 + 2H 3 O + H 2 SiO 3 + 2Na + + 2H 2 O
Гидролиз реакциялары сапалық талдауда катиондарды бөлу үшін қолданылады. Артық сілті көмегімен хром және алюминий катиондарын бөлу үшін, оларды натрий алюминатына және натрий хромитіне ауыстырады. Содан соң ерітіндіні сумен сұйылтады және қайнатады, осы кезде натрий хромитінің гидролизі нәтижесінде хром гидроксиді тұнбаға түседі.
CrO 2 - + 2 H 2 O Cr(OH) 3 + OH -
Гидролизденетін тұздардың сулы ерітінділері мәні белгілі pH(Na 2 CO 3 , NaAc, NH 4 Cl және т. б. ) жұмсақ бейтараптаушы орта болып табылады.
Гидролизденетін тұздар ерітінділерінің pH-ын анықтау
Гидролиз процесінің сандық көрсеткіші гидролиз константасы болып табылады.
а) Күшті негіз және әлсіз (мысалы, NaCN) тұздарына гидролизін қарастырайық:
NaCN Na + + CN -
Цианид-ионы гидролизге ұшырайды:
CN - + H 2 O HCN + OH -
Цианид ионы сумен әрекеттескенде тұз ерітіндісінің ортасы сілті болады. Гидролиз қайтымды процесс, сондықтан бұл процесстің К т-т үшін әсер етуші массалар заңын қолдануға болады:
K
r
=

- теңдеудің алымы мен бөлімін [H+] -ке көбейтеміз:
K r =
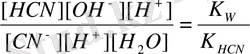
Анықтама бойынша K HCN = 5 . 10 -10
K
r
=
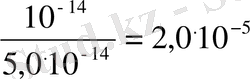
б) Әлсіз негіз бен күшті қышқыл тұзының (мысалы, NH 4 Cl) гидролизін қарастырайық:
NH 4 + + H 2 O NH 4 OH + H +
K
r
=
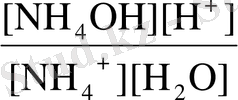
(2) теңдеудің алымы мен бөлімін [OH - ] -ке көбейтеміз:
K
r
=
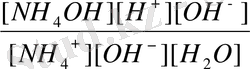
K
NH
 OH
= 1, 76
.
10
-5
K
r
=
OH
= 1, 76
.
10
-5
K
r
=
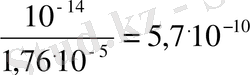
Жоғарыда көрсетілген екі тұз гидролизінің константа мәндерін салыстырғанда, гидролиз әлсіз электролит түзілу жағына қарай тереңірек жүретінін көруге болады.
в) Әлсіз негіз бен әлсіз қышқыл (мысалы, NH 4 CN) тұздарының гидролизін қарастырамыз.
NH 4 + + CN - + H 2 O NH 4 OH + HCN
K
r
=
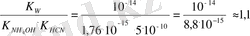
Бұл тұздың гидролизі алдында қарастырылған екі тұз гидролизімен салыстырғанда терең жүреді.
Гидролиз процесі гидролиз дәрежесімен сандық сипатталады. Гидролиз дәрежесі тұздың гидролизденген бөлігінің оның жалпы концентрациясына қатынасына тең және h әріпімен белгіленеді. Күшті негізбен әлсіз қышқыл тұзы үшін:
h =
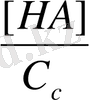
A
-
+ H
2
O
 HA + OH
-
; K
r
=
HA + OH
-
; K
r
=
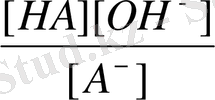
[HA] = [OH
-
], сондықтан K
r
=
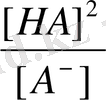
Тұз анионы конценирациясы тұздың жалпы концентрациясына тең, себебі тұз толығымен диссоциацияланады:
Сонда [A
-
] = C
c
; K
r
=

Басқа жағынан K
r
=
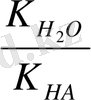 , т. е.
, т. е.
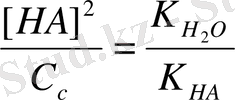 (1)
(1)
Теңдеудің екі жағына C c бөлеміз:
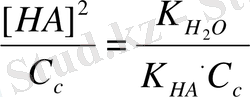
Сонда h =
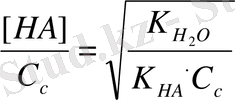 (2)
(2)
0, 1 н. NaCN үшін: h =
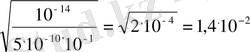
h = 1, 4%
(2) теңдеуден гидролиз дәрежесі - температура жоғарылағанда көбейетін судың иондық туындысына қышқыл күшіне тәуелді екенін көруге болады.
Неғұрлым қышқыл әлсіз болса соғұрлым гидролиз терең. Гидролиз дәрежесі тұз концентрациясына тәуелді: концентрліге қарағанда, сұйылтылған ерітіндінің гидролиз дәрежесі жоғары. Егер күшті қышқыл әлсіз негіз тұзы болса онда:
h =
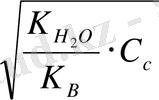
0, 1 M NH
4
Cl үшін h =
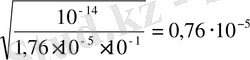 немесе
немесе
h = 7б . 10 -4 %
Бұл тұздың гидролиз дәрежесі NaCN қарағанда 1800-ден аса аз, себебі NH 4 OH негізі синиль ерітіндісі қышқылынан бірнеше мың есе күшті.
Егер әлсіз қышқыл мен әлсіз негіз тұзы бар болса, онда:
B
+
+ A
-
+ H
2
O BOH + HA; K
r
=
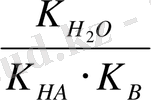
Егер С - осы тұздың жалпы концентрациясы болса, онда [BOH] = [HA] Ch мұнда Ch - гидролизденген бөлшектердің саны, гидролиз дәрежесінің теңдеуінің шығатыны
h =
Гидролизден кейін тұз иондарынң тепе-теңдік концентрациясы тең
[B + ] = [A - ] = C - Ch = C(1-h)
сонда K
r
=
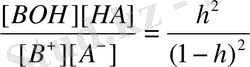
Басқа жағынан K
r
=
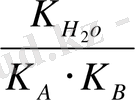 есекере отырып, былай жазуға болады:
есекере отырып, былай жазуға болады:
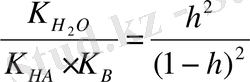
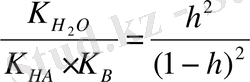 немесе
немесе
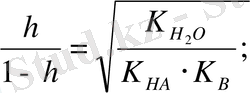 Equation. 3
Equation. 3
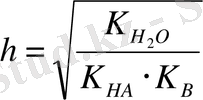
Әдетте h 1-ден аз болғандықтан, оны ескермесе де болады.
K HCN = 5 . 10 -10 және K NH4OH = 1, 76 . 10 -5 болғанда 0, 1 M NH 4 CN үшін:
h =
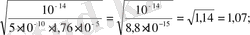 h ≈100%
h ≈100%
Әлсіз негіз және әлсіз қышқыл тұзының гидролиз дәрежесі қарастырылған басқа екі тұзбен салыстырғанда көп есе жоғары.
Әлсіз қышқыл және күшті негіз (NaCN мысалында) гидролизденетін тұздар ерітінділерінің pH-ын есептейміз:
CN - + H 2 O HCN + OH -
K
r
=
 [CN
-
] = C
c
; [HCN] = [OH
-
]
[CN
-
] = C
c
; [HCN] = [OH
-
]
Бұдан K
r
=
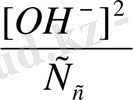 [OH
-
] =
[OH
-
] =
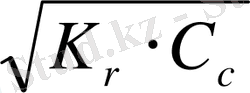
0, 1 н. NaCN үшін: [OH
-
] =
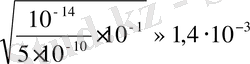
pOH = 2, 9 pH = 11, 1
0, 1 М NH 4 Cl үшін: NH 4 + + H 2 O NH 4 OH + H +
[H
+
] =
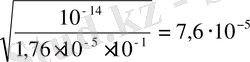
pH = 4, 1
Әлсіз негіз және әлсіз қышқыл (BA) тұзының гидролизі жағдайындағы ерітіндінің қышқылдығын есептейтін формула шығарамыз:
B + + A - + H 2 O BOH + HA
K
r
=
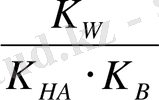 =
=
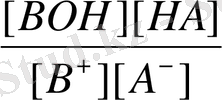
Әлсіз негіз және әлсіз қышқыл тұзы гидролизіндегідей, гидролиз константасының мәні аз болса, онда:
[BOH] ≈ [HA] ; [B + ] = [A - ] ≈ C c
Онда K
r
=
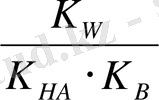 =
=
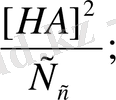 (1)
(1)
Басқа жағынан HA H + + A - [A - ] = C c болғанда
K
HA
=
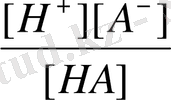 ; [HA] =
; [HA] =
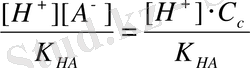 (2)
(2)
(2) теңдеуін (1) теңдеуіне қоямыз:
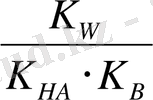 =
=
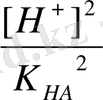 [H
+
] =
[H
+
] =
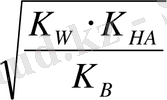
0, 1 M NH 4 CN үшін:
[H
+
] =
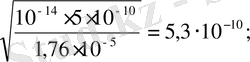 pH = 9, 3
pH = 9, 3
Буфер ерітінділерінің pH-ын есептеу
Буфер ерітінділері - әдетте құрамында әлсіз негіз және оның тұздары бар, (мысалы, CH 3 COOH + CH 3 COONa ) немесе әлсіз негіз және оның тұздары бар қоспа. Мысалы, NH 4 OH + NH 4 Cl сутек иондарының белгілі концентрациясында. Буфер ерітінділерінің pH мәндері - аз мөлшерде күшті қышқыл немесе сілті қосқаннан және ерітіндіні сұйылтқаннан өзгермейді, ал орта шарттары өзгермейтін жағдайда химиялық процесстер жүргізуге мүмкіндік береді. Буфер ерітіндіге күшті қышқылдың аз мөлщерін қосқанда, күшті қышқылдың сутек иондары әлсіз қышқыл молекулаларымен байланысады, сондықтан бұл ерітіндінің қышқылдығы бірден жоғарыламайды. Егер буфер ерітіндіге аз мөлшерде сілті қосса, онда оның гидроксил иондары әлсіз қышқылдың сутек иондарымен су молекуласына байланысады. Тәжірибеде буфер ерітінділер сумен сұйылтса да өз қышқылдығын өзгертпейді. Ол, былай түсіндіріледі: әлсіз қышқылдың диссоциация дәрежесі сұйылтқанда көбейеді және сутек иондарының концентрациясы іс жүзінде тұрақты болып қалады.
Буфер ерітінділер химия тәжірибесінде кеңінен қолданылады, ол түрлі организмдердің өмір сүру процесінде маңызды роль атқарады. Көптеген өмір сүру процесстер тек pH-тың белгілі мәнінде ғана жүреді. Тірі ағзада pH тұрақтылығы табиғи буферлік қоспалармен ұсталады ( мысалы, адам ағзасында фосфаттық қоспалар NaH 2 PO4 + Na 2 HPO 4 , карбонаттыбуферлік қоспа H 2 CO 3 + NaHCO 3 бар) . Буфер қоспалар аналитикалық химияда және өндірісте кеңінен қолданылады: сапалық талдаудың жүйелік әдістерінде аналитикалық топтарды бөлгенде, бөлек иондарды тапқанда және шығарғанда, сирек элементтерді бөлгенде, шикізатты флотациямен байытқанда және т. б.
Буферлік қоспадан түзілетін pH көлемін теориялық есептейді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz