Орта мектептегі химия курсының мазмұнын таңдау және оқыту әдістемесі


Жоспар
І. Кіріспе
ІІ. Негізгі бөлім
2. 1. ХИМИЯ КУРСЫНЫҢ МАЗМҰНЫН ТАҢДАУҒА ЖӘНЕ
ОҚЫТУҒА ҚОЙЫЛАТЫН ДИДАКТИКАЛЫҚ ТАЛАПТАР
2. 2. ОРТА МЕКТЕПТЕГІ ХИМИЯ КУРСЫНЫҢ МАЗМҰНЫН
СҰРЫПТАУ НЕГІЗДЕРІ
2. 3. ОРТА МЕКТЕПТЕГІ ХИМИЯ КУРСЫ МАЗМҰНЫНЫҢ
ҚАЛЫПТАСУ КЕЗЕҢДЕРІ
2. 4. ХИМИЯДАН АЛҒАН ОРТА БІЛІМ МАЗМҰНЫНЫҢ
КЕЛЕШЕГІ ТУРАЛЫ
2. 5. ОҚЫТУ ӘДІСТЕРІНІҢ ЖІКТЕЛУІ
ІІІ. Қорытынды
IV. Пайдаланылған әдебиеттер
Кіріспе
Химияны оқыту методикасы - мұғалімдер дайындайтын университеттер мен педагогика институттарының оқу жоспарындағы негізгі пәндердің бірі. Ол болашақ мұғалімдерді химияны оқыту теориясымен қаруландырып, іс жузінде күнделікті туындап отыратын жеке методикалық мәселелерді ғылыми тұрғыдан шеше білуге әзірлейді. Алайда қазақ бөлімінде оқитын студенттер бұл пәнді игеруде үлкен қиыншылықтарға кездесіп жұр. Ұсынылып отырған оқулықтың мақсаты - аз да болса сол олқылықтардың орнын толтыруға көмектесу.
Студенттерге арналған қазақ тіліндегі бұл тұңғыш методикалық оқулық қазіргі кезде қолданылып жүрген химииялық оқыту методңкасының бағдарламаларына сәйкес жазылды, мұнда химияны орта мектепте оқыту методикасының жалпы және жеке мәселелері баяндалады.
Оқулықтың жалпы бөлімінде химияны оқыту методикасы бойынша зерттелетін объект, оның басқа пәндермен байланысы қалыптасу кезендері, Қазақстан Республикасындағы химияны оқыту методикасының даму жолдары карастырылады. Жалпы білім беретін орта мектепте химияны оқытудың мақсаттары мен міндеттері, мазмұны, оқыту әдістері және ұйымдастыру түрлері мектеп реформасының талаптары мен тұжырымдары тұрғысынан талданды. Бұл еңбекте орта мектепте химиядан сабақ берудің аса маңызды құралы болып табылатын химиялық эксперименттердің түрлеріне, мөлшерлік және эксперименттік есептерді шығару методикасына баса назар аударылды. Химиялық ғылыми тілдің табиғаты, құрамы, оқыту құралдарының жүйесіндегі. орны, оқу-тәрбие саласында атқаратын қызметі семиотикалық және дидактикалық көзқарастар тұрғысынан біршама кеңірек талданады.
Қазақ мектептерінде химияны оқытудың негізгі ерекшелігі ғылыми тілге байланысты екені ескеріліп, химиялық терминология мен номенклатураның қазақша қалыптасуына және даму кезеңдеріне қысқаша шолу жасалады.
ОРТА МЕКТЕПТЕПТЕГІ ХИМИЯ КУРСЫНЫҢ МАЗМҰНЫ MEH ҚҰРЫЛЫСЫ
I. ХИМИЯ КУРСЫНЫҢ МАЗМҰНЫН ТАҢДАУҒА ЖӘНЕ ОҚЫТУҒА ҚОЙЫЛАТЫН ДИДАКТИКАЛЫҚ ТАЛАПТАР
Химия курсының мазмұны химия ғылымының қолы жеткен табыстарын дидактикалық талдау арқылы мына негіздерге сай анықталады және оқытылады: ғылымилығы, жүйелілігі түсініктілігі, саналылығы мен белсенділігі, көрнекілігі-теорияның сарамандылыққа байланыстылығы.
Ғылымилығы. Орта мектептегі химияның негізіне ғылымда толық шешімін тапқан деректер мен көзқарастар кіреді. Олар ғылымдағы мәліметтерге толық сәйкес келіп, заттар мен құбылыстар туралы ақиқатты бұрмаламай жеткізуі тиіс. Ол үшін жетекші теориялардың орны дұрыс анықталып, жеткілікті деректі материалдың негізінде енгізілуі керек.
Жү й е л і л і г і. Оқу материалы ғылымның логикасына сәйкес бірінен бірі туындайтын ретпен орналастырылады. Жаңа материал өтілгенді ескеріп беріледі де, өзі соңындағыларға негіз болады. Жүйелік негізі, әсіресе, химияның негізгі ұғымдарын қалыптастырғанда ескеріледі. Ол үшін деректі материалдарды заттар және химиялық реакциялар туралы ұғымдар жүйесіне біріктіреді.
Т ү с і н і к т і л і г і. Бұл ғылыми негізге - кереғар, жүйелілікке тура қатысты болады. Оқу материалының түсінікті болуы көлеміне және ғылыми деңгейіне байланысты, сондықтан кейбір ғылыми ақпарды оңайлатып беруге тура келеді. Оңайлатудың дәрежесін тым төмендетіп жіберсе, бұрмалаушылыққа әкеліп соғады. Оңайлатудың дәрежесін тым төмендетіп жіберсе, бұрмалаушылыққа әкеліп соғады.
Оқушылар химиялық қосылыс және қоспа ұғымдарымен нақтылы мысалдар арқылы танысқан соң ерітінділер өтіледі. Осыған орай оңайлату үшін ерітінді ұғымына қосылыс деп те немесе қоспа дел те анықтама беру болмас еді. Өйткені ерітінді бір сипаттамалары жөнінен химиялық қосылысқа (еріген зат және еріткіш бөлшектерінің өзара әрекеттесуі), екіншілері бойынша қоспаға (құрамы тұрақсыз) ұқсайды.
Саналылық және белсенділiгі негізі - оқыту барысында мұғалім мен оқушы еңбегінің ара салмағын оқушылар жағына ауыстырып, олардың қызығуын және білім алудағы белсенділігін арттыру. Ол үшін білімнің қажеттігі мен пайдасына оқушылардың көздерін жеткізіп, өздігінен жұмыс істей білуге үйрету керек.
Ғылымның тілін меңгерумен байланысты саналылық негізінің маңызы арта түседі. Окушылар термин арқылы берілетін ұғымның негізгі белгілерін, қажет жағдайда, зат атауының шығу төркінін, химиялық символиканың мәні мен мағынасын түсінуі, олар арқылы белгіленген заттар мен құбылыстарды елестете білуі керек. Мұның өзі оқушылар білімінің жаттанды және үстірт болмауын қамтамасыз етеді.
Көрнекілік принципі - дидактиканың ертеден қалыптасқан түпкілікті негіздерінің бірі, химияны оқытуда маңызды орын алады. Оқушылар білімді заттар мен химиялық әрекеттерді тікелей қабылдау арқылы алуы тиіс. Бұл мүмкін болмаған жағдайда атом мен молекула құрылысының, өндірістік қондырғылардың модельдерін, суреттерін, сызбанұсқаларын пайдаланады. Осының бәрінде оқушылар жан-жақты бақылау жасауға, әр көрнекіліктен барынша мол ақпар алуға, бақылау нәтижелерін қорытындылап, түсіндіре білуге үйренуі керек.
Теорияның сарамандыққа байланыстылығы. Бұл - оқушылардың ғылым негіздерінен алған білімін өмірмен, қоғамдық құрылыс сарамандығы мен ұштастыру арқылы жүзеге асады, политехникалық білім беру мәселелерін қамтиды. Реті келген жағдайда химия ғылымында ашылған жаңалықтардың өндіріске енгізілуін, ал химия өнеркәсібі қажеттілігінін ғылым дамуына түрткі болғанын нақты мысалдармен түсіндірін отырған жөн. Мәселен өткен ғасырда азот тыңайтқыштарын молынан өндіру, оқ-дәрі жасайтын нитрат алу қажеттігі туғанда химиялық байланыстырудың мәселесі қойылды. Осыған орай аммиак синтезінің жағдайлары, химиялық тепе-теңдікті қалаған жағына қарай ығыстыру шарттары, әрекетті жүзеге асыру құралдары мен негіздері жан жақты зерттелді.
Сөз болып отырған принципті жүзеге асыру үшін оқушылар химиядан алған теориялық білімін сарамандық таным есептерін шығаруға қолдана білуі тиіс, Бұл есептер өмірде, табиғатта, зертханаларда және өндірісте жиі кездесетін құбылыстарға негізделіп құрастырылады.
ОРТА МЕКТЕПТЕГІ ХИМИЯ КУРСЫНЫҢ МАЗМҰНЫН СҰРЫПТАУ НЕГІЗДЕРІ
Химияны оқыту метоликасының негіздерінде оқу материалының көлемін және қиындығын реттеудің мынадай жалпы педагогикалық талаптары келтірілген: мазмұнның тұтастығы; ғылыми дәлдігі және құндылығы; оқушылардың жас ерекшеліктеріне сай келуі; оқу жоспарындағы сағат санының ескерілуі; көпшілік мектептің жағдайына сәйкестігі; халықаралық стандартпен үйлесімділігі.
Бұлар оқу пәндерінің бәріне тиесілі жалпы талаптар. Мектептегі химия курсының мазмұнын іріктеудің кейбір өзіндік негіздері химиядан сабақ беру методикасында талданған, соларға тоқталып өтейік.
Оқу материалының қазіргі ғылым деңгейіне сәйкес келуі. Қазіргі ғылыми-техникалық революция дәуірінде жеке ғылым салалары қарыштап дамыды. Қайсыбір топшылауларға қарағанда, әр 7-10 жылда ғылыми ақпараттың көлемі екі есе өскен екен. Мұның өзі оқу пәндерінің мазмұнын дүркін-дүркін қайта қарап, жаңалықтармен толықтырып отыруды қажет етеді.
Оқу пәні ретінде химияның мазмұнына деректі материалдар, жетекші теориялар мен заңдар, өндірістік материалдар енгізіледі. Осылардың әрқайсысы соны деректермен, химиялық технологияның жаңалықтарымен, жаңа идеялармен толысуы керек.
Химия курсының мазмұнын таңдағанда жәке толықтырғанда білімнің жүйелі түрде орналасуы ескеріледі. Оқу материалының ішінен ең іргелі білім мен біліктерді іріктеп, жетекші идеяның төңірегіне топтастырады, олардың ішкі мәнін жалпы заңдылықтарды қамтитын теориялардың тұрғысынан түсіндіреді.
Демек, теория мен деректі тәжірибелік білімнің ара- қатынасын тиімді анықтау- аса маңызды методикалық міндеттердің бірі. Деректер теориялық көзқарасты жетік меңгеретін дәрежеде ғана алынады. Олардың мөлшері тым көбейіп кетсе, кері нәтиже береді.
Ұғымдарды дамыту негіздері. Химия ғылымының даму барысында теориялық деңгейінің көтерілуіне байланысты негізгі ұғымдарының мағынасы кеңейіп, тереңдейді. Мектеп курсында әр үғымның ғылым тарихындағы қалыптасу жолын айнытпай қайталау міндет емес. Дегенмен, оқушылардың әзірлігін, жас-ерекшелігін ескеріп, ұғымның мағынасын біртіндеп ашып, дамытуға тура келеді. Мәселен, зат туралы ұғым мына сызбанұсқаға сәйкес дамытылады: физикалық дене -> зат -> элементтік құрамы -> элементар бөлшектер -> иондық құрамы - материяның бір түрі.
Сызбанұсқаға қарағанда зат туралы алғашқы ұғым тәжірибе жүзінде бірнеше физикалық денелердің ортақ белгілерін табу арқылы қалыптасады (1) . Бұдан соң атом-молекулалық теорияның (2), электрондық теорияның (3), электролиттік диссоциациялану теориясының (4), жалпы материалистік көзқарастың (5) тұрғысынан дамиды.
Қиыншылықты бөлу негізі. Бұл негіз химия курсының мазмұнын анықтауда әр қилы шешім тапты. Мұндағы негізгі мәселе - оқушылардың таным әрекетінің мүмкіндігін ескеріп, деректі материалдардың, теориялардың және химиялық ұғымдардың орнын тиімді анықтау. Оқушылар тікелей бақылауға негізделмеген теориялық материалдарды игеруге қиналады. Сондықтан оларды бір жерге топтастырмай, қиыншылықты бөлу негізіне сәйкес кластарға бөліп орналастырады. Деректі материалдар теорияның алдынан және соңынан қарастырылады да, бірінші жағдайда теорияны түсіндіру, екінші жағдайда бекіту, нақтылау және дамыту мақсатын көздейді.
Қи ы н ш ы л ы қ т ы б ө л е б і л у н е г і з і ұғымдарды дамытуға тығыз байланысты. Негізгі химиялық ұғымдар теориялық деңгейіне қарай курстың әр жерінде өтіліп дамытылады. Мәселен, валенттілік ұғымының VII класта эмпирикалық түсінігі, VIII класта электрондық түсінігі беріліп келді. Эмпирикалық ұғымның өзі, алдымен қосылу, соңынан орын басу реакциялары арқылы әр тақырыптарға бөлініп беріледі.
Қиыншылықты бөле білу негізіне сәйкес терминдердің мағынасы да біртіндеп ашылады. VII класта атом- химиялық бөлінбейтін - заттың ең кішкене бөлшегі деп анықталады да, VIII класта атомный, элементар бөл шектерден тұратын күрделі құрылысы түсіндіріледі. VIII класта электрондардың атомдағы күйі, периодтылықтың себебі туралы күрделі материалды толық және терең қарастыру мүмкін еместігінен, бұлардың негізгі бөлігі XI кластағы жалпы химия курсына көшірілді.
Политехнизм негізі. Бұл негізді жүзеге асыру үшін химия-курсының мазмұнына енгізілетін материалдар: 1) алдыңғы қатардағы химия өндірістерінің және негізіне химиялық әрекеттер жататын кейбір өндіріс орындарының шикізаттары, өнімдері, технологиялық барысы, қажет болған жағдайда кондырғылары мен аппараттары; 2) өндірістің жалпы және химияға тән ғылыми негіздері; 3) халық шаруашылығын химияландырудың негізгі бағыттары, басқа өндірістермен байланысы, ауыр индустриядағы алатын орны; 4) химия өнеркәсібінің дамуы, қазіргі жайы, өркендеу перспективалары; 5) химия өндірістерінің экологиялық мәселелерін шешудегі мәні; 6) кәсіптік бағдар беретін материалдар.
Келтірілген материалдар оқушылардың ғылыми-техникалық ой өрісін дамытуға бағытталған. Бұлардан басқа полиехнизм оқушыларды сарамандық іске бейімдеу, тұрмыста және табиғатта жиі кездесетін заттармен жұмыс істей білу біліктері мен дағдыларын қалыптастыру мақсатын көздейді.
Тарихи негіз. Бұл негізді жүзеге асыру дегеніміз - химия ғылымын даму бағытында көрсету, оның өткені, бүгінгісі және болашағы туралы оқушыларда пікір қалыптастыру. Тарихи негіз екі бағытта жүзеге асады. Біріншісі орта мектептегі химия курсының мазмұны мен құрылысын анықтағанда ғылымның тарихи даму логикасын ескеру, екіншісі - химиялық элементтердің, заттардың, химия ғылымының дамуына елеулі үлес қосқан ғалымдардың өмірі мен енбектерінен мәліметтер беру.
Бірінші бағыттың негізінде теориялық көзқарастардың орналасу реті анықталады. Мұнда оқушыларды ғылым тарихындағы адасулар мен қателіктерге соқтырмай, тура жолмен алып жүру мақсаты көзделеді.
Екінші бағыт бойынша оқу материалының мазмұнына кіретіндер: 1) кең таралған және толық түрде өтілетін элементтердің, мысалы, оттегі мен сутегінің ашылу тарихы жөнінде мағлұматтар беру; 2) атом - молекулалық ілімнің негізін қалаған М. В. Ломоносов, Дж. Дальтон еңбектерімен қысқаша таныстыру; 3) масса сақталу заңдарының ашылуына байланысты М. В. Ломоносов және А. Лавуазье тәжірибелерін сипаттау; көрнекті ғалымдардың ғылымға келу жолын, қиыншылықтарды жеңу үстіндегі табандылығын, Отанына деген шексіз сүйіспеншілігін нақтылы мысалдармен көрсету.
ОРТА МЕКТЕПТЕГІ ХИМИЯ КУРСЫ МАЗМҰНЫНЫҢ ҚАЛЫПТАСУ КЕЗЕҢДЕРІ
Жалпы білім беретін орта мектептің алдына қойылған міндеттердің өзгеруіне сәйкес химия пәнінің мазмұны үздіксіз қайта қаралып, жаңарып отырды.
1920 жылы химияның шамамен алынған екі бағдарламасының жобасы жарияланды. Шамамен алынған дейтін себебіміз бұл бағдарламаларда әр класта өтілетін тақырыптардың тізбесі ғана берілді, мазмұны ашылмады, оны жергілікті жағдайға байланысты мұғалімнің өзі анықтау керек болды. Екі жоба химияны оқытудың өмірмен, қоғамдық сарамандыққа байланысын, өздігінен істейтін сарамандық жұмыстар арқылы оқушылардың белсенділігін арттыру негізіне сай құрылды. Профессор П. П. Лебедовтың басшылығымен жасалған москвалық жобада теорияның жетекшілік мәні мойындалмады, оны тәжірибеден оқушылардың өздері қорытып шығаруға тиісті болды.
1923 жылы қабылданған жинақты бағдарламада химияның жаңадан қалыптаса бастаған жүйелі курсы жойылып кетті. Оның орнына барлық пәндерді біріктіретін «табиғат», «еңбек», «қоғам» деген құрама тақырыптар енгізілді. Соларға сәйкес өндіріс және өндірістік әрекеттер оқылып, химиялық білім әр кластың соңында қарастырылды. Жүйелі білімі болмағандықтан, оқушылар өндірістік әрекеттерді жөндеп түсінбеді, білімнің сапасы да өте төмендеп кетті.
Оқу пәндерінің бағдарламаларын жасауда орын алған бұрмалаушылықтарды түзетуде ВКП(б) Орталық Комитетінің 1932 жылғы тамыздағы «Бастауыш және орта мектептердегі оқу программалары және режімі» туралы қаулысының маңызы зор болды. "Бұл қаулыда жалпы білім беретін пәндердің жүйелі бағдарламаларын жасау, пәнаралық байланыстарды жүзеге асыру міндеттері қойылды. Осыған орай 1932 жылдың соқында В. Н. Верховский басқарған комиссия химияның тұрақты бағдарламасын ұсынды.
Бұл бағдарлама жүйелілік, ұғымдардың үздіксіз дамуы, политехнизм, теорияның сарамандыққа байланысына негізделіп құрылды. Химияның негізгі ұғымдары мен заңдарының анықтамалары тәжірибе жүзінде өтілген деректі материалдардың негізінде берілетін болды, оларды орналастыруда химия ғылымының логикасы мен даму кезеңдері ескерілді. Мұны. VII класс бағдарламасынан айқын көруге болады.
1. Заттар және олардың айналулары. 2. Су. 3. Оттегі мен сутегі. 4. Элементтер туралы алғашқы ұғым. 5. Салмақ сақтау заңы. Ауа. 6. Құрам тұрақтылық заңы. 7. Атом молекулалық ілім. 8. Тотығу және тотықсыздану. 9. Оксидтер. Негіздер. Қышқылдар. Тұздар.
Бағдарламаның идеясына сәйкес элемент туралы алғашқы ұғым оттегі және сутегі жай заттары өтілгеннен кейін төртінші тақырыпта беріледі. Тәжірибелер жасау арқылы салмақ сақтау заңы, құрам тұрақтылық заңы дәлелденгеннен кейін, оларды түсіндіру үшін атом - молекулалық ілім қарастырылады, химиялық символика енгізіледі.
VІІІ-IX кластарда галогендер, ерітінділер, күкірт, азот және фосфор, көміртек және кремний бейметалдары оқылған соң химиялық элементтердің периодтық жүйесі және заттардың құрылысы туралы ұғым беріледі. Содан кейін металдар қарастырылады.
X кластағы органикалық химия курсына мына тақырыптар енгізілген. 1. Органикалық химия пәні. 2. Молекулалық формулалар және құрылыс формулалары. 3. Көмірсутектер. 4. Спирттер мен фенолдар. Жай эфирлер. 5. Альдегидтер мен кетондар. Қышқылдар. 6. Күрделі эфирлер. Майлар. 7. Көмірсулар. 8. Нитроқосылыстар және амидтер. 9. Белок (ақуыз) заттары. Бұдан қазіргі химия курсының мазмұны негізінен отызыншы жылдарда қалыптасқанын көреміз. Алғашқы тұрақты бағдарлама 1948-жылға дейін елеулі өзгеріссіз пайдаланылды. Бұдан кейінгі жылдарда оны жетілдіруге мына жағдайлар әсерін тигізді: 1) жалпы білім беретін мектептердің алдына қойылған міндеттердің өзгеруі; 2) химия ғылымы мен өнеркәсібінің жедел өркендеуі; 3) методикалық зерттеулердің ұсыныстары; 4) мектепте химияны оқыту тәжірибесінің нәтижесі және қорытындылары.
Жаппай жетіжылдық білім беру міндеттері тұрғысынан VІІ класта біршама аяқталған білім беру көзделді, өйткені оқушылардың бір бөлігі тікелей сарамандық іске араласуы керек болды. Осыған орай VII класс химиясына (1949ж. ) сарамандық маңызы зор. «Көміртегі. Жану», «Темір және басқа металдар» тақырыбы-енгізілді.
Бағдарлама құруда ортақтасу негізі орнықты. Қөміртегі, темір және басқа металдар туралы оқу материалы жоғары кластарда қайтадан қарастырылды. СОКП XIХ съезінің политехникалық білім беруді жаксарту шешімдеріне сәйкес орта мектептің химия курсында өтілетін өндірістерді іріктеу қайта қаралды, химияның халық шаруашылығының әр түрлі салаларында қолданылуы; көрсететін материалдардың көлемі ұлғайды. Елуінші жылдардың соңында синтетикалық материалдарды көптеп өндіру міндеттеріне сәйкес (1958ж. Мамыр пленумы) орта мектептің химия курсында полимерлердің құрамы, құрылысы, қасиеттері және қолданылуы жөнінде едәуір мол мәліметтер берілді. СОҚП мен Министрлер Советінің 1966 ж «Жалпы білім беретін орта мектептердің жұмысын одан әрі жақсарту шаралары туралы» қаулысы жаппай орта білімге көшу, оқу пәндерінің ғылыми дәрежесін арттыру міндеттерін жүктеді.
Химия ғылымы мен өнеркәсібінің жетістіктерін ескеріп, технологиясы ескірген, оқу-тәрбиелік маңызы кеміген өндірістер бағдарламадан шығарылды, мысалы: күкірт қышқылын өндірудің мұнаралық әдісі, колчеданды өртеудің қатарлы пештері, генератор газын алу, синтетикалық тұз қышқылын өндіру. Олардың орнына күкірт қышқылын өндірудің жанаспа әдісі, аммиак және металдарды алудың озат тәсілдері, спирттер және альдегидтер өндірудің мұнай-химиялық әдістері, полимер материалдарын өндіру енгізілді.
Методикалық зерттеулер теориялық материалдарды ертерек орналастырудың тиімділігін байқатты. Осыған орай, химиялық элемент туралы ұғым, атом-молекулалық ілім VII класс курсының бірінші тақырыбына ауыстырылды. Д. И. Менделеевтің периодтық заңы мен периодтық жүйесі ІХ кластағы курсының алдыңғы жағына, содан соң VІІІ класқа көшірілді. Электролиттік диссоциациялану теориясы бейорганикалық химия курсының соңғы жағынан ортасына қарай жылжытылды. Теориялық материалдарының ғылыми деңгейі едәуір жоғарылады. Заттың құрылысы жеке тақырып ретінде өтіліп, теріс электрлік, тотығу дәрежесі, сигма және пи- байланыстар ұғымдары қарастырылатын болды.
Химияны оқыту тәжірибесі бағдарламада басы артық деректі материалдар барын көрсетті. Уақытты үнемдеу үшін осындай материалдардың біразы, мәселен, галогендердің, күкірттің, азоттың оттекті қосылыстары және т. б. деректі материалдар бірнеше рет қысқартылды.
Химия бағдарламасы жалпы және кәсіптік білім беретін орта мектептердің реформасын жүзеге асыру бағыттарына сәйкес жетілдірілді. Химия VIII-XI кластарда оқылатын болды, бұрынғы бейорганикалық және органикалық химияның үстіне жалпы химияның негіздері деген қорытынды курс енгізілді.
Химиядан политехникалық білім берудің мүмкіндіктері молайтылды. Қазіргі техникада кеңінен қолданылатын бағалы заттарды алудың ғылыми негіздері толығырақ қарастырылады. Химия өндірісінің экологиялық және экономикалық мәселелеріне, химияның халық шаруашылындағы маңызына баса назар аударылады. Химия саласындағы ғылыми-техникалық озықтыктың бет алысы, энергетикалық және азық-түлік бағдарламасын шншудегі химияның мәні дәлірек көрсетіледі. Кәсіптік бағдар беру үшін химия өндірістеріндегі негізгі мамандықтарға сипаттама беріледі.
Мектеп реформасының талаптарына сай жасалған жаңа бағдарламаның тақырыптары мынадай:
ЕРІТКІШТІК ТАҚЫРЫБЫНА АРНАЛҒАН ЕСЕПТЕУЛЕР
Еріткіш деп берілген бір заттың еріткішке еру қабілеті айтылады. Зат ерігіштігі температураға байланысты өзгеріп отыратындықтан, ерігіштік нақты температураға қатысты қолданады. Көп жағдайда, нақты температурада 100 г еріткіш массасы еріткіш массасына келетін еріген зат массасы ерігіштікті санды түрде сипаттайды және ол ерігіштік коэфиценті деп те аталады.
2. 18. 40 0 С-де 50 г қаныққан ерітінді құрамында 6, 5 г калий сулфаты бар. Ерітіндінің массалық үлес концентрациясын және ерігіштігін анықта.
Берілгені: Шешімі:
m (ерітінді) = 50г І. Массалық үлес концентрациясын
m(H 2 SO 4 ) = 6. 5 г формуланы пайдаланып анықтаймыз.
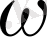 (H
2
SO
4
) -?
(H
2
SO
4
) -?
еріткіш-?
- ерігіштін шамасын анықтау үшін
еріткіш массасын табалық.
m(еріткіш) = 50-6, 5=43, 5 г Н 2 О
3. Ерігіштікті 100 г еріткіш массасына келетін еріген зат массасын арқылы сипаттайтын болғандықтан төмендегідей пропорция құрамыз.
43, 5 еріткіш - 6, 5 г К 2 SO 4
100 г еріткіш - Х г К 2 SO 4
Жауабы:
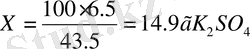
Ерігіштік - 14, 9г тұз 100 г еріткіште ериді.
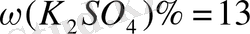
2. 19. 80 0 С - қаныққан 600 г ас тұзы ерітіндісі 0 0 С- ге дейін
салқындатылғанда бөлінген ас тұзының массасын анықтаңыз. Ас тұзының 80 0 С ерігіштігі 38, 0 г ал 0 0 С кезінде 35, 3 г.
Берілгені: Шешімі:
t 1 =80 0 C І. Ерігіштік шамаларын пайдалана отырып, ерітінді
m 1(ерітінді) =600г құрамындағы тұздардың массасын анықталық.
еріткіш(80 0 С) =38. 0 г а. 80 0 С ерігіштік 38, 0 яғни 100 г суда 38, 0 г ас тұзы
t 2 = 0 0 C бар. Демек ерітінді массасы 100+38=138. 0г
m(NaCl) -? ерігіштік(0 0 С) = 35. 8 г Олай болса:
138л ерітінді - 38 г NaCl
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz