Күкірт қышқылының технологиялық қасиеттері, өндіру әдістері және Қазақстандағы қолданылуы


1 дәріс
Күкірт қышқылының технологиялық қасиеттері мен қолданылуы
Күкірт қышқылы - химиялық өнеркәсіпте ең үлкен және көп көлемде өндірілетін өнімдерінің бірі. Күкірт қышқылы түтіндемейді, түссіз, иіссіз, қалыпты жағдайда сұйық зат.
Техникада күкірт қышқылы деп күкірт оксидтен (VI) және судан тұратын әртүрлі құрамды: n SO 3 . m H 2 O жүйелер аталады. n = m = 1 жағдайда күкірт қышқылының моногидраты, яғни 100% күкірт қышқылы болады, m > n - моногидраттың су ерітінділері, ал m < n жағдайда - моногидраттағы күкірт оксидінің (VI) ерітінділері (олеум дейтін) түзіледі:
Н 2 SO 4 . ( n - 1) SO 3 ←Н 2 SO 4 →Н 2 SO 4 . ( m - 1) H 2 O.
олеум моногидрат моногидрат ерітінді
Күкірт қышқылының моногидраты - түссіз май тәрізді сұйықтық. Оның кристалдану температурасы 10, 4 ºС, ал қайнау температурасы 296, 2 ºС және тығыздығы 1, 85 т/м 3 . Моногидрат сумен және күкірт оксидімен (VI) әртүрлі қатынаста араласады, ол сумен - Н 2 SO 4 . H 2 O; Н 2 SO 4 . 2H 2 O; Н 2 SO 4 . 4H 2 O гидраттарды, ал SO 3 -пен - Н 2 SO 4 . SO 3 және Н 2 SO 4 . 2SO 3 қосылыстарды түзеді. Күкірт қышқылы суда ерігенде 1 моль 36 кДж жылу бөліп шығарады.
Осы гидраттары мен SO 3 -пен қосылыстар әртүрлі кристалдану температураларға ие болып, эвтектика қатарын түзеді. Олардың кристалдану температурасы кейбіреулері нольден төмен немесе нольге жуық. Бұл эвтектикалар 1 суретте көрсетілген.
1 сурет - «SO 3 - Н 2 O» жүйесінің кристалдану диаграммасы
Күкірт қышқылының қайнау температурасы да оның концентрациясына, яғни «күкірт оксиді (VI) - су» жүйесінің құрамына тәуелді (2 сурет) . Күкірт қышқылы ерітінділердің концентрациясы өскен сайын оның қайнау температурасы да өседі және максимумды 336, 5 ºС-ға жетеді, оған концентрациясы 98, 3 % сәйкес. Бұл концентрацияда өзгермей қайнайтын (азеотропты) ерітінді түзеді. Құрамында бос SO 3 -тің мөлшері көбейген кезде олеумнің қайнау температурасы 296, 2 ºС-дан (моногидраттың Т қайнау) 44, 7 ºС-ға, яғни 100 %-дық SO 3 -тің қайнау температурасына дейін төмен түседі.
2 сурет - Күкірт қышқылының қайнау температурасы
Күкірт қышқылының булары 400 ºС-дан жоғары қыздырғанда келесі схема бойынша термиялық диссоциацияланады және құрамында көп мөлшерде Н 2 SO 4 -ның молекулаларына қарағанда SO 3 молекулары көбірек болады, ал 700 ºС-дан жоғары SO 2 -нің молекулары артық болады:
400º 700º
2Н 2 SO 4 ↔︎2Н 2 O +2SO 3 ↔︎ 2H 2 O + 2SO 2 + О 2 .
Құрамында қоспалардың мөлшеріне және қышқыл ерітіндісінің концентрациясына байланысты химия өнеркәсібі күкірт қышқылының үш негізгі тауарлы түрін (сорт) шығарады (1 кесте) .
1 кесте - Күкірт қышқылының түрлері
Контактілік қышқыл
(техникалық Н 2 SO 4 - купорос майы)
Олардан басқа аккумулятор күкірт қышқылы (92-94 % Н 2 SO 4 ) бар, оның құрамында Mn, Fe, As, Cl иондары, азот оксидтері және т. б. қоспалар болмауы керек, егер олар аз мөлшерде болса да аккумуляторды зарядтағанда тотығу-тотықсыздану процесі жүреді, бұл жағдайда электродтар тез бұзылады және электр тоғы артық мөлшерде жұмсалады.
Зертханада реактивтік күкірт қышқылының «ХТ», «ТAТ» және «Т» маркалары қолданылады.
Қолданылуы Күкірт қышқылының өндірісі - бейорганикалық заттардың химиялық өнеркәсіптің - қышқылдар, негіздер, тұздар, минералдық тыңайтқыштар және хлор өндіретін салаларының - ең маңызды бір тарауы. Минералды қышқылдардың арасында күкірт қышқылы бірінші орын алады. Соңғы 25 жыл әлемде күкірт қышқылының тұтынуы 3 есе өсті және қазіргі кезде жылына 160 млн. тонна құрайды.
Н 2 SO 4 -ның ең үлкен бөлігі минералды тыңайтқыштардың өндірісінде (30 %-дан 60 %-ға дейін), сондай-ақ бояғыштар өндірісінде (2-ден 16 %-ға дейін), химиялық талшықтар өндірісінде (5-тен 15 %-ға дейін) және металлургияда (2-ден 3 %-ға дейін) жұмсалынады.
Сонымен қатар, әртүрлі техникалық мақсаттар үшін ол тамақ, металл өңдеу, қопарылғыш заттар өндірісінде және Н 3 РО 4 , НСl, сірке және т. б. қышқылдар өндірісінде көп қолданылады. Коксохимия өндірісінде күкірт қышқылы мұнай өнімдерін, майларын тазарту үшін жиі пайдаланылады.
Қазақстанда күкірт қышқылын фосфор тыңайтқыштарын өндіретін және уран алатын зауыттар «Қазатомпром» мемлекеттік кәсіпорындары ең көп пайдаланады. Ал өнім ретінде шығарылатын зауыттар: Өскемен мен Балхаш химиялық зауыттары.
Н 2 SO 4 -ның қолдану аймақтары 3-суретте көрсетілген.
Н 2 SO 4 суда өте жақсы еруімен қатар, суды (ылғалды, дымқылды) күшті тартып сіңіреді, сондықтан оны құрғатқыш ретінде қолданады.
Күкірт қышқылы өндірісінің даму тарихы
XVIII ғасырдың ортасына дейін күкірт қышқылды табиғи темір сульфатын (купорос дейтін) тақтатасымен құрғақ айдау арқылы алынған, осы себептен өндірісте техникалық күкірт қышқылын купорос майы деп атайды.
1746 ж. күкірт қышқылын түбіне су құйылған қорғасын камерасында күкіртпен калий селитра (КNO 3 ) қоспасын өртеу арқылы өндіре бастады. Бұл жағдайда күкірт оксиді (VI) және азот оксидтері суда еріп нитроза түзілген. Сондықтан бұл әдісті «камералық» немесе нитроза әдісі деп аталған.
ХХ ғасырдың басында азот оксидтерін ұстау үшін қондырғыға арнай мұнара қосылған, бұл үрдістің қарқындылығын арттырды. Содан кейін қорғасын камералар қышқылға төзімді саптама бар мұнаралармен ауыстырған. Сөйтіп, «камералы» әдіс күкірт қышқылының «мұнара» әдісіне ауысты. 1837 ж. шикізат ретінде алғаш рет күкірт орнынан темір колчедан пайдаланды.
1831 ж. ағылшын ғалымы П. Филипс платина катализатор қатысында күкірт қышқылының контактілік (жанасу) әдісін ұсынды.
ХХ ғасырдың 20-жылдарынан бастап қымбат платина орнына арзан ванадий оксидінің (V) негізінде контакт массасын қолданатын болды. Бұл катализатордың жану температурасын біраз төмендетеді.
3 сурет - Күкірт қышқылының қолданылуы
1930 ж. өндіріс тәжірибеде тұнғыш рет темір колчедан күйдіру сатысында «ҚҚ» (қайнаушы қабатта күйдіретін) пештер ендірген, бұның арқасында өндірістің қарқындылығы өсті және күкірттің жоғалуы азайды.
1931 ж. И. А. Ададуров және басқалармен газдағы су буының мөлшері жоғары болғанда қатты катализатордың үстінде күкірт оксидінің тотығу әдісі ұсынылды. Кейінірек, бұл - күкіртті сутектен күкірт қышқылын алу әдісі - «ылғалды катализ» деп аталған.
Содан кейін өндіріске Г. К. Боресков және В. С. Бесковпен ұсынылған қос жанасу әдісі («ҚЖ-ҚА») ендірілген. Ол SO 2 -нің жанасу дәрежесін артады және у газдардың шығынын азайтады.
Қазіргі кезде Н 2 SO 4 негізгі екі әдіспен: контакт (жанасу) және нитроз (мұнара) әдістерімен өндіріледі. Моногидрат бойынша аппараттардың күндік өнімділігі 2000 т жетеді.
Әдеб. : 1 нег. [185-189] ; 2 нег. [155-157] ; 6 нег. [5-21] .
Бақылау сұрақтары:
1. Халық шаруашылығындағы күкірт қышқылының маңызы мен ролі.
2. Күкірт қышқылының негізгі технологиялық қасиеттері.
3. Күкірт қышқылының негізгі тауарлы сорттары.
4. Күкірт қышқылының пайдалану аймақтары.
5. Күкірт қышқылының өндіру тәсілдері.
2 дәріс
Қазақстанда күкірт қышқылы Степногорскіде (жылына 180 мың тонна), Балқашта (жылына 1 мың тонна) өндіріледі. Күкірт қышқылын өндіру үшін шикізаттар күкірт немесе күкірт (IV) оксиді алынуы мүмкін күкіртті қосылыстар.
Көп мөлшерде өндірілетін күкірт қышқылына керекті күкірт диоксидін алудың бір қоры - түсті металлургияның пештерінен соңғы кезге дейін далаға жіберіліп келген газдар. Қазіргі кезде бұл газдар, әсіресе түсті металдардың қазынасы, Қазақстанда (Шығыс Қазақстан, Балқаш) күкірт қышқылын алуға жұмсалады. Мысалы 1 тонна мыс өндіргенде 7, 5 тонна күкірт диоксиді шығады, одан 10 тонна артық күкірт қышқылын алуға болады. Өндірісте 80% жуық күкірт қышқылын табиғи күкірт пен темір колчеданынан алады.
Сонымен, күкірт қышқылын күкірті бар шикізаттан өндіруі бірнеше химиялық үрдістерден тұрады, оларда шикізаттың және жартылай өнімдердің тотығу дәрежесі өзгереді:
S 0
FeS 2 -2 I II
H 2 S -2 [S +4 ] [S +6 ],
S +4 O 2
мұндағы I - күкіртті газдың (күкірт оксиді (IV) ) алу сатысы;
II - күкіртті оксидін каталитикалық тотығу арқылы күкірт ангидридіне айналдыру және оны абсорбциялау.
Практика жүзінде орындалатын өндірісте осы химиялық үрдістерге шикізатты дайындау, күкіртті газды тазарту және басқада механикалық және физика-химиялық үрдістер қосылады. Онда күкірт қышқылының жалпы өндіріс сұлбасын мына түрінде көрсетуге болады:
Шикізат → шикізатты дайындау → шикізаттың жануы (күйдіру) → күкіртті газды («күйдіргіш» газ) тазартуы → жанасауы → күкіртті ангидридті абсорбциялау → H 2 SO 4 .
Өндірістің технологиялық сызба-нұсқасы қолданылатын шикізат түріне, күкірт оксидінің (IV) каталитикалық тотықтырудың ерекшеліктеріне, күкірт оксидінің (VI) абсорбция сатысының бар немесе жоқ болуына байланысты.
Күкірт қышқылы өндірісінде шикізат ретінде күкірттің өзін және құрамында күкірті бар әртүрлі қосылыстарды да пайдалануға болады.
Өндіріс масштабында Н 2 SO 4 жалпы көлемінен 45 % колчеданнан, 25 % - күкірттен, 25 % - әртүрлі өндірістен шығатын күкіртті газдан және 5 % - әртүрлі шикізаттан алынады.
Күкірт табиғатта негізінен үш түрде кездеседі:
1) бос түріндегі күкірт - элементарлы күкірт S;
2) сульфидтік кендерінде - металл сульфидтері;
3) металл сульфаттар: гипс СаSO 4 . 2Н 2 О, ангидрид СаSO 4 , мирабилит Na 2 SO 4 . 10Н 2 O және т. б.
Элементарлы күкірттің кендері өте аз мөлшерде кездеседі (күкірттің кларкы 0, 1 %-ды құрайды) . Бірақ элементарлы күкірт SO 2 -ні өндіруге өте құнды шикізат.
Күкіртті газдың (SO 2 ) басқа да көздері бар. Күкірт мұнай, тас көмір, табиғи және өтпелі газдардың құрамында болады. Оларды өңдегенде ол күкіртті газ түрінде шығады. Көп мөлшерде SO 2 оттық және түсті металлургияның газдарында болады. Одан басқа күкірт жанғыш газдарды тазалау кезінде бөлініп шығатын күкіртсутек түрінде болады.
Сол сәттен, күкірт қышқылын өндіру үшін қолданылатын шикізат өте алуан, бірақ осы уақытқа дейін шикізат ретінде темір колчеданы мен элементарлы күкірт жиі қолданылады. Колчедан құрамындағы күкірт мөлшері 35-50 % құрайды. Оның негізгі кенорындары Кавказ, Орал және Орта Азия републикаларында орналасқан.
Н 2 SO 4 өндірудің жалпы сызба-нұсқасы негізгі мынадай сатылардан турады:
1) күкіртті ангидридін SO 2 алу,
2) күкірт оксидін (IV) SO 3 -ке тотықтыру,
3) күкірт ангидридін Н 2 SO 4 -ке айналдыру.
Өнеркәсіпте өндіретін газ (SO 2 күкіртті ангидрид) өте күрделі қоспа, оның құрамында SO 2 -нен басқа: азот, оттек және т. б. қоспалар болады.
Осы өнеркәсіптік жалпы схемада Н 2 SO 4 өндіру үшін алғашқы екі саты өте маңызды болып келеді. Олар: шикізатты дайындау және оны күйдіру. Осы айтылғандардың әрқайсысын техникалық орындауы ерекше болады, өйткені шикізат табиғатына байланысты болады.
Шикізат дайындау сатысын келесі мысалдарда қарастырайық.
1) Темір колчедан. Табиғи темір колчедан қатарлы колчедан түрінде кездеседі. Бұл темір сульфидтен FeS 2 және басқа металл (мыс, мырыш, қорғасын, никель, кобальт және т. б. ) сульфидтерден туратын күрделі жыныс. Олардан басқа оның құрамына металл карбонаттары мен бос жыныс кіреді.
Колчеданның дайындау үрдісі 1-суретте көрсетілген. Оның мақсаты - түсті металдарды және FeS 2 бөліп шығару.
1 сурет - Темір колчеданның дайындау сызбасы
2) Күкірт. Элементарлы күкірт құрамында не күкіртсутек, не күкірт оксиді (IV) бар газдардан немесе күкіртті кендерден алынады. Осыған сәйкес кенді (самород) және газды күкіртті ажыратады:
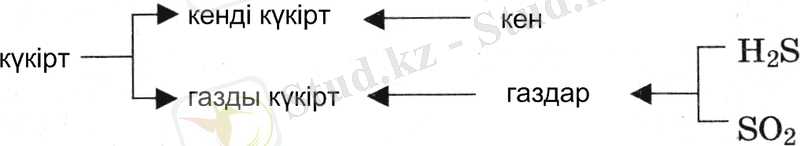
Күкіртті кендерден күкіртті пештерде, автоклавтарда немесе Фраш әдіспен тікелей жерасты кеншоғырларда балқытып алады. 2-суретте кенді күкірттің дайындау сызба-нұсқасы көрсетілген.
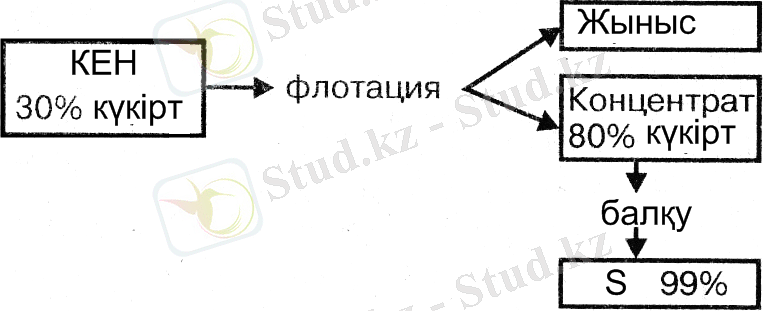
2 сурет - Кенді күкірттің дайындауы
Газды күкіртті күкіртсутектен алады. Бұл үрдіс қатты катализатордың үстіндегі Н 2 S-тің толық жүрмейтін тотығу реакциясына негізделген:
Н 2 S + 1, 5О 2 = SО 2 + Н 2 О
2Н 2 S + SО 2 = 2Н 2 О + 1, 5S 2
2Н 2 S + О 2 = 2Н 2 О + S 2 .
Мыс өндірісінде қосымша өнімдерінің бірі күкірт қосылыстары болу мүмкін. Олар балқу кезінде келесі реакциялар бойынша элементарлы күкіртті беру мүмкін:
FeS 2 = 2FeS + S 2 ,
SО 2 + С = S + СО 2 ,
СS 2 + SО 2 = 1, 5S 2 + СО 2 ,
2СОS + SО 2 = 1, 5S 2 + 2СО 2 .
3) Күкіртісутек Н 2 S-тің көздері: кокстық, генераторлық, өтпелі газдар және мұнай қайта өндеудің газдары. Олардың құрамында 90 %-ға дейін күкірт болады, сондықтан ол арнай дайындауды қажет етпейді.
4) Түсті металлургияның газдары Осындай газдарда 4-тен 10 %-ға дейін күкірт оксиді (IV) болады, сондықтан олар тікелей күкірт қышқылын алу үшін қолданылуы мүмкін.
Н 2 SО 4 -ның өзіндік құнында шикізат үлесі көп болғандықтан, өндірістің техника-экономикалық көрсеткіштері пайдаланылатын шикізатқа тәуелді. 2-кестеде әртүрлі шикізаттан алынатын күкірт қышқылы өндірісінің ТЭК келтірілген.
2 кесте - Н 2 SО 4 өндірісінің техника-экономикалық көрсеткіштері (%)
Әдеб. : 2 нег. [157-166] ; 6 нег. [31-41] .
Бақылау сұрақтары:
1. Күкірт қышқылын темір колчеданнан алудың физика-химиялық негізі.
2. Күкірт қышқылын күкірттен алу.
3. Күкірт қышқылын күкіртсутектен алу.
4. Күкірт қышқылын түсті металлургияның газдарынан алу.
5. Күкірт қышқылын өндіру тәсілдерінің тиімділігін салыстыру
3 дәріс
Күкіртті газды көп мөлшерде өндіруге шикізат ретінде құрамында күкірт бар табиғи минерал немесе өндіріс қалдықтары қолданылады. Қазіргі кезде күкіртті газды өндіруге негізгі шикізат ретінде күкірт колчеданы қолданылады. Колчедан құрамындағы күкірт мөлшері 35-50 %-ға дейін болады. Кен орындары: Орал, Кавказ және Орта Азия Республикалары.
Күкіртті газдың басқа да көзі бар, олар: түсті металдар сульфидтерін күйдіргенде күкіртті газ бөлінеді. Мұнай өнімдерін өңдегенде, көмірді кокстегенде және генератор газдарын өндіргенде көп мөлшерде күкіртті сутек бөлінеді. Күкіртті сутек күкіртті газдардың ерекше көзі болып табылады.
Күкірт қышқылын колчеданнан өндіру
Колчеданнан күкірт қышқылын алудың химиялық сұлбасы бір ізділікпен жүретін үш сатыдан тұрады:
- пирит концентратын ауа құрамындағы оттегімен тотықтыру:
4FeS 2 + 11О 2 = 2Fe 2 О 3 + 8SО 2 + 3400 кДж,
- күкірт диоксидін арттық оттегімен үшоксидке тотығу:
2SО 2 + О 2 = 2SО 3 ;
- күкірт қышылының пайда болуымен күкірт оксидін (VI) абсорциялау:
SО 3 + Н 2 О = Н 2 SО 4 .
Технологиялық безендіру бойынша колчеданнан күкірт қышқылын өндіруі өте күрделі және бірнеше тізбекті сатыдан тұрады. Бұл өндірістің құрылымды сызба-нұсқасы 1-суретте көрсетілген.
I - күйдіргіш газды алу сатысы: 1 - колчеданды күйдіру; 2- қазандық-утилизатор; 3 - газды жалпы тазартуы; 4 - газды арнаулы тазарту;
II - жанасу сатысы: 5 - жылуалмастырғышта газды жылыту; 6 - жанасау;
III - абсорбциялау: 7 - күкірт ангидридінің (VI) абсорбциясы және күкірт қышқылының пайда болуы
1 сурет - Флотацияланған колчеданнан Н 2 SО 4 өндірісінің құрылымды сызба-нұсқасы
Колчеданның күю процесі тізбекті және параллельді химиялық реакциялардан құралған күрделі үрдіс. Колчеданды 500 ºС-дан жоғары қыздырғанда пирит диссоцияланып, темір (II) сульфидін және күкірт түзеді:
2FeS 2 → 2FeS + S 2 .
Күкірт газ фазада жылдам күйіп күкіртті газға айналады:
S 2 + 2О 2 = 2SО 2 + Q.
Ал темір сульфиді мына теңдеу бойынша тотығады:
4FeS + 7О 2 = 2Fe 2 О 3 + 4SО 2 + Q.
Температура 600 ºС-дан төмен болса, онда темір сульфаттары түзіледі:
2FeS + 7О 2 = Fe 2 (SО 4 ) 3 + SО 2 .
Колчеданның жалпы күю жылдамдығы пирит ядросына оттектің диффузиясымен шектелінеді, яғни пириттің күюі ішкі диффузия саласында жүретін гетерогенді үрдіс болып табылады. Сондықтан пириттің күю жылдамдығы мына теңдеумен сипатталады:
,
мұндағы k m - масса беру коэффициенті;
F - фазалар жанасу беті;
∆C - үрдістің қозғаушы күші.
Теңдеу бойынша күю процесін жылдамдату үшін k m , F және ∆C көбейту керек. Сонымен үрдістің жылдамдығы температураға (k m арқылы), колчеданның дисперстілігіне (F арқылы), ауадағы оттек және колчедандағы темір дисульфид концентрациясына (∆C арқылы) байланысты. 2-суретте күю жылдамдығының бөлшек диаметріне және температураға тәуелділігі көрсетілген.
2 сурет - Колчеданның күю жылдамдығына температураның ( а ) және бөлшек диаметрінің ( б ) әсері
F көбейту үшін қатты компонентті 0, 03-0, 3 мм шамаға дейін ұсақтау керек.
∆C көбейту үшін өртеу аймақта колчедан құрамындағы пирит және оттектің концентрациясын көбейту керек. Ол үшін колчеданды флотациялап байытады және ауа құрамындағы оттек мөлшерін жоғарылатады (әдетте, стехиометриядан 30 % артық немесе 1, 2-1, 8 есе артық мөлшерде алады) .
k m көбейуі температураға байланысты. Тәжірибеде процесті 1000 ºС-дан аспай жүргізеді, өйткені одан жоғары шикізат бөлшектері балқып бірігіп агломератқа айналады, реакцияласушы беті тым төмендеп кетеді, осыған байланысты колчеданды күйдіру температурасы: 1) химиялық құрамы мен колчедан табиғатына; 2) пештің конструкциясына тәуелді.
Қазіргі кезде колчеданды күйдіруге конструкциясы әртүрлі пештер қолданылады:
1) механикалық көп сөрелі пеш «ВХЗ» (Воскресенск химиялық зауыты) (3- сурет) . ВХЗ пешінің барлық сөрелерінің ауданы 140 м 2 , бір сөреде тәулікте 31, 5 т колчедан күйдіріледі. Пештің қарқындылығы орта есеппен 225 кг/тәул 1 м 2 пеш сөресінен немесе 185 кг/м 3 . Күйдіргіш газдың құрамы: SО 2 9 %, О 2 9 %, N 2 82 %.
Кемшіліктері: құрылысы күрделі, қарқыны төмен, эксплуатациялау құны жоғары, тұғыл құрамында қалып 2-3 % күкірт тотықпайды және SО 2 күйдіргіш газында 7-9 % шамасынан аспайды.
2) Тозаң түрінде колчеданды күйдіретін пеш - флотацияланған құрғақ ұсатылған колчеданды ауа ағынында күйдіруге арналған (4 сурет) . Ішкі қабырғасы отқа төзімді болу үшін шамот кірпішімен қапталған. Пештің төменгі жағынан форсунка арқылы берілетін ауамен күйдіретін зат тозаң қалпында пеште күйеді. Күю үрдісі толық жүру үшін пешке жоғарғы жағынан қосымша ауа беріледі. Тұғыл пештің конус тәрізді түбінен бөлініп шығады. Газдар 1000 ºС температурамен штуцер арқылы «қазандық-утилизаторға» (котел-утилизатор) шығарылып, су буын дайындауға пайдаланады. Ары қарай күйдіргіш газ 275-425 ºС температурада тозаңнан тазартуға циклон аппаратқа, одан кейін құрғақ электрсүзгішке келіп тұғыл тозаңынан тазартады.
Күйдіргіш газдың құрамында SО 2 13 % құрайды. Пештің қарқыны тәулігіне 700-1000 кг/м 3. . Кемшілігі: колчедан біркелкі және құрғақ болуы қажет, газдың тозаңдылығы 100 г/м 3 (салыстыру үшін ВХЗ пешінде газ тозаңдылығы 10 г/м 3 ) .
3) «Қайнаушы қабатта» күйдіретін пеш (5 сурет) . Мұндай пештің төменгі жағында газ тарататын тор орналасқан. Тор астынан қысыммен белгілі жылдамдықпен ауа үрленеді. Бұл кезде ұнтақталған қатты зат (0, 01-0, 5 мм) бұрқылдатып, кайнап жатқандай түрге келтіреді. Соны «қайнаушы қабат» дейді. Мұндай «қайнаушы қабатта» қатты заттардың ұнтағы еркін жанасатын болғандықтан, ауамен жақсы араласып, ондағы химиялық реакция өте жоғары жылдамдықпен жүреді. Өндірілетін заттардың шығымы 3-4 есе артады.
Бұндай пештер тек күкірт қышқылының өндірісінде ғана емес, сонымен қатар басқада өндірістерде қолданылады.
Пеште күйдіру нәтижесінде алынған тұғыл арнаулы тесіктен бөлініп шығады, ал күйдірілген газ жоғарғы жағында орналасқан штуцерден шығады.
Пештің қарқындығы орта есеппен тәулігіне 1800 кг/м 3 немесе 1 кг/м 2. . Күйдірілген газда SО 2 14 % құрайды, тұғыл құрамындағы күкірт 0, 5 % құрайды. Реакция жылуын бу өндіруге пайдаланады. 1 т колчеданды өртегенде 1, 3 т бу алынады. Пештің кемшілігі: электр энергиясы көп мөлшерде жұмсалынады, күкіртті газ тым тозаңды - 200-300 г/м 3 .
5 сурет - Колчеданды қайнау қабатында күйдіретін пеш
Колчедан күйдіру нәтижесінде «күйдіргіш» газ және тұғыл (құрамында Fe 2 O 3 , бос жыныс және жанбаған темір дисульфид қалдығы бар) алынады. Орта есеппен колчеданды өртегенде массасының 70 %-ы тұғылға айналады. Тұғылды шойын балқытуға, түрлі минералдық бояулар өндіруге және микротыңайтқыштар ретінде қолданады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz