Мұнай өңдеудегі катализ процесінің құрылымы


Қазақстан Республикасы Білім және ғылым министрлігі
Каспий өңірінің қазіргі заманғы жоғарғы колледжі
Тіркеу номері Бөлімі: Мұнай және газ
« » 2018 жыл Мамандығы: 0819000 « Мұнай және газды газды қайта өңдеу технологиясы »
Тобы: 13. 15. 31
КУРСТЫҚ ЖОБА
Пәні: « Мұнай және газды өңдеу процестері мен аппараттары »
Тақырыбы: «Катализ процесінің құрылымы »
Орындаған: / Максутов Н. М. /
Жетекші: / Ерболатов А. Е. /
ПЦК комиссия
төрайымы: / Сакипова Г. С. /
Бөлім меңгерушісі: / Алтай Қ. А. /
Атырау 2018 жыл
« Мұнай және газды қайта өңдеу технологиясы »
13. 15. 31 тобы
Максутов Нурсат
Мазмұны
КІРІСПЕ
Химия ғылымының алғаш дамуынан бастап, химиялық айналуларга, реакцияға мағыналы түрде қатыспайтын заттардың жылдамдыққа әсерін тигізетін ғажайып құбылыстар ашылып, зерттелген. Олардың катарына: 1806 жылы француз ғалымдары Клеман мен Дезормомның ашылған азот оксидтерінің күкірт қышқылын өндіргенде кукірттің диоксидінің тотығуына әсері, Алманияда Кирхгофпен ашылған (1811-1814ж. ) араласкан қышқылдар мен арпа ашытқысының диастазасының қатысуында крахмалдың қантка айналуы, француз химигі Тенармен (1813-1818 ж. ) зерттелген көптеген қатты заттардың әсерінен аммиактың жэне сутек пероксидінің араласқан ерітінділерінің айырылуы, ірі ағылшын ғалымы Дэви мен (1817 жылы) Алмания ғалымы (1821 жылы) Деберейнермен ашылған бөлме температурасында платинаның қатысында спирттің, эфирдің жэне сутектің буларының тотығуы, Алманияда (1833 жылы) Митчерлихпен зертгелген күкірт қышқылының қатысында спирттен эфирдің түзілуі жэне т. б. ашылулар жатады.
Митчерлих ең алғаш рет қатынасты реакциялар деп аталатын бұл құбылыстардың жалпылыгын ашты. Дэл осы уақытта, қарастырылып жатқан құбылыстар үшін - катализ (грек сөзі кагаіизігайырылу ) деген жаңа атау беру туралы 1835 жылы ¥лы швед химигі Берцелиустың классикалық жұмысы жарық көрді.
1 ӘДЕБИ ШОЛУ
1. 1 Мұнай өндіру өндірісінің дамуындагы катализдің қызметі
Аталған катализ құбылысының ерекшеліктері, дәл айтқанда, катализатордың химиялық айналуларды энергияны жұмсамай тездетуі және катализатор затының өзін жүмсамайтыны катализді өндірісте химиялық айналуларды жүзеге асыру үшін қолданылатын құнды құрал ретінде көрсетеді, Тек кейбір каталитикалық өндірістік процестерге ғана тоқталайық. Катализ құбылыстары табиғатта кеңінен тарағанмен және адамға онымен ерте кездесуге тура келгенімен, катализ процесінің кең өндірісте қолданылуы тек XX ғасырда ғана басталды.
Каталитикалық процестер аммиактың синтезі үшін шикізат болып табылатын сутекті жэне химиялық технологияның басқа да өндірістері үшін колданылады. Сутектің арзан қайнар көзі - табиғи газ. Сутекті алудың бірінші деңгейі, бөлшекті түрде оттекті немесе ауаны 1130-1270 К температурада қосымша қосумен метанның су буымен өзара әрекеттесуінен түрады. Катализатор ретінде термотұрақты тасымалдауышқа жағылған, никель қолданады. Бүл реакцияның нәтижесінде сутекпен белгілі мөлшерде көміртек оксиді түзіледі. Төмен температурада оксидті катализаторды колданумен көміртек оксидінің су буымен СО-ны С0 2 -ге дейін тотықтыруға болады, бұл процесс барысында сутек түзіледі. Соңғы жылдарға дейін бұл реакцияны жүзеге асыру үшін катализатор ретінде хром оксидінің коспасы бар Ғе, 0 4 қолданды. Бұл катализатор температура 670 К -нен жоғары болганда ғана белсенді болады. Бұл температурада химиялык тепе-тендік:
СО +Н, 0*~* СО] + Н 2
Су буының артықшылығы болғанның өзінде сол жакка қарай ығысқан және соңғы қоспа аммиак синтезінің катализаторларының белсенділігін курт кемітетін, көміртек оксидінің біраз мөлшеріне ие болады. СО-ның қалдығын жою үшін, қысымның әсерімен Си 2 0- ның аммиакты ерітіндісімен газды коспаны күрделі шаюды колдану қажет болды. Соңғы жылдары мысқа эртүрлі шпинель пішінінде немесе баска да оксидті қосылыстар түрінде ие болатын, көміртек оксидінің су буымен әрекетесуінің жаңа катализаторлары табылды. Бұл катализаторлар көміртек оксидінің айналуын 450-560 К температурасында бастайды. Осының нәтижесінде, көміртек оксидінің мөлшері пайыздың ондық үлесіне дейін кемуі мүмкін, ал жуудың күрделі операциясы аммиак, метанның синтезі кезінде де, көміртек оксидінің қалдықтарының зиянсыз катализаторларга айналу үшін жай процеске ауыскан;
СО+ЗН 2 = СН 4 +Н 2 О
Бұл процесс - никельді катализаторлардың көмегімен каталитикалық түрде жүзеге ауысуы. Сонымен белсенділігі жоғарырақ болатын катализаторды дайындау технологиялық сызбанұсқаны біраз дәрежеге дейін жеңілдетеді.
Тағы да бір мысал ретінде мұнай өндірісінің каталитикалық крекингін келтірейік. XX ғасырдың 20 жылдары мұнай өндірісі катализаторды қолданбайтын, жоғары температураға дейін қыздырғанда ыдырайтын термиялық крекинг процестері мен ректификациямен ғана шектелген. Тек 30 жылдары ғана мұнай өндірісі үшін каталитикалық процестер қолданылу басталды.
Каталитикалық крекингтің негізін қалаушы француз инженері Гудри катализ бойынша II Халықаралық конгресте, 1935 жылы жарық көрген Американдық мұнай институтының мұнай өңдеудің өндірісінің күйі мен мүмкіншіліктері жайлы шолуында «катализ» сөзі бірде-бір рет ескерілмеген. Ал бірнеше жылдардан кейін каталитикалық әдістер өндірістің бұл саласында түбірлі өзгерістер жасағаны туралы өзінің баяндамасында көңіл аударып, атап өтті. Мұнай еңдеу өндірісінде катализді қолдану тиімділІгі өте маңызды болды, оның нәтижесінде бірнеше жылда катализаторларды қолданудың негізінде алынатын моторлы отынның шығысын да, сапасын да арттыруға мүмкіншілік беретін шынайы техникалық революция болды.
Қазіргі заманда 80% жоғары мұнай каталитикалық крекингті, риформингті, күкіртті косылыстардың гидрогенолизі, гидрокрекингті жэне басқа да каталитикалық процестерді қолдану арқылы өндіріледі. 1-кестеде мұнай өңдірісінің қазіргі заманда қолданылатын маңызды каталитикалық процестері келтірілген.
1-кесте.
Мұнай өндеудің қазіргі заманға сай каталитикалық процестері
№, Со, Мо жағылған косылыстарымен цеолиті бар катализаторлар жэне баска косиаларымен
РІ, РЦ №5 2 / АІзО. к (Со-Мо) / АІ 2 Оз жэне т. б.
Өткен уақытта каталитикалық крекингті синтетикалық және табиғи алюмокремнийлі, кремниймагнийлі, алюмокремнийцир- конийлі жэне қышқыл табиғаты бар тағы басқа катализаторларды қолданып, 670-770 К температурада өткІзетін. Соңғы жылдары кристалды синтетикалық цеолиттердің негізіндегі катализаторлар кең өндірістік қолданысқа ие болды. Бұл катализаторлардың әсіресе, сирекжер элементтердің оксидтері бар катализаторлардың белсенділігі аморфты алюмосиликатты катализаторларға карағанда, жоғары болады.
Катализаторларды қолдану төменірек молекулалы массасы бар көмірсутектердің түзілуінің жылдамдығың ғана арттырып қоймай, сонымен қатар, термиялык крекингке қарағанда, кұнды фракциялардың шығуын арттыруға мүмкіншілік береді.
Кокстектес калдықтардың түзілуінің нэтижесінде крекинг процесс барысында катализаторлардың белсенділігі төмендейді, бірақ оттегісі бар ортада күйдіру жолы аркылы түгел қайтадан қалпына келтірілуі мүмкін.
Әсіресе, крекингтің тэртібі реактор мен регенератор аркылы катализатордың циркуляциясын жеңілдетуге мүмкіншілік беретін, жалған сұйылған жіңішке дисперсиялы катализатордың қабатында эсерлі болады.
Каталитикалық крекинг жоғары тонналы өндірістік каталитикалық процесс болып табылады. Оныц көмегі арқылы қазіргі заманда жылына 300 млн. т мұнай өшенеді, бұл жыл сайын 300 мың т. катализаторларды жұмсауды қажет етеді.
Каталитикалық крекингтің негізгі мақсаты-вакуумды газойльдердең жэне олардың атмосфералы жәңе вакуумды айдаулардың қалдықтарының қоспасынан жеңіл көлікті жанармайлардың және майлы газдардың жоғарыоктанды құрауыштарын алу болып табылады. Каталитикалық крекингтің жанармайы жақсы детонациялық көрсеткіштерге ие болады. Жанармайдың октан саны (моторлы эдіс бойынша) - 80-85-ке тең болады.
Каталитикалық крекингтің бутан бутиленді фракциясы алкилдеу процесінің шикізаты ретінде жанармайдың жоғары сапалы құрауышы -алкилатты алу үшін қолданылады. Газдың пропан- пропиленді жэне этан-этиленді фракцияларын органикалық синтездің процестеріне арналған шикізат ретінде қолданады. Крекинг барысында алынатын газойльдерді жақсартудан кейінгі дизельді отынның құрауыштары ретінде қолданады.
Кейінірек, XX гасырдың 50-жылдары мұнай өңдеу өндірісінде каталитикалық риформинг кеңінен қолданыла бастайды. Бұрын бұл процесті 740-790 К температурада жэне 1, 5-4 МПа кысымда жүргізеді, катализатор ретінде алюминий оксидіне жағылған, қышқылдық қасиеттерді артгыру үшін хлорлы сутекпен өнделге платинаны басымырақ турде қолданады. Казіргі заманда жаңа полиметалды катализаторларды қолдану арқылы процесс 0, 8-1, 5 МПа қысымда жүргізіледі.
Каталитикалық риформинг - жогары октанды қүрауыш ретінде немесе олардан жеке ароматты көмірсутектерді бөлу үшін қолданылатын жоғары ароматгы дистиллятгарды тура айдаулы жанармайлы фракциядан алатын, мұнай өндеу өнеркэсібінің ең ірі процессі болып табылады.
Риформинг процесінің барысында нафтендерді ароматты көмірсутектерге дегидрлеу реакциялары өтеді, парафиндер мен олефиндердің циклизациясы мен бесмүшелі көмірсутектердің алтымүшелі көмірсутектерге изомерлеу реакциялары өтеді.
Қазіргі заманда каталитикалық риформинг жылына 200 млн. тоннадан астам мұнайды өлшеу үшін қолданады. Оны қолдану тек моторлы отынның сапасын ғана арттырып коймай, сондай-ақ, химиялық өндірістің қажеттілігі үшін ароматты қосылыстардың біраз мөлшерін өндіруге мүмкіншілік берді.
Сутек каталитикалық риформингтІң жанама өнімі болып табылады. Арзан сутектің пайда болуы Н 2 3 түрінде болатын күрамында күкірті бар мұнай өнімдері үшін каталитикалық гидротазалауды кеңінен қолдануға мүмкіншілік берді. Бұл мақсат үшін гидрлеудің әртүрлі катализаторлары қолданады. Алюминий оксидіне жағылған, кобальт және молибденнің оксидтерінен жасалатын катализаторлар кең қолданысқа ие болды. Одан басқа, болашагы бар катализаторларға сол каталитикалық композициялар, бірақ цеолиттердің қоспалары бар катализаторлар жатады.
Процесті өткізу шарттары тазаланатын шикізаттың қасиетіне тәуелді болады, бірақ жиірек 600-680 К мен 3-5 МПа арасында жатады. Гидротазалауға жыл сайын 300 млн. т. мұнай өнімдері ұшырайды. Бұл процесс күкірттің біраз мөлшерін алуға мүмкіншілік береді, мұнай өңдеудің келесі каталитикалық процестерін жеңілдетеді, сондай-ақ, моторлы отынды жандырғанда пайдаланылған газдармен атмосфераны ластауды кемітеді.
Соңғы уақытта крекинг, изомеризация жэне гидротазалау процестері бір уақытта өтетін гидрокрекинг процесі маңызды дамуға ие болды. Катализаторларды қолдану бұл процесті 520-740 К, 5-15 МПа қысымда өткізуге және жоғары цетанды саны бар дизельді отынның біраз мөлшерлі шығуын алуға мүмкіншілік бередІ. Катализатор ретінде вольфрам сульфидін, тасымалдауыштардың негізіндегі араласқан вольфрамникельді сульфидті катализаторларды, Иі, Рі, Р<і қоспалары бар алюминий оксидіндегі жэне аморфты немесе кристалды цеолиттер негІзіндегі басқа да металдардың кобальт-молибденді катализаторларды қолданады.
Жанармайдың сапасын арттыру үшін әртүрлі тасымалдауыштар негізіндегі платиналы және палладийлі катализаторларды қолданатын каталитикалық изомеризация процестері қолданады.
Жоғарыда айтылған қағидалардан каталитикалық процестердің мұнай өндірісінде маңызды орынға ие болатынын түйіндеуге болады. Катализ арқылы мұнайдан алынатын өнімдердің қүндылығын бірнеше есе арттыруға болады. Бұл өріс қазіргі күні де жалғасуда. Мұнай бағасының өсуіне байланысты оның құрауыштарының барлығын қолдану маңызды болып табылады. Болжау бойынша мұнай бағасының өсуі жалғаса береді, себебі біртіндеп эксплуатация үшін оның үлкен қиындықтары болатын қайнар көзіне өтуге тура келеді. Сондықтан мұнайдан құнды өнімдерді бөлу маңызды болып табылады, бұл жақсы катализаторларды колдану арқылы жүзеге асады.
1. 2 Гетерогенді катализкезінде өзара әсерлесудің негізгі аралық деңгейлері
А затының изомеризациясына немесе диссоциациясына акелетін қарапайым мономолекулярлы реакцияның жағдайында:
А ^ А' немесе А -> Р + С2
Каталитикалық айналу:
Физикалық адсорбция Хемосорбция -» реакция өнімдерінің физикалыц адсорбциясы деңгейлерінен тұрады .
Реакция жолының бойымен энергияның өзгеруі 2 - суретте көрсетілген. Физикалық адсорбция (II нүкте) үлкен жылдамдықпен белсенділік энергияның қатысынсыз жүреді және катализатордың бетінің біртекті жабылуына әкеледі. Температура артқан сайын, біртекті бет кемиді жэне белгілі температурадан бастап, тікелей хемосорбция процесі жүзеге асырылуы мүмкін. Әсерлесетін заттың хемосорбциясы, энергиясы эсерлесетін заттың энергиясынан артық болатын, демек, көп жағдайларда белгілі белсенділік энергиясымен сипаттапатын белсенді жиынтық арқылы (1 нүктесі) жүзеге асады. Белсенділік энергиясының өлшемі (Е 2 ) хемосорбцияның жылдамдығын анықтайды.
Хемосорбция барысында (III нүктесі) әсерлесетін заттың молекуласында кейбір байланыстардың үзілуі мен әлсізденуіне жэне қатты катализатордың беттік атомдарымен жаңа байланыстардың түзілуіне экелетін электрондық тығыздықгың ығысуы жүреді. Бұл өзгерістер белгілі жағдайларда белсенді жиынтық (2) арқылы реактанттардың хемосорбирленген реакция (IV) өнімдеріне айна- луларыныңбелсенділік энергиясының кемуіне әкеледі. Белсенділік энергиясы (Е 2 ) бұл деңгейдің жылдамдығын сипаттайды және хемосорбциянын өнімініңэнергиясы мен құрылысын анықтайтын, химиялық айналулардың түріне және катализатор мен реактанттың табиғатына тәуелді болады. Реакция өнімдерінің десорбциясы да, реакция өнімдерінің хемосорбциясының жылулығы жоғары болған сайын, белсенділік энергиясымен байланысты (Е 3 ) (1-сурет) болады. Физикалық түрде адсорбцияланған реакция өнімдерінің жылулыгынан бірнеше есе төменболатын, оның физикалық адсорбциясының жылулығына тең болатын белсенділік энергиясын қажет етеді және сондықтан, өнімдермен физикалық түрде адсорбцияланған катализатордың бетінің жабдықталуы тепе-теңдікті болады. Хемосорбция деңгейінің жылдамдыгы, химиялық айналуы жэне десорбциясы катализатор менәсерлесетін заттың табиғатына байланысты белсенділік энергиясының эр түрлі мэндерімен сипатталады.
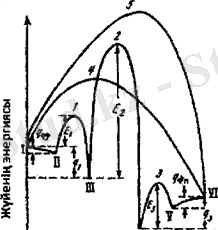
1-сурет Мономолекулярлы айналулардың гетерогендІ катализі барысында 1 реакция жолы бойынша қозгалыс кезінде энергияның өзгеруі.
I. Бастапқы зат; II. Бастапқы заттың физикалық адсорбциясы; III.
Бастапқы заттың хемосорбциясы; IV. Реакция
өнімдерінің хемосорбциясы; V. Реакция өнімдерінің физикалық
адсорбциясы; VI. Реакция өнімдері;
1, 2, 3 - хемосорбцияның белсенді жиынтығы; 4-хемосорбциясыз
жүретін қаталитикалық реакцияның белсенді жиынтығы;
5- катапитикалық емес реакцияның белсенді жиынтығы;
Е,, Е 2 , Е 3 - сәйкес белсенділік энергиясы;
Чф
Р
Я
ф в
- реагенттер мен өнімдердің физикалық адсорбциясының
сәйкесінше жылулыгы
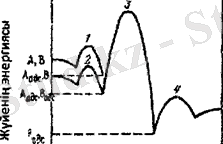
2-сурет Каталитикалық гетерогенді бимолекулярлы
реакцияның энергиясының өзгеруі.
1, 2, 3, 4 - А және В реактанттарының хемосорбциясының
белсенді жиынтығы
Әртүрлі деңгейлердің экспоненциал алдындағы көбейткіштері эртүрлі болатынын ескерту қажет, бүл себептен эрқашан ең жоғары энергиялық шыңы бар деңгей ең баяу болады деп бекітуге болмайды. Солай қарастырылған мономолекулярлы реакцияда хемосорбция жылдамдығы:
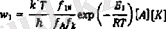
( 1 )
Егер К, X және белсенді жиынтықтар беттің үстінде жайылдырылмаса жэне тек толқынды бос дәрежеге ие болса, онда Г к , Ғ мәндері 1-ге жақын болады.
і А , С к , Г - хемосорбирленген реактант молекуласының және өнімнің хемосорбирленген молекуласының хемосорбдиясы жүретін, катализатор бетінің аумағының, газды фазада әсерлесетін заттың күйінің қосындылары;
Е - белсенділік энергиясы; [А] - газды фазада әсерлесетін заттың концентрациясы, моль/ см 3 ; [К] -1 см 3 газды фазаға жататын бос аймақтардың саны; [X] - әсерлесетін заттың хемосорбирленген молекуласымен алынған аймактар үшін; [Ү] - өнімніңхемосорбир- ленген молекуласымен алынган аймақтар үшін.
Онда реакцияға қатысатын беттің бір аймағына жататын деңгейдің жылдамдыгының қатынасы:
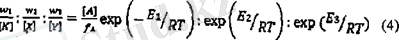
теңдігіне ие болады
Газды фазада (Ғ д ) көпатомды молекуласы күйінің қосындысы 10 26 -10 29 арасында жатады. А концентрациясы оның қысымы мен температурасына тәуелді болады. Атмосферлы қысым мен 500 К [А] =1, 6 • 10 20 температурада жүреді. Бүл шарттар үшін К. Т Іп ([А] Б £ д ) 50-75 кДж арасында жатады.
Бетгің бір бос аймағына жататын екінші (\\’ 2 Б [X] ) жэне үшінші (\ү 3 [Ү] ) сәйкес келетін деңгейлердің жылдамдығына жақын болуы үшін, хемосорбцияның жылдамдығы бүл өлшемге Е ^ Е 2 және Е 3 - тен кем болуы керек, Егер К кейбір темпера- турада \у 2 Б К және \ү 2 О К ие болатын ретке ие болса, онда температура артқан сайын бірінші өлшем басқа өлшемдерден кем болады және хемосорбцияның деңгейі лимитгелген болады. Бүл кезде байқалатын белсенділік энергиясы және стационарлы X .
Ақырғы жағдайда реактанттың қалыпты хемосорбирленген күйі пайда болмауы жэне қатты катализатормен өзара әсерлесуі катализатордың қатысында бір белсенді жиынтықтың түзілуімен шектелуі мүмкін. Катализатордың айналуы бір мезетте реакцияның өніміне және катализатордың бетінің аймағына босатылуына әкеледі. Каталитикалық реакцияның сәйкес жолы 1-суретте 1-4-VI сызығымен белгіленеді.
Жүргізілген анализде барлық деңгейлердің қайтымсыздығы болжанады. Қайтымдылық кезінде шапшаң деңгейлер аралық өнімдердің -теңдігіне әкеледі. Мысалы, егер реактанттың хемосорбциясының жэне өнімдердің десорбциясының деңгейлері химиялық айналулардың деңгейлеріне және газды фазадағы концентрациялардың катынасына қарағанда тез жүрсе, төменде көрсетілген тепе теңдік орындалады.
[Х. ] р мен [Ү. ] - тің тепе - тең мәндерІне қол жеткізсе, онда реакцияның жылдамдығы:
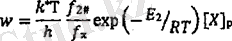
теңдігімен сипатталады.
1. 3 Катализаторлар жайлы жалпы мағлұматтар
Катализаторлар - бұл өзгермейтін жэне соңгы өнімдердің құрамына кірмейтін, химиялық реакцияларды қозғайтын немесе олардың жүруін тездететін заттар. Олар кез келген каталитикалық процестің ең қажет бір бөлігі болып табылады жэне химиялық реакциялардың белсенділік энергиясын төмендетуге мүмкіншілік береді. Катализатордың қолайлы құрамын таңдау арқылы процестің еңжоғары тиімділігіне қол жеткізе отырып, бүтін жэне жанама реакциялардың жылдамдықтарының қатынасын қадағалайды. Катализаторлардың қатысында реакцияларды жүргізу олардың жүруі барысындағы температурасын кемітуге мүмкіншілік береді. Алайда, егер термодинамика тұрғысынан қандай да бір реакцияның жүруі мүмкін болмаса, онда оны катализаторлар көмегімен де жүзеге асыруы мүмкін емес екендігін ұмытпау кажет.
Мұнай өңдеу өнеркәсібінде цеолитІ бар, алюмосиликатты және т. б. бірқатар катализаторларды қодданады. Цеолиті бар катализаторларды жетілдіру, олардың белсендігін, тұрактылығын жэне селективтілігін көтеру қажеттілігімен байланысты. Катализатордың қасиеті түсінігінде селективтілік, активтілік, тұрақтылық жэне оның кұрылысының кеуектілігі.
Катализатордың талғамдылығы деп, берілген шарттарда және берілген шикізатты құрауыштар үшін термодинамикалық қатардан мүмкін болатын, оның бір немесе бірнеше бүтін химиялық реакцияларды тездету қабілеттілігін айтады.
Катализатордың белсенділігі шикізаттың қүрауыштарын соңгы өнімге айналдыру және белгілі дәрежеде процестің өндірістілік қабілеттілігін сипаттайды. Ол жоғары болған сайын, уақыт бірлігінде бастапқы заттардың белгілі мөлшерінің өнімге айналуы үшін қолданатын катализатордың мөлшері аз болады. Катализатордың белсенділігі тек қана белсенділік орталықтарының күшінен ғана емес, сондай-ақ, оның бетінің күйіне де тәуелді. Катализатордың белсенділігінің елгнем бірлігін зертханалық жағдайларда өткізеді, бұл жерде зерттелетін процесті қатаң берілген параметрлерде өткізеді. Катализатордың белсенділігі оны қолданған сайын кемиді. Катализатордың өзінің касиетін сыртқы фактордың әсерінен сақтау қабілеттілігін тұрацтылыцрхчи атайды.
Жиірек катализатордың белсенділігінің кемуіне оның құрылысының бұзылуы немесе белсенді орталықтардың дезбелсенділігі себеп болып табылады, бұл оларға немесе уақ тесіктеріне кокстектес заттардың бөлінуі нәтижесінде, яғни шикізаттың құрамында болатын және каталитикалық улар депаталатын кейбір қоспалардың әсері салдарынан келеді.
Катализатордың құрылысының бұзылуы, оның жеке бөлшектерінің бірігуі жэне басқа да процестері процестің қатаң шарттарымен шақырылуы, жеке айтқанда, жоғарылаған температурамен, су буларының әсерімен және т. б. шақырылуы мүмкін.
Кокстектес заттар бөлшектердің бетінде жэне катализаторлардың уақ түйіршіктерінде полимеризация, конденсация және тығыздалу жанама реакцияларының нэтижесінде жиналады. Түзілген полиароматы қүрылысты ірі молекулалар, бір жағынан, белсенді орталықта берік адсорбдияланады, ал бір жағынан, катализатордың микротүйіршіктерінің диаметрін асыратын мөлшерлерге ие бола отырып, олардан шыға алмайды. Нәтижесінде олар катализатордың бүкіл бетін жабдықтай отырып, адсорбцияның жүруіне және көмірсутектік шикізаттың жүруіне кедергі келтіре отырып, кейінгі тығыздалуға ұшырайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz