S-блок элементтері (IA және IIA топтары): электрондық құрылымы, химиялық қасиеттері, алынуы және қолданылуы


Кіріспе
S элементтердің электрондық қабығы алғашқы екі S-электроннан тұрады. Мұндай элементтер s-блок деп аталатын топқа біріктіріледі.
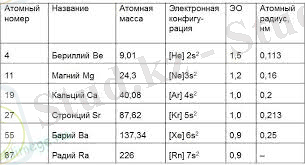
Оларға периодтық жүйенің екі тобы кіреді: IA және IIA, IA тобына 8 элемент кіреді: литий, калий, натрий, рубидий, цезий, франций, сутегі, гелий. IIA тобына 6 элемент жатады: бериллий, магний, кальций, стронций, барий, радий.
S-элементтердің ерекшелігі, атомдардың жоғары энергиялы электрондары s-орбитальдерінде болады. Сутегі мен гелийді қоспағанда, бұл электрондар өте оңай бөлініп, химиялық реакция кезінде оң иондарға айналады.
S-элементтердің қаттылығы (қалыпты жағдайлар кезiнде) өте аз мөлшерден бастап(барлық сілтілік металдар - пышақпен кесуге болады) өте жоғары (бериллий) болуы мүмкін. Берилий және магнийді қоспағанда металдардың жоғары реакциялық қабiлетi бар. Бұл металдар өте маңызды болып табылады, себебі титан, цирконий, торий және танталдың минералды нысандарының өндірісінде үнемдеуге мүмкіндік береді; органикалық химияда кеңінен қолданылады.
Литий-термоядролық энергетикада қолданылады; Cs-генераторларында және ионды ракеталық қозғалтқыштарда; Be, Mg Li-да - ауа және ғарыш салалары үшін арнайы қорытпаларды өндіруде қолданылады. Калий, магний, кальций, азот және фосфор өсімдіктерге өте қажет. Оларды кез-келген басқа элементтермен алмастыру мүмкін емес.
IА тобының металдары сілтілік металдар деп аталады. Олар сумен белсенді әрекеттескенде сілті түзетіндіктен осылайша аталған. Натрий және калий (элементтердің таралуы бойынша Na алтыншы, К - жетінші орында ) табиғатта кең таралған; литий, рубидий, цезий - сирек элементтер, франций - жер қыртысында болмайтын радиоактивті элемент. Ядродан қашықтау валенттік электронның ядромен байланысының әлсіреуіне әкеледі, сондықтан металдардың химиялық белсенділігі топта жоғарыдан төмен қарай өседі. IА тобының элементтерінің сыртқы электрондық қабатында бір электрон ядромен әлсіз байланысты болғандықтан, оны беріп жіберіп, күшті тотықсыздандырғыш болады.
II топтың металдарына жалпы сипаттама
ІІ топтың негізгі топшасына берилий Be, магний Mg, кальций Cа, стронций Sr, барий, барий Ba, радий Ra жатады. Мұндағы кальций, стронций, барий сілтілікжер металдарға жатады. Олар s-элементтерге. Қарапайым күйінде типтік металдар түрінде болады. Сыртқы деңгейде екі электрон бар. Оларды бере отырып, олар қосылыстарда +2 тотығу дәрежесін көрсетеді. Тотығу-тотықсыздану реакцияларында топшаның барлық металлдары күшті тотықсыздандырғыш болады, алайда сілтілік металдарға қарағанда біршама әлсіз. Бұл II топтағы металдар атомдары сол периодта орналасқан тиісті сілтілі металдардың атомдарына қарағанда радиусы кішірек болуымен түсіндіріледі. Бұл электрондық қабаттардың сығылуына байланысты, өйткені сыртқы электрон қабатының s-кабықшасы толық, сондықтан оларға электрондар күштірек тартылады.
Сілтілі металдардан айырмашылығы, сілтілік жер плазмалық және қан клеткаларында өтпелі металдар сияқты, яғни ион радиусының ұлғаюымен, плазмада металдың мөлшері артады. 2 топтағы металл иондары сілтілі металдар иондарына қарағанда комплексті қосылыстар түзуге бейім.
Осы ns2-металдардан ең маңыздысы Mg және Ca болып табылады. Тірі организмдерде олар макроэлементтерге жатады. Мәселен, ересек адам денесінде 1 кг Ca (99% дейін сүйектері мен тістерінде) және шамамен 25 г Mg бар. Олардың маңыздылығы метаболизм процестеріне, қанның ұюына, бұлшықеттердің жиырылуына және жүйке жүйесінің жұмысына әсер етеді.
Атомдық
нөмірі
Атомдық
салмақ
- Жай заттармен әрекеттесуі.
Барлық элементтер оттегі және күкіртпен оңай өзара әрекеттесе отырып, оксидтер мен сульфаттарды түзеді:
2Be + = 2BeO
Ca + S = CaS
Бериллий мен магний қыздырылған кезде оттегі мен күкіртпен реакцияға түседі, ал қалған металдар қалыпты жағдайда әрекеттеседі.
Бұл топтың барлық металдары галогендермен оңай әрекеттеседі:
Mg + C = MgC
Қыздырған кезде барлығы сутегі, азот, көміртек, кремний және басқа металдармен өзара әрекеттеседі:
Ca + = Ca (кальций гидриді)
3Мg + = М (магний нитриді)
Ca + 2C = Ca (кальций карбиді)
Кальций карбиді - бұл түссіз кристалды зат. Әртүрлі қоспалардан тұратын техникалық карбид сұр, қоңыр және тіпті қара түсті болуы мүмкін. Кальций карбиді сумен ыдырайды
Кальций карбиді сумен әрекеттескенде маңызды химиялық өнім болып табылатын ацетилен түзе отырып ыдырайды.
Ca + 2 O = Ca(OH +
Балқыған металдар басқа металдармен әрекеттесе алады, мысалы, CaS , C Sn.
- Сумен өзара әрекеттеседі. Бериллий сумен өзара әрекеттеспейді, себебі реакцияға металл бетіндегі оксидті қорғаныш пленкасы кедергі келтіреді. Магний сумен қыздырғанда реакцияға түседі:
Mg + 2 O = Mg (OH) 2 +
Қалған металдар қалыпты жағдайда сумен белсенді өзара әрекеттеседі:
Ca + 2 O = Ca (OH) 2 +
- Қышқылдармен әрекеттесу.
ІІ А топшаның барлық элементтері тұз қышқылы мен сұйылтылған күкірт қышқылымен әрекеттеседі:
Be + 2HCl = BeC +
Сұйытылған азот қышқылымен металдар негізінен аммиак немесе аммоний нитратына дейін тотықсыздандыра отырып әрекеттеседі:
2Ca + 10HN = 4Ca (N + N N + 3 O
Концентрленген азот және күкірт қышқылдарында (қыздырусыз) бериллий пассивтеледі, ал қалған металдар осы қышқылдармен реакцияға түседі.
- Сілтілермен әрекеттесу.
Бериллий сілтілердің сулы ерітінділерімен өзара әрекеттесіп, комплексті тұз және сутегі түзеді:
B NaOH + 2 O = N [Be(OH ] +
Магний сілтілік жер металдармен реакцияға түспейді. .
5. Оксидтермен және металл тұздарымен өзара әрекеттесу.
Магний және сілтілік жер металдары көптеген металдарды олардың оксидтері мен тұздарынан тотықсыздандыра алады.
TiC + 2Mg = Ti + 2MgC
+ 5Ca = 2V + 5CaO
Бериллий, магний және сілтілі жер металдардың хлоридтерінің балқымаларын электролиздеп немесе олардың қосылыстарын термиялық тотықсыздандырып алады:
Be + Mg = Be + Mg
MgO + C = Mg + CO
3CaO + 2Al = 2Ca + A
3BaO + 2Al = 3Ba + A
Радийді RaC сулы ерітіндісі мен сынап балқымасының электролизі нәтижесінде алады.
СІЛТІЛІКЖЕР МЕТАЛДАР ( ІІ А ТОПША)
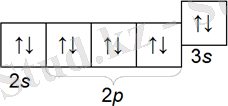
Б е р и л л и й (лат. Beryllіum), Ве - Элементтердің периодтық жүйесінің ІІ тобындағы химиялық элемент, атомдық Рр изотопы (9Ве) бар. 4 Ве ) 2 ) 2 1s 2 2s 2 2p химиялық реакция кезінде оның 2s 2 орбитасындағы бір электрон 2p орбитасына промотталады (электронның басқа орбитаға өтуі) сонда максимал коваленттілік - IV болады: 2 байланыс алмасу механизмі бойынша, 2 байланыс донорлы-акцепторлық механизм бойынша түзіледі. 1798 ж. берилл минералынан француз химигі Л. Воклен тапты. Металл күйінде алғаш рет неміс химигі Р. Влер алды. Бериллий алюминийден жеңілірек, тығыздығы 1, 816 г/см 3 , балқу температурасы 1284 0 С, қайнау температурасы 2450 0 С, химиялық қосылыстарында 2 валентті, беткі қабаты тотығып, қорғауыш қабыршақ түзілетіндіктен ауада өзгермейді. 800 0 С-тан жоғары температурада қыздырғанда жылдам тотығады; қышқылдарда да, сілтілерде де ериді.
Сілтілерде еріп бериллаттар деп аталатын тұздар түзеді (мысалы, натрийбериллаты - Na 2 BeO 2 ) . Бериллий галогендер, оттек, күкірт және азотпен тікелей қосылып, оттекпен оксид (BeO), азотпен нитрид (BeN 2 ), көміртекпен карбид (Be 2 C), күкіртпен сульфид (BeS) қосылыстарын түзеді.
Табиғатта кездесуі
Жер қыртысында бериллийдің орташа мөлшері 3, 8 г / т. Бериллийдің магмалық жыныстарда көптеп кездесуі плагиоклаздармен байланысты, онда бериллий кремнийді ығыстырады.
Берилийдің алынуы
Бериллий алуда қолданылатын негізгі шикізат - берилл және гельвин минералдары. Металл бериллий хлорлы бериллийді балқытып электролиздеу арқылы алынады.
BeCl
2
 Be + Cl
2
;
Be + Cl
2
;
BeCl 2 + Mg = Be + MgCl 2
Сонымен қатар, бериллий металын магниймен BеF 2 қосылысын тотықсыздандырып алады, магнийдің артық мөлшерін вакуумда қайта айдап бөледі, алынған бериллий әрі қарай дистилдеу әдісімен тазартылады.
Берилийдің қолданылуы
Бериллийді құймаларға араластырғанда қаттылығы артады, бұл бағалы қасиеті бұрыннан белгілі болса да, оны қолдану тек 20 ғасырдың 40-жылдарында басталды. Баяу балқитын металдардың бериллидтері - авиация және ракета жасауда аса қажетті зат. Рентген сәулелері бериллийден жақсы өтетін болғандықтан, одан рентген трубкаларының терезелерін дайындайды. Бериллий әр түрлі құймалар және коррозияға берік болат алуда, электротехникада, атом реакторларын жасауда кең түрде қолданылады. Қазақстанда бериллий Өскемендегі титан-магний комбинатында өндіріледі.
Химиялық қасиеттері
Бериллийге тек бір ғана +2 тотығу дәрежесі тән. Берилийдің көптеген химиялық қасиеттері сәйкес топта тұрған магнийге емес, көбіне алюминийге ұқсас («диагональды ұқсастық» көрінісі) . Олардың стандартты электродтық потенциалдары (Е 0 Ве2+/Ве = -1, 7В, Е 0 Al3+/Al = -1, 67В) өте жақын, сондықтан қасиеттері ұқсас: Be, Al - амфотерлі элементтер.
Ве + 2NaOH +2H 2 O → Na 2 Be(OH) 4 + H 2 ↑.
Be+Г 2 → ВеГ 2 галогенидтер, реакция қыздыру нәтижесінде жүреді;
2Be+О 2 → 2ВеО оттегіде жанады;
Жоғарғы температурада азотпен, күкіртпен әрекеттеседі: 3Be + N 2 → Be 3 N 2 ;
Be + S → BeS түзіледі.
Бериллий бөлме температурасында салыстырмалы түрде аз реакцияға түседі. Қалыпты күйінде ол тіпті сумен және су буымен әрекеттеспейді, тіпті ауамен 600C-қа дейін тотықпайды. Бериллий ұнтағы өртелгенде жарық жалынмен жанады. Галогендер бериллиймен 600 ° C жоғары температурада әрекеттеседіі, ал халькогендер тіпті жоғары температураны қажет етеді. Аммиак 1200 ° C температурада бериллиймен әрекеттесіп, B нитридін түзеді, ал көміртегімен 1700 ° С температурада B карбидін түзеді.
М а г н и й- иондану энергиясы бериллийге қарағанда аз, сондықтан Mg қосылыс түзгіш, тірі организмде, мысалы, хлорофилл құрамында болады.
Кездесуі және алынуы: Силикаттар, хлоридтер, карбонаттар, сульфаттар түрінде кездеседі. MgCl 2 , балқыма → электролиз Mg+Cl 2 және доломиттен карботермиялық әдіспен алады. Қосылыстары:
MgCO 3 - магнезит;
CaCO 3 ×MgCO 3 - доломит;
KCl×MgCl 2 ×6H 2 O карналлит.
Физикалық және химиялық қасиеттері: Mg - парамагнитті, активті металл.
Mg+H 2 O → суық жағдайда жүрмейді;
Mg + H 2 O → t0 Mg(ОН) 2 + Н 2 ↑.
Минералды қышқылдарда ериді, HF-да ерімейді.
Mg + Н + → Mg 2+ + . . . , Mg+HF → жүрмейді. Сілтілерде ерімейді:
Mg + OH - → жүрмейді. Магний ауада жанғанда оксид пен нитрид қоспасын береді; галогендермен, халькогендермен, пниктогендермен қыздырғанда қосылыстар береді: Mg + ауа → t0 MgO + Mg 3 N 2 ;
Mg+Cl 2 → t0 MgCI 2 ;
Mg+S→ t0 MgS.
3Mg+N 2 → t0 Mg 3 N 2 .
MgO Т б =2850 0 C; магний оксиді сілтілерде ерімейді. Ауада сақтағанда біртіндеп Mg(OH) 2 +MgCO 3 қоспаларына айналады.
Mg(ОН) 2 суда, сілтілерде ерімейді, күші орташа негіз. MgF 2 -ден басқа галогенидтері суда жақсы ериді. MgSO 4 . 7H 2 O; сілтілік металлдармен қос тұз түзеді: Ме 2 SO 4 ×MgSO 4 ×6H 2 O.
Қолданылуы : Ti, Zr, V, U металдарын алу үшін Mg-термия арқылы; Магнийге Al, Zn, Mn қосылған «электрон» деген балқымасы ең жеңіл конструкционды материал, берік, ракета, авиация, автомобиль құрылысында колданылады.
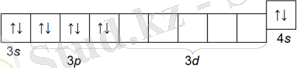
К а л ь ц и й IV период, II топтың негізгі топшасының элементі. Реттік немірі 20, ендеше ядросында 20 протон мен 20 нейтроны бар (А r =40), электрондарының жалпы саны да 20, валенттілік электрондары 4s 2 болғандықтан кальций косылыстарында II валентті. [1]
 Ашылуы: 1808жылы ашылған, латынның «калькс» известь сөзінен шыққан, яғни жұмсақ, оңай өңдірілетін әк, бор минералдарынан атау алған. 1808 жылы ағылшын ғалымы Дэви электролиз арқылы кальцийді алды.
Ашылуы: 1808жылы ашылған, латынның «калькс» известь сөзінен шыққан, яғни жұмсақ, оңай өңдірілетін әк, бор минералдарынан атау алған. 1808 жылы ағылшын ғалымы Дэви электролиз арқылы кальцийді алды.
Табиғатта таралуы
Жер қыртысында кальций-оттек, кремний, алюминий және темірден соң таралымы, мөлшері жөнінен бесінші элемент болып табылады. Массалық үлесі-2, 69%
Кальций 385-ке жуық минерал құрамына кіреді. Оның ішінде ең көп таралғандары:
сульфаттар CaS0 4 • 2 0 ғаныш,
карбонаттар - СаС0 3 , доломит СаС0 3 • 2MgC0 3 ;
фосфаттары фосфорит Са 3 (Р0 4 ) 2 , апатит Са 5 (Р0 4 ) 3 0Н, фторапатит Са 5 (Р0 4) 3 Ғ, флюорит СаҒ 2 .
Алынуы
1. Кальцийді кальций хлоридінің балқымасын электролиз'- деп алады.
СаCl→Са+C
2. Кальцийді алюминотермия және кальций карбидін ыдыратып алу жолдары жетілдіруде:
3СаО+2Аl→3Са+ A
СаС2→Са+2С
Физикалық қасиеттері
Кальций ақ түсті, жеңіл (р=1, 55 г/см 3 ), сілтілік металдардан қаттырақ зат, t°балқу = 851°С, керосиннің астында сақталады.
Ат. н. 20; ат. м. 40, 08; балқу t 842°С; қайнау t 1495°С тығыздығы 1, 55 г/см 2 . Түсі күмістей ақ, жеңіл металл, белгілі изотоптары 14, табиғи изотоптары 6. Негізгі минералдары: кальцит, ангидрит, гипс, флюорит, апатит, т. б.
Химиялық қасиеттері
Кальций белсенді металл болғандықтан көптеген реакцияларға түседі.
Жай заттармен- Са + Н2= СаН2кальций гидриді
- Са + Сl2= СаСl2кальций хлориді
- 2Са + О2= 2СаО кальций оксиді
- 6Са + 2N2СаN кальций нитриді
- Ca + 2С =СаС2кальций карбиді
- Ca + 2НОН = Са(ОН) 2+ Н2↑
- Ca + 2HCl=СаСl2+ Н2↑
Осы реакциялардың барлығында кальций - тотықсыздандырғыш.
Оттекпен оңай әрекеттесіп, қыздырғанда жанады. Металлоидтармен тікелей әрекеттеседі. Кальций металын өнеркәсіпте екі жолмен алады:
- электролиз әдісімен алу үшін балқыған Калций хлориді (CaCl2) арқылы тұрақты ток жіберіп, катодта таза Калций металын алады;
- екінші әдіс Al не Mg ұнтағының әктаспен аралас қоспасын вакумда 1100 1200°Ста қыздыру арқылы алады. Калций көмегімен уран, торий, ванадий, хром, цирконий, бериллий, тантал сияқты қиын балқитын, сирек те шашыранды, ілеспе металдарды тотықсыздандырып өндіреді.
Кальций қосылыстары
Кальций оксиді - ақ түсті қиын балқитын зат. Техникада оны "сөндірілмеген әк" деп атайды. Оны әктасты жоғары температурада (1000 C 0 шамасында) қыздырып, ыдырату арқылы алады:
СаС0 3 = t = СаО + СО 2 ↑- 180кДж
Кальций оксиді - нағыз негіздік оксид. Кальций сілтілікжер металл болғандықтан, оның оксиді сумен оңай әрекеттесіп кальций гидроксидін, яғни сілтісін түзеді:
СаО + Н
2
0 = Са(ОН)
2
+ 70 кДж
Бұл реакция өте қуатты жүреді, су бұрқылдап "қайнап" жатады, тіпті біразы буланады. Нөтижесінде, сөндірілген әк деп аталатын көпсіген кеуек ақ ұнтақ түзіледі. Кальций гидроксиді суда аз ериді. Оның қанық ерітіндісі лабораторияда әк суы деген атпен жиі колданылады. Кальций гидроксиді ерітіндіде иондарға толық диссоциацияланады:
Са(ОН) 2 = Са +2 + 2ОН
Сілті ерітіндісінің түзілгені фенолфталеиннің таңқурай түске боялуынан байқалады. Кальций гидроксиді қышқылдармен және қышқылдық оксидтермен әрекеттесіп бейтараптанады. Бұл реакцияны зертханада көмірқышқыл газын анықтау үшін қолданады. Әқ суына көмір қышқыл газын жібергенде, ол алдымен ерімейтін карбонат түзіп, лайлана бастайды:
Са(ОН) 2 + CO 2 = СаСО 3 ↓ + Н 2 О
Газды одан өрі жібере берсе, лай көрінбей кетеді, өйткені суда ерімейтін орта тұз ерімтал қышқыл тұзға айналады:
СаСО 3 + Н 2 О + СО 2 = Са(НСО 3 ) 2
Қатты күйдегі кальций гидроксидінің Са(ОН), судағы жүзгіні, түсі ақ болғандықтан, техникада әк суті деп аталады. Сөндірілген өк құрылыста кеңінен қолданылады. Әк сүтін құрылыста әктеу үшін пайдаланады, ал сөндірілген өктің күммен қоспасын кірпіш қалаганда және сылағанда байланыстырушы зат ретінде жүмсайды. Бүл коспа ауада біртіндеп "ұстасып" қатая бастайды, себебі көмірқышқыл газымен әрекеттесіп, қатты карбонат (бор) түзеді.
Кальций тұздарының құрылыста үлкен маңызы бар. Олардың сумен химиялық байланысып, кристалгидраттар түзетін қабілетін кеңінен пайдаланады. Мәселен, табиғи гипсті CaS0 4 • 2Н 2 0 өртегенде, өзінің кристалдық суының біразын жоғалтып, алебастрға айналады:
CaS0 4 • 2 О = CaS0 4 • 0, 5Н 2 0 + 1, 5Н 2 0
Алебастр ұнтағын сумен араластырғанда кері реакция жүріп, қайтадан гипс түзіп катаяды. Гипстің бұл қасиетін тек құрылыста қолданып коймайды, оны өшекейлік бедер, статуэткалар жасағанда және медицинада пайдаланады.
Көпшілікке белгілі цементтің күрамында кальцийдің силикаттары мен алюминаттары жүреді. Бұл тұздарды күммен қосып араластырғанда қатая бастайды, ейткені түзілетін кристалдар өзара ұстасып, берік материалға айналады.
Қолданылуы
Кальций инертті газды тазартып болат, никель, мыс, т. б. металдарды балқыту үшін қоспа ретінде пайдаланылады.
Залалсыздандырғыш, тотықтырғыш ретінде кальций гипохлориді -Са(Сı ) және аралас тұз хлорлы ізбес Са(СıО) Сı тұрмыста, медицинада қолданылады.
Натронды ізбес көмір қышқыл газын сіңіруде пайдаланылады.
Стронций және барий сілтілік жер металының өкілдері болып табылады. Радий-радиоактивті элемент.
C т р о н ц и й
Ашылуы
1790ж ағылшын минералогтары Кроуфрод және Крюикшенк стронцианит минералы құрамында жаңа зат бар екендігін тұжырымдаған. Бұлардан өзге ағылшын химигі Хоп стронцианит құрамында жаңа элемент-стронций бар екендігін мәлімдеді.
Ал, элемент күйінде стронцийді бөліп алған ғалым Х. Дэви болды.
Стронций-пышақпен оңай кесілетін, жұмсақ сілтілікжер металы. Үш түрлі аллотропиялық түр өзгерісі бар.
Табиғи изотроптары
0, 56%; 9, 96%, 7, 02%, 82, 56%
Табиғи қосылыстары
Табиғатта стронцийдің 12 түрлі минералының ішінен целестин және стронцианит жиі ұшырасады.
Целестин-SrS
Стронцианит- SrС
Жер бетінде биомасса құрамында 2 млрд. Тонна стронций, ал өсімдіктер дүниесінде 100 млн. тоннадай стронций бар.
Стронций мен барий табиғатта минералдар құра отырып, сульфаттар мен карбонаттар түрінде кездеседі. SrSC
целестин, стронциатит SrC
, барит BaS
және BaC
витерит. Жер қыртысында стронций мен барийдің мөлшері кальцийдің мөлшерінен айтарлықтай аз.
Металдық стронций және барийді кальций сияқты балқытылған хлоридті тұздардың электролизі арқылы алады. Бұл металлдар өте белсенді, ауада тез тотығады, сумен (әсіресе барий) өте белсенді өзара әрекеттеседі және тікелей көптеген элементтермен реакцияға түседі.
Стронций SrO және барий оксиді BaO әкке ұқсас. Екі металл да пероксидтерді құрайды. Барий пероксиді BaO2 ауада барий оксидін шамамен 500 ° C дейін қыздыру арқылы алынады. Жоғары температурада ол қайтадан оксид пен оттегіге ыдырайды. Барий пероксиді әртүрлі материалдарды ағартуға арналған натрий пероксиді сияқты қолданылады.
Стронций мен барий тұздары кальций тұздарына өте ұқсас. SrC , BaC , SrS және BaS -нің карбонаттары мен сульфаттары суда ерімейді, Sr және Ba иондары С және С иондарымен байланысқан болса тұнба түзеді.
Бұл үш металдың бір-бірінен ерекшеленетін айырмашылық олардың тұздары жанған кезде жалынының түсінің өзгеруі. Кальций тұздары қызғылт-қызыл түсті жалын, стронций тұздары кармин-қызыл түсті, ал барий тұздары сарғыш-жасыл түсті. Стронций және барий тұздары пиротехникада қызыл және жасыл бенгал жарықтарын дайындау үшін қолданылады.
Барий (Barium, гр. barys «ауыр» ) Ba химиялық элементтердің периодтық жүйесінің 6-шы периодының ІІ тобына жататын элемент, реттік нөмірі 56, атомдық массасы 137, 34. Жерсілтілі элементтерге жатады. Табиғатта барит (Ba 2 SO 4 ) және витерит (BaCO 3 ) деген минералдары кездеседі. Барийді 1774 жылы Карл Шееле ашқан.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz