Азот қышқылының физика-химиялық негіздері, азот оксидтерін жұту және өндірістік технологиялары


Жоспар
- Кіріспе3
- Негізгі бөлім2. 1 Азот қышқылының өндірісі; 42. 2 Азот қышқылының қолданылу 52. 3 Азот қышқылын өндірудің физикалық-химиялық негіздері; 72. 4 Азот оксидтерінің жұтылу жылдамдығы мен азот қышқылының түзілуі; 112. 5 Жоғары концентрлі азот қышқылын алу; 142. 6 Қоюландырылған азот қышқылын алу; 152. 7 Сұйытылған азот қышқылын алу өндірісі; 162. 8 Азот қышқылын өндірудің түйдектелген жолдары; 182. 9 Кюльман тәсілімен азот қышқылын алу; 202. 10 Азот қышқылын концентрлеудің өндіріс схемасы; 212. 11 Азот қышқылын концентрлеудің жаңа тәсілдері; 242. 12 Азот оксидтерінен концентрлі азот қышқылын алудың жалпы шарттары. 252. 13 Сұйық азот қышқылының жартылай булану кезіндегі колоннаның материалдық және жылулық балансын қарастыру. 27
- Қорытынды30
- Пайдаланылған әдебиеттер31
Кіріспе
Таза азот қышқылы тұрақсыз және кәдімгі температурада ыдырайды. HNO 3 кристалдану температурасы -41, 58 0 C тең. -30 дан +50 0 C аралығында азот қышқылының тығыздығын келесі теңдеумен анықтауға болады: d=1, 5492-0, 00183 *t. Азот оксиді мен азот қышқылы арасындағы тепе - теңдіктің орналасу жылдамдығы өте үлкен, қалыпты жағдайда концентрациясы төмен азот оксидінің қышқылымен әрекеттескендегі жылдамдық азот оксидінен тепе - теңдік концентрациясы болатын NO 2 түзілу жылдамдығынан әлде қайда жоғары. Кейбір мағлұматтар бойынша азот қос оксидімен қышқыл арасындағы тепе-теңдік 1, 2 сек орналасады. Ал басқа мағлұматтарға сүйенсек тепе-теңдіктің орналасуы 4 сағатқа дейін созылады. Бірақта азот қос оксидінің жұтылу дәрежесі екі жағдайда да бірдей болады. Концентрациясы 65-70% HNO 3 аммоний селитрасын, күрделі минералды тыңайтқыштар және нитроқосылыстар алу үшін пайдаланылады.
Жоғары концентрлі азот қышқылын алу үшін концентрлі нитроз газдарын қолданып азот оксидтерін абсорбциялануы жоғары қысымда, төменгі температурада жүргізу керек.
Тікелей азот оксидтерінен концентрлі азот кышқылын алудағы қиыншылықтарды жою үшін жоғары концентрлі сұйық азот төрт оксидін қолдану керек, азот оксидтері сумен әрекеттескенде жоғары қысымды пайдаланып процесті жоғары температурада жүргізу керек. т. с. с
Азот қышқылының өндірісі
Алдын ала қысымдалған және котализ алдындағы құбырдан тазалаудан өткен азотты-сутекті қоспаны циркуляциялық газбен конденсатор арасындағы құбырда араластырады. Бұл жаңа қоспаны CO 2 және CO іздерінен қосымша тазалауға мүмкіндік береді. Газдық қоспа синтез құбырының жоғарғы бөлігіне беріледі, содан соң корпусымен катализаторлық қораптың қабырғалары арасындағы сақиналық кеңістік арқылы құбырдың төменгі бөлігінде орналасқан, бірінші жылуалмастырғыштың түтікаралық кеңістігіне келіп түседі. Бұл жылуалмастырғышқа қоспа 300-350 0 C дейін қыздырылады, және екінші жылу алмастырғыштың жылу алмасу түтіктеріне келіп түседі. Екінші жылу алмасытғышта қоспаның температурасы 400-450 0 C - қа дейін көтеріледі, ал котализаторлық қорапта реакция жылуы әсерінен 500-550 0 C дейін жоғарылайды. Синтез құбырынан азотты сутекті қоспа сулық конденсаторға жіберіледі. Бұнда аммиак газдан конденсацияланады. Ол газды ажыратқышта жиналады және ары қарай дайын өнімдер қоймасына жіберіледі.
Үрдістің бірінші сатысы болып аммиактың ауадағы оттегімен тотығуы саналады. Аммиак котализатор қатысында азот түзе отырып, тотығады:
NH 4 +3O 2 =2N 2 +6H 2 O+Q
Платиналық котализаторлар бетінде негізінен басқа, қайтымсыз реакция жүреді:
NH 4 +5O 2 =4NO+6H 2 O+Q
Котализатор тор түрінде қолданылады. Оны, платинаның радий мен палладийдан балқымасынан дайындалған жұқа сымдарды өріп жасайды.
Үрдістің екінші сатысы - азот тотығының NO 2 -ге тотығуы және ары қарай N 2 O 4 -ке ішінара димерленуі. Қайтымды тотығу реакцияларындағы тепе теңдік жағдайы:
2NO+O 2 =2NO 2 +Q
температураға қатты тәуелді.
Үшінші соңғы болып N 2 O 4 және NO 2 тотықтарының сумен әрекеттесу үрдістері саналады:
2NO 2 +H 2 O=HNO 3 +Q
N 2 O 4 +H 2 O=HNO 3 +HNO 2 +Q
және ары қарай (азотты қышқылдың тұрақсыздығы салаларынан ) оның өзіндік тотығу-тотықсыздану реакциясы жүреді:
3HNO 2 =HNO 3 +NO 2 +H 2 O+Q
Азот тотықтарының сумен әрекеттесуінің қосындылық теңдеулері:
3NO 2 +H 2 O=2HNO 3 +NO+Q
3N 2 O 4 +2H 2 O=4HNO 3 +2NO+Q
Осы экзотермиялық реакцияларыны осы экзотермиялық реакцияларының жүруі кезінде газдар көлемі азаятындықтан Ле-Шателье принципіне сәйкес, қысым жоғарылаған сайын тепе-теңдік азот қышқылы түзілуі жағына қарай ығысады.
Егер, сұйық N 2 O 4 -тің сумен әрекеттесуінің таза оттегінің 5 10 6 Н/м 2 қысымында 60-80 0 C жүргізсе, сусыз концентрленген азот қышқылын алуға болады. Бұл кезде өзгеру дәрежесі 100% ға дейін жетеді. Оның себебі мыныларға байланысты:
а) төмендегі реакйияның
3N2O4+2H 2 O=2HNO 3 +2NO
Сұйық сұйық сұйық газ
Тепе теңдігі сұйық N 2 O 4 тотығын суға қатысты артық мөлшерде қолдануға байланысты, б) температураның жоғарылауы N 2 O 4 -тің сумен әрекеттесуін жеделдетеді. Бұл тотығудың бір сағатта аяқталуына мүмкіндік береді. Қысымның көтерілуі:
2 N 2 O 4 +2H 2 O+O 2 =4HNO 3 +Q
реакцияның толық жүруіне әсер етеді.
2NO 2 +H 2 O=HNO 3 +Q
N 2 O 4 +H 2 O=HNO 3 +HNO 2 +Q
Азот қышқылының қолданылуы
Бағдатта екі бірдей жарылыс болып, 8 бейбіт тұрғын көз жұмды. Тағы 23 кісі жарақат алды. Ал, бейсенбі күнгі 4 лаңкестік әрекеттен 18 адам мерт болып, 50 шақты адам зардап шеккен. Сонымен қатар Америка әскерилері Бағдаттың батысында үлкен көлемде азот қышқылы сақталған екі құпия қойма тапқан. Жергілікті ақпарат көздерінің хабарлауынша, барлығы қышқыл толтырылған 31 бөшке мен әрқайсысы 20 литрлік екі контейнер табылыпты. Сонымен қатар белгісіз ұнтақ саланған төрт қап, бірнеше зымырандық снаряд, цинк әктастары мен бензол құюға арналған бірнеше ыдыс табылыпты. АҚШ сарбаздарының айтуынша, азот қышқылы қолдан бомба жасау үшін қолданылады. Жарылғыш затқа қосылған қышқыл адамның тыныс алу және ас қорыту жүйесін зақымдап, денесін күйдіріп түсіреді екен. Арнайы қызмет өкілдерінің мәліметіне қарағанда, Бағдатта болған соңғы жарылыстарда жасақтар хлормен жасақталған бомбылар қолданған болатын.
Азот қышқылының физикалық қасиеттері
Таза азот қышқылы тұрақсыз және кәдімгі температурада ыдырайды. HNO 3 кристалдану температурасы -41, 58 0 C тең. -30 дан +50 0 C аралығында азот қышқылының тығыздығын келесі теңдеумен анықтауға болады:
d=1, 5492-0, 00183 *t
Мұндағы t- температура, 0 C 230-300 0 C аралығында HNO 3 буының мольдік жылу сыйымдылығын келесі теңдеумен анықтайды [ккал\(моль град) ] :
Cp бу = 25б64+1, 427*10 -2 T-4, 09*10 -5 T 2
Ал сұйық HNO 3 жылу сыйымдылығы:
Cp сұйық =2, 88+4, 047*10 -2 T-2, 407*10 -5 T 2
HNO 3 -H 2 O системасының кристалдану диаграммасы (1 суретте) келтірілген.
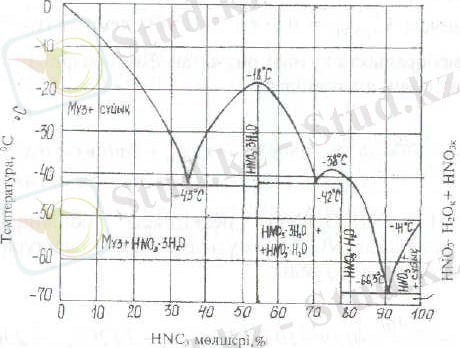
1 сурет. HNO 3 -H 2 O кристалдану диаграммасы
Мұнда кристалдану температурасы -18 0 C HNO 3 *3H 2 O (53, 8% HNO 3 ) және -38 0 C HNO 3 *H 2 O (77, 8% HNO 3 ) қосылыстарының бары байқалады.
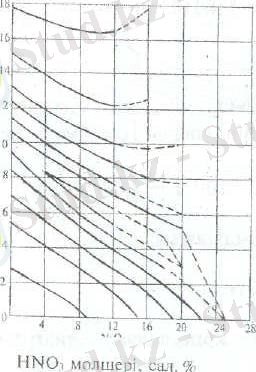
HNO 3 -H 2 O-N 2 O 4 cистемасындағы қату сызықтары (2 суретте), ал азот қышқылының қайнау температурасы (3 суретте ) көрсетілген. Құрамында 68, 4% HNO 3 бар қоспа азеотроптық қоспа.
2 сурет. HNO 3 -N 2 O системасының қату сызықтары
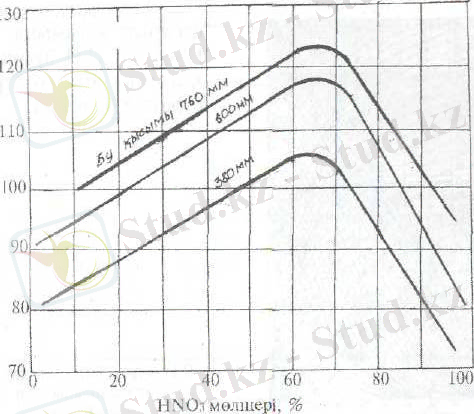 3 сурет. Азот қышқылының сулы ерітінділердің қайну температурасы.
3 сурет. Азот қышқылының сулы ерітінділердің қайну температурасы.
HNO 3 ерітіндісі бетіндегі су мен азот қышқыл буының қысымы қышқылдың концентрациясы жоғарлаған сайын төмендейді. (4 сурет)
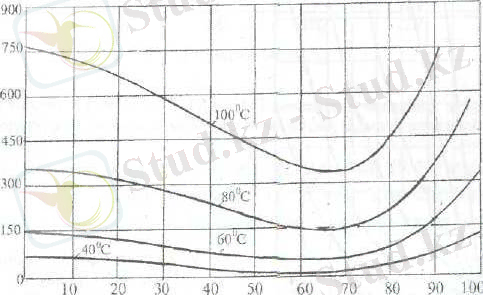
4 сурет. Азот қышқылының сулы ерітінділерінің бетіндегі будың жалпы қысымы.
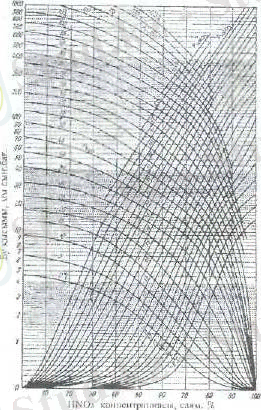
5. сурет. Әртүрлі температурадағы азот қышқылы мен су буының парциалдық қысымы
Температура мен сұйық фазаның құрамына байланысты HNO 3 -пен H 2 O буының парциал қысымының өзгеруі (5) суретте берілген.
HNO 3 - N 2 O 4 системасының ерітінді бетіндегі азот қос оксиді буының жалпы қысымы (6 суретте) келтірілген.
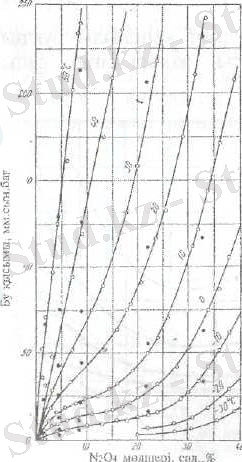
6. сурет. Әртүрлі температурадағы HNO 3 - N 2 O 4 система ерітіндісі бетіндегі NO 2 мен
N 2 O 4 буының жалпы қысымы
Азот қышқылы ыдырағанда су, азот оксиді және оттегі бөлінеді:
2 HNO 3 = 2 NO 2 + H 2 O+0, 5O 2
Қыздырылған таза азот қышқылы келесі реакция бойынша ыдырайды:
2 HNO 3 = N 2 O 3 +O 2 +H 2 O
Температураны дейін көтерсе азот қышқылы толығымен ыдырайды (7 сурет) . Концентрациясы 99, 55% жоғары азот қышқылын тікелей дистерлеу жолымен 160 0 C алуға болады, себебі құрамында аз мөлшері су оның ұстамдылығы артады.
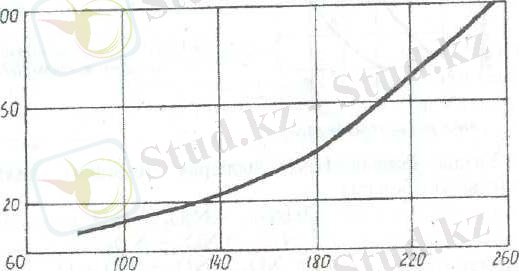
7. сурет. 2 HNO 3 = N 2 O 3 +H 2 O реакциясы бойынша әртүрлі температурада азот қышқылының тепе теңдік ыдырау дәрежесі
Азот қышқылының ыдырау жылдамдығын (суреттен) байқауға болады. Температура мен HNO 3 концентрациясы жоғарылаған сайын азот қышқылының ыдырау жылдамдығы тез өседі.
Газды фазада HNO 3 ыдырау механизмі келесі түрде ойластыруға болады:
2 HNO 3 =N 2 O 5 +H 2 O
N 2 O 5 = NO 3 + NO 2
NO 3 + NO 2 = NO 2 +NO+O 2
NO 3 +NO=2 NO 2
NO 3 +NO 3 =2NO 2 +O 2
99, 67%-99, 79% таза азот қышқылын, күкірт қышқыл нитраттар концентрлі азот қышқылымен айдап және бөліп кристалдау арқылы алады.
Азот оксидтерінің жұтылу жылдамдығы мен азот қышқылының түзілуі
Азот оксиді мен азот қышқылы арасындағы тепе - теңдіктің орналасу жылдамдығы өте үлкен, қалыпты жағдайда концентрациясы төмен азот оксидінің қышқылымен әрекеттескендегі жылдамдық азот оксидінен тепе - теңдік концентрациясы болатын NO 2 түзілу жылдамдығынан әлде қайда жоғары. Кейбір мағлұматтар бойынша азот қос оксидімен қышқыл арасындағы тепе-теңдік 1, 2 сек орналасады. Ал басқа мағлұматтарға сүйенсек тепе-теңдіктің орналасуы 4 сағатқа дейін созылады. Бірақта азот қос оксидінің жұтылу дәрежесі екі жағдайда да бірдей болады.
Азот оксидтерінің азот қышқылымен жұтылу процесін реттейтін фактор болып азот қос оксидінің сұйық және фаза шекарасында пайда болатын қышқыл тұман қабыршығы арқылы өту жылдамдығы саналады. Азот қышқылы ерітіндісімен сіңірілген азот қос оксидінің мөлшері келесі теңдеумен анықталады: [моль\(см 2 * сек) ]
Q NO2 = P (2D N2O4 *p N2O4 +D N2O4 p NO2 )
RTp b x
Мұнда:
Р, Р N2O4 , Р NO2 , p b - газдың жалпы қысымы,
N 2 O 4, , NO 2 - инертті газдардың парциал қысымы, атм.
R- универсал газ тұрақтысы,
T-температура, K
x- қабыршықтың тиімді қалыңдығы, см
D N2O4 , D N2O4 - диффузия коэффициенті, см 2 * сек
Жұтылған NO 2 мөлшерін келесі теңдеуден де анықтауға болады:
Q NO 2 =вC N2O4 = вKC 2 NO 2
Мұндағы:
К - тепе теңдік тұрақтысы, C N2O4 :C 2 NO 2 қатынасына тең
в - газдар үшін және сұйық үшін Рейнольдс саны 1200-3000; 100-600 аралығында, 45 0 С-де 10-15 см\сек және 25 0 С-де 2-8 см\сек болатын коэффициент.
Азот оксидтерін сумен жұтуды химиялық процесс деп қарастырсақ, онда оның жылдадығы келесі теңдеумен анықталады:
- dC N2O4 /dτ = k 1 C N2O4 *C H2O - k 2 C HNO 2 *C NO 3
Мұндағы:
k 1 , k 2 - тура және кері рекцияның жылдамдық тұрақтысы;
Азот қышқылдың ыдырау реакциясының жүретінін және NO 2 мен N 2 O 4 арасындағы тепе-теңдіктің болатындығын есепке алатын интеграл түрдегі теңдеу:
1/√p 1 = {1/√p 0 -2√Kpln p 0 /p 1 }+ ß τ
Мұндағы:
p 0 , p 1 - бастапқы және соңғы газдағы N 2 O 4 парциал қысымы, атм
K p - тепе -теңдік тұрақтысы, атм
ß - температураға тәуелді коэффициент
τ - абсорбциялау уақыты, сек
Абсорбция процесінде екі ауыспалы ауданның болатындығы анықталған. Біріншіде газ құрамында NO 2 мөлшері аз болғанда (0, 3 % дейін ) абсорбция жылдамдығы NO 2 концентрациясына пропорционал және газдың сызықтық жылдамдығына тәуелсіз болады. Екіншіде газдағы NO 2 концентрациясы молдау болса, онда абсорбция жылдамдығы газдың сызықтық жылдамдығына тәуелді болады. Бірінші ауданнан екіншіге NO 2 динамикалық тепе - теңдік концентрациясы болғанда өтеді.
Азот қос оксидін абсорбциялау жылдамдығы келесі теңдеумен анықталады:
G=K 1 * C op (бірінші ауданда)
G=K 2 (C op -C) (екінші ауданда)
Мұндағы :
G - NO 2 жұту жылдамдығы, кмоль\(м 2 *сек)
K 1 , K 2 - NO 2 жұту коэффициенттері, кмоль\(м 2 *сек)
C op - газ фазадағы NO 2 орташа концентрациясы, %
C- NO 2 динамикалық тепе -теңдік концентрациясы, %
Динамикалық тепе -теңдік концентрациясының азот қышқылы концентрациясына тәуелділігі келесі теңдеумен көрсетіледі:
C= 25*10 -3 C HNO3 - 0, 8
Мұндағы:
C HNO3 - HNO 3 концентрациясы, сал. %
Абсорбция коэффициентінің азот қышқылы концентрациясына (20-60%) тәуелділігі келесі теідеумен анықталады:
K 2 *10 7 = 0, 295 (C ‘ HNO3 - C HNO3 )
Мұндағы:
C ‘ HNO3 - азот қышқылы мен судың азеотроптық қоспасының концентрациясы, (68, 4 % HNO 3 сал. %)
Азот қышқылының сұйық ерітіндісінде азот қос оксидінің еру жылдамдығы, келесі теңдеу арқылы анықталады:
-dp NO 2 / dτ =kp NO 2
0, 2 және 0, 4 м\сек газдың жылдамдығында әртүрлі концентрациясы болатын, сұйық азот қышқылы ерітіндісіне NO 2 еру жылдамдығының тұрақтысы (9 суретте ) келтірілген.
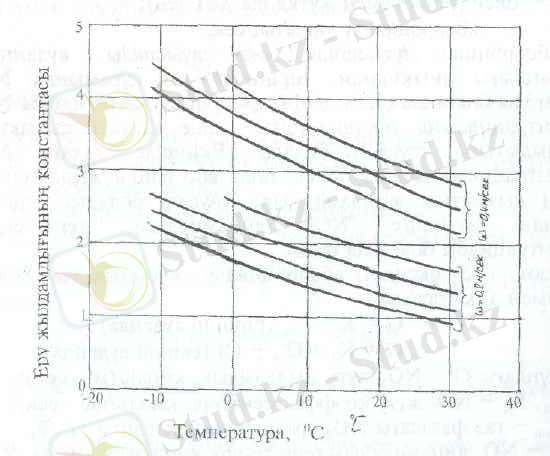
9. сурет. 0, 2 және 0, 4 м\сек газдың жылдамдығында сұйық азот қышқылы ерітіндісінде NO 2 еру жылдамдығының тұрақтысы (константасы)
Газдың сызықтық жылдамдығы W=0, 2-0, 4 м\сек, қышқыл концентрациясы C HNO3 =0-60% HNO 3 , температура -10-нан +40 0 C дейінгі аралықта k p -ның айтылған факторларға тәуелділігін келесі формуламен анықтайды:
k p = 5, 2ω/ 0, 84 + ω │0, 253- (80C HNO3 +C 2 HNO3 +280t+t 2 ) *0, 875*10 -5
3NO 2 +H 2 O=2HNO 3 +NO реакциясы бойынша азот қышқылы түзілуінде NO 2 жұтылу жылдамдылық тұрақтысын келесі теңдеумен анықтайды:
K n = 2, 14ω/0, 289 +ω │0, 19-10 -5 (52, 5C HNO3 +2, 12 C 2 HNO3 +230t+t 2 )
Жоғары концентрлі азот қышқылын алу.
Концентрациясы 65-70% HNO 3 аммоний селитрасын, күрделі минералды тыңайтқыштар және нитроқосылыстар алу үшін пайдаланылады.
Жоғары концентрлі азот қышқылын алу үшін концентрлі нитроз газдарын қолданып азот оксидтерін абсорбциялануы жоғары қысымда, төменгі температурада жүргізу керек.
6, 5 қысымда 50-65% HNO 3 өнім қышқылының абсорбциялық мұнараға келетін нитроз газдарының концентрациясына тәуелділікті келесі теңдеумен табуға болады:
C 2 HNO3 =6120- 19900/ C NO2
Мұндағы:
C 2 HNO3 - өнім қышқылының концентрациясы, сал. %
C NO2 - абсорбциялық мұнараға баратын азот оксидтерінің концентрациясы көлем, %
Жоғары концентрлі азот қышқылын алу системасының абсорбциялық узелінің схемасы 10. суретте келтірілген.
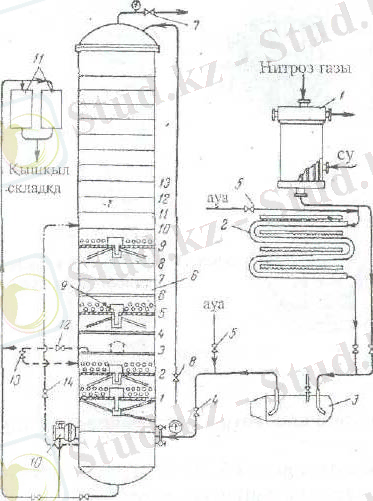
10. сурет. Жоғарғы концентрлі азот қышқылын алу схемасының абсорбциялық узелінің схемасы.
1- жылдам тоңазытқыш, 2- тоңазытқыш компенсатор,
3- сепаратор, 4- нитроздық газдар жолындағы реттеу тетігі (вентиль),
5- қосымша ауа тетік, 6- абсорбциялық колонна,
7- шығатын газды реттейтін тетік, 8- колоннаға берілетін суды реттегіш тетік,
9- құйғыш қондырғы, 10- қышқыл деңгеін реттегіш,
11- өнім қышқылын өлшеуіштер, 12- қышқыл шығаратын тетік,
13- қышқыл ағатын тетік, 14- айналмалы қышқыл беретін тетік.
Азот қышқылын алуға қолданылатын нитроз газ жақсы тотыққан болса, онда өнім қышқылын абсобциялық нашар тотыұұан болса, онда колоннаның төменгі жағында азот оксиді оттегімен және азот қышқылымен тотығады:
2 NO+O 2 =2NO 2
NO+ 2 HNO 3 =3NO 2 +H 2 O
NO-ның тотығуына HNO 3 жұмсалғандықтан және нитроз газдарымен келетін су буының конденсациялануы нитижесінде колоннаның бірінші табақшаларының астындағы HNO 3 жоғары табақшаларға қарағанда концентрациясы төмен болды. Жоғары табақшаларда HNO 3 концентрациясы жоғарлайды да, онда еріген азот оксидтерімен қышқыл байиды. табақшаларда қышқылдың концентрациясы өте жоғары болады, әрі қарай төмендейді. Сондықтан, бастапқы газ жақсы тотыққан болса, онда өнім қышқылын абсобциялық колоннаның төменгі жағынан шығарады, ал нитроз газы әлсіз тотыққан болса, онда артық азот қышқылын колоннаның төменгі жағынан табақшаларға береді, өнім қышқылын табақшалардан шығарады. Абсорбциялық колоннаның орта бөлігі салқын тұздықпен салқындатылады.
Шығын газдардың құрамында азот оксидтерінің мөлшері 0, 05% аспау үшін (азот оксидтерін жұту дәрежесі 99, 5 %) табақша қажет етіледі.
Cұйытылған азот қышқылын алу өндірісі
Концентрациясы 45-72% дейін азот қышқылы өндірісінің қазіргі тәсілдері негізінен үш топқа бөлінеді:
- Атмосфералық қысымда алу
- Жоғары қысымда алу
- Аралас тәсілмен ( қысым абсорбциялық системадағы қысымнан тқмен) алу.
Атмосфералық қысымда істейтін системалар
Атмосфералық қысымда істейтін сұйытылған азот қышқылы өндірісінің технологиялық схемасы 11-суретте көрсетілген
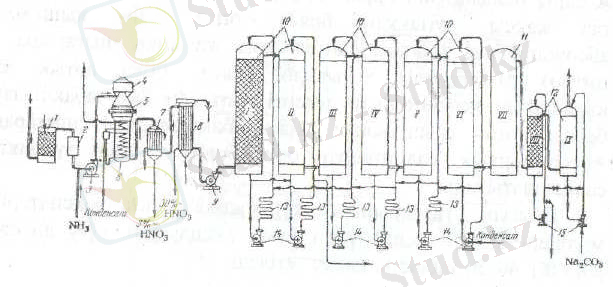
11 сурет. Атмосфералық қысымда істейтін сұйытылған азот қышқылы өндірісінің технологиялық схемасы
1- су скруббері, 2-сүзгіш,
3- аммиак ауа вентеляторы, 4- сүзгі,
5- беттеу аппараты, 6- бу котел утилизаторы,
7-жылдам салқындатқыш, 8- салқындатқыш клнденсатор,
9- нитроз газдарының вентиляторы, 10- абсорбциялық мұнара,
11- тотықтырғыш мұнара, 12- сілтілермен азот оксидтерін жұту мұнарасы,
13- қышқыл салқындатқышы, 14, 15- насос.
Процестің брінші сатысында аммиак ауа қоспасын дайындайды. Егер қоймадан сұйық аммиак алынса, оны алдымен буландырады. Түзілген газ күйіндегі аммиакты газглбдерге жинайды. Қолданар алдында газды сүзгіден немесе сұйық аммиактан өткізеді (май булары мен механикалық қоспалардан тазарту ) .
Өндіріске қолданылатын ауаны басқа газдармен ластанбаған таза жерден алған жөн. Ауаны қышқыл газдардан тазарту үшін оны әдетте сілті ерітіндісімен немесе сумен арнайы қондырғыда жуады. Механикалық қосындыдан айыру үшін ауаны материалдан жасалған сүзгілерден өткізеді.
Тазартылған аммиак пен ауа системаға сорғыш арқылы беріледі. Сорғышта газдар жақсы араласады.
Егер системаға жылы ауа қажет етілсе, онда соңғы нитроз газдармен қыздырылады. Олай болған жағдайда ауада аммиакпен араластыру жеке қондырғыда іске асырылады да, системаға олар жеке жеке беріледі.
Катализаторға барар алдында газ қоспасы таға бір рет мата тәріздес немесе картоп сүзгісінен өткізіледі. Ол беттесу аппаратының жоғарғы жағында орналасқан.
Конвертор тікелей котел утилизаторға бекітілген, сондықтан жылудың қоршаған ортаға шығымы көп азаяды.
Тіке бағытта жұмыс істейтін котел утилизатор жылан түтік тәріздес. Мұнда су қыздырылып бу су қоспасына айналдырылып, одан кейін сепараторда бөлінеді. Конденсаттың біраз бөлігі қазанға қайтарылады, ал қалған бөлігі қазанда бөлініп тазартқанда ұшады. Сепаратордан шыққан бұл қазанның төбе жағында орналасқан ирек түтік қыздырғышқа келіп, одан кейін жалпы завод жүйесіне жіберіледі. (будың температурасы 450 0 C, қысымы 40 атм дейін) . Шығын нитроз газдардың жылуын толық пайдалану үшін қазанға бір немесе екі бір ізбен қосылу экономайзер орналасқан. Бұл схемада нитроз газдардың температурасы 800-160 0 C дейін төмендейді. Газды одан әрі қарай салқындату бір ізбен қосылған су салқындатқыштарында іске асады. Жылдам салқындатқышта 40 0 C -де шыққан нитроз газдар құрамында 2-3% HNO 3 бар конденсат бөлінеді. Салқындатқыштан (7) шығарда нитроз газдардың құрамындағы азот оксиді тез тотығады да газдардың температурасы қайтадан жоғарылайды. Газды салқындату үшін оны екінші салқындатқыш (8) арқылы өткізіледі. Мұнда құрамында 25-30% HNO 3 бар кондаенсат бөлініп алынады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz