Бензоидты емес ароматты жүйелер: құрылымы, кванттық-механикалық негіздері және химиялық қасиеттері


Жоспар
- Кіріспе
- Негізгі бөлімБензоидты емес ароматты жүйелер . . . 4Ароматты жүйелердің диамагнитті қасиеттері . . . 5Екі π-электроны бар ароматты жүйелер . . . 8Төрт π-электроны бар ароматты жүйелер . . . 9Алты π-электроны бар ароматты жүйелер . . . 10Бір гетероатомы бар алты мүшелі гетероциклдер . . . 10Екі гетероатомы бар алты мүшелі гетероциклдер . . . 14Циклопентадиенил-анион . . . 16Тропилий-катион . . . 23Алтыдан көп π-электроны бар ароматты жүйелер . . . 26Азулен . . . 26Аннулендер . . . 28Порфириндер . . . 29
- Эксперименттік бөлім
- Қорытынды
- Қолданылған әдебиеттер
Кіріспе
XIX ғасырдың ортасына дейін органикалық химияны өсімдіктер мен жануарлар организмінде түзілетін заттарды зерттейтін ғылым деп келеді. «Организм» деген сөзге сәйкес органикалық химия деген атау пайда болды. Ғылымның дамуына сәйкес, бұл атаудың мағынасы түбірлі өзгеріске ұшырады, солай бола тұрса да, осы тарихи атау сақталып, бүгінге дейін жетіп отыр.
Қазіргі кезде органикалық химия деп, көміртек қосылыстарын және олардың туындыларын зерттейтін ғылымды, ал органикалық заттар деп, құрамында көміртек элементі бар заттарды айтады. Өте ерте кезден бастап адам баласы кейбір органикалық заттарды ала білген және оларды өздерінің тұрмыстық қажетіне пайдаланған.
XIX ғасырдың бірінші жартысында органикалық заттарды синтездеумен қатар органикалық қосылыстарды анализдеу техникасы да едәуір жетілдірілді. Бұл көптеген органикалық қосылыстарды анализдеу мүмкіндік берді. Анализдеу барысында барлық органикалық қосылыстардың құрамынан қөміртек элементті табылды.
Организмнің қатысуынсыз органикалық заттарды алу мүмкіндігі және барлық органикалық қосылыстардың құрамынан көміртек элементінің табылуы органикалық химияға жаңа анықтама беруге негіз болды. Сөйтіп, 1848 жылы Гмелин: « Органикалық химия көміртек қосылыстарының химиясы» деген жаңа анықтама берді.
Ароматты қосылыстар - молекулаларында алты көміртек атомдарынан тұратын бір немесе бірнеше тұйық тізбегі (циклі) бар органикалық қосылыстар. Алғашқы ашылған ароматты қосылыстардың жұпар иісті болуына байланысты осылай аталған. Олардың құрамындағы циклдар бір-бірімен жапсарласа байланысып, біртұтас жүйе құрайды.
Ароматты жүйелер бензоидты (арендер және арендердің туындылары, бензол ядросын құрайды) және бензоидты емес (қалғандары) болып екіге бөлінеді. Сонын ішінен бензоидты емес ароматты жүйелерге тоқталып кетеміз.
Жарты ғасыр бұрын Э. Хюккел мынадай ұсыныс айтты: ароматтылық қасиетпен бензол қатарындағы қосылыстар ғана емес, сонымен қатар бензоидты емес қосылыстарда иелене алады.
Негізгі бөлім
2. 1 Бензоидты емес ароматты жүйелер
Әлі күнге дейін қарастырылып отырған изоциклдік ароматты жүйелер, сонымен бірге кондинсерленген ароматты жүйелердің пішіндері бензол ядросына негізделген.
Бензол алты π-электронынан тұрады. Ол альтернантты ароматты жүйелерге жатады. Ойша қортқанда π-байланысқан электрондары бір-бірлеп әр көміртек атомымен байланысқан. Олардың спиндері кезектесіп отырады. Альтернантты жүйелер басқалардан айырмашылығы, ароматты жүйені құрайтын көміртегі атомдарын «бірінші, екінші» деп санауға болады.
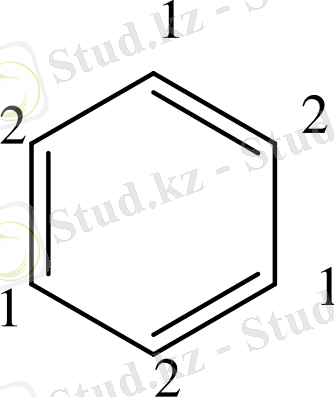
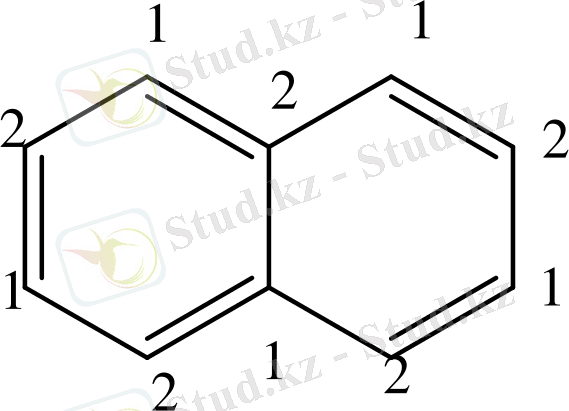
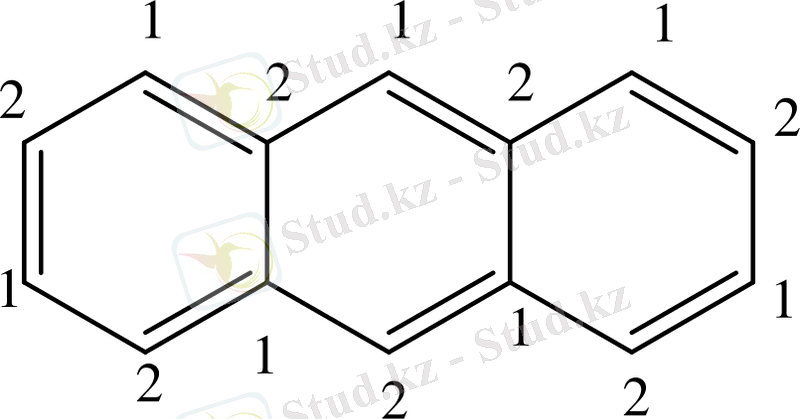
«Бірінші» және «екінші» атомдар дұрыс кезектеседі. Альтернантты емес ароматтық жүйелерде нафтолин изомері - азулен туралы айтылады.
Бензол молекуласында болатын альтернантты электрофильді және нуклеофильді көміртегі атомдары альтернантты ароматты жүйелерге тән емес.
Квантты-механикалық есеп молекулярлы орбиталь әдісі бойынша мынадай қорытындыға әкеледі: энергияның күрт төмендеуі барлық қанықпаған циклдік қосылыстардың π-байланыстармен қаптастасуы, π-электрондарының саны 4n+2 тең болса, n кез-келген сан болады (бұл қорытынды тек қана моноциклдік жүйелерге қатысты) . Сонымен, «ароматты алтылық» бензол электрондары (4×1+2=6) жеке болғанымен маңызды болып келеді.
Барлық ароматты жүйелерде тұйықталған циклді құрайды және олар ашақ полиметинді жұйесінің қатысуымен ерекшелінеді:
X - CH = CH - CH = CH - … X
Изоциклді ароматты жүйелерде альтернантты және альтернантты емес, барлық ароматты циклдер sp-гибридтену күйінде болады. Электрондардың мұндай әрекетті ароматты жүйелерді ерекше оптикалық және димагниттік қасиеттерін көрсетеді.
2. 1 Ароматты жүйелердің диамагнитті қасиеттері
Магниттік жолға атом жүйесін жібергенде әрбір электрон кішкене қосымша қозғалысқа ие болады және қосымша индуцирленген магниттік жағдай қарама-қарсы жаққа индуцирленген жолға бағытталып босатады. Мұның бәрі магниттік жолда соленоидтың ағымдағы тоқпен орналасуы. Сонымен қатар, соленоид жолына перпендикуляр бағытталып қалпына келеді және жолға қарама-қарсы бағыт құрайды. Бірақ та атомдар молекулаға бекітілген. Сондықтан осындай диамагниттік жүйе пайда болады. π- байланысы жоғартылған магниттік жүйеге ие болады. Өйткені π-байланыс қосымша инкрементті енгізеді.
Атомдардың диамагниттік қосындылары (Паскаль бойынша) χ А ·10 6 :
H . . . -2. 9 F . . . -6. 3
C . . . -6. 0 Cl . . . -20. 1
N . . . -5. 55 Br . . . -30. 6
O . . . -4. 6 I . . . -44. 6
Байланыс инкременттері χ·10 6
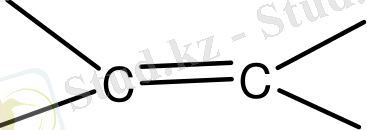 . . . +5. 5
. . . +5. 5
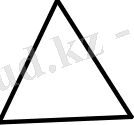 . . . +4. 1
. . . +4. 1
 . . . +0. 8
. . . +0. 8
 . . . +3. 05
. . . +3. 05
 . . . +1. 85
. . . +1. 85
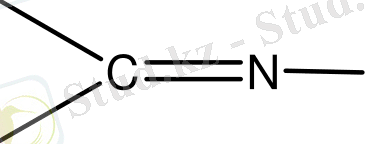 . . . +1. 6
. . . +1. 6
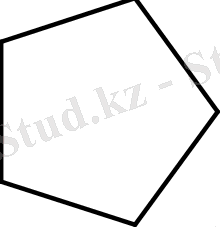 . . . -0. 98
. . . -0. 98
 . . . +0. 8
. . . +0. 8
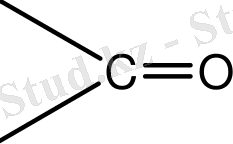 . . . +6. 32
. . . +6. 32
 . . . +0. 86
. . . +0. 86
Осы ауқымды формулалар органикалық байланыстарға бекітіліп, диамагниттік молекулалық қосындыларын аддитивті ауқымның негізінде, санап шығады. Эксперименттік көлемді магниттік жолдың әлсіреуін өлшеу арқылы табады. Практика жүзінде магниттік жолдың ең жоғарғы қауырттылығынан шыққан заттың күшін өлшеу үшін, ең бірінші көлемнің қабілетін К мен молекулалар қабілетінің ядросының χ М теңдігімен шығады:
Мұнда М - молекулалық салмақ, d - тығыздық.
Ароматтық жүйелер басқаша айтқанда жазық циклдік жүйелер үшін, осы әдіс арқылы көп мөлшерде инкрименттер ( экзальтациялар) табылды.
Осылай диамагнитті экзальтация қабілеттілігі ароматтылықтың нақты белгісі болып табылады. (кесте №1) .
№1 кесте. Диамагнитті экзальтация қабілеттіліктің ароматтылық сипаттамасы
Айырмашылық
∆
Айырмашылық ∆
Бензол циклдер саны
Бензол
Нафталин
Антрацен
Фенантрен
Дифенил
Азулен
Трополон
Тропон
Циклооктатетраен
-55, 6
-91, 9
-129, 4
-127, 9
-102, 9
-91
-61
-54
-105, 1
-36, 9
-55, 7
-74, 5
-74, 5
-68, 0
-55, 7
-45, 8
-41, 2
-79, 3
18, 7
36, 2
54, 9
53, 4
34, 9
35, 3
15, 2
12, 8
25, 8
18, 7
18, 1
18, 3
17, 8
17, 5
-
-
-
-
Хейльброннерге сүйене отырсақ, оны ең оңай тәсілмен істеуге болады. Ол үшін бәріне белгілі Де-Бройля байланысын электрон қозғалысына потенциалдық орға бір мөлшерде үздіксіз потенциал мен тұрақты қабырға бейнесіне қолдану арқылы жасау керек. Сонда
мұнда һ - Планк тұрақтысы, m e және ν - электрон массасы мен жылдамдығы.
Кванттық энергияның жағдайы сызықтық потенциалдық жәшіктегі және сақинадағы электрондар әр түрлі. Бұл түсінікті, өйткені әр берілген энергия сызықтық потенциалдық жәшікте бір ғана қозғалыс бола адады(«артқа - алға» жәшік бойы), ал сақинада бір немесе бірнешеу болуы мүмкін. Олар сағат тілімен және сағат тіліне қарсы бағытта қозғала алады. Кванттықтың шарты бойынша, сызықтық жәшікте L ұзындығы жарты толқын ұзындығынан λ/2 қысқарау болуы керек, ал сақинада - L периметрі бүкіл толқын ұзындығынан қысқарау болуы тиіс.
Бұл шарттардың мынадай түрлері бар.
Сызықты потенциалды жәшік сақина*
(λ/2) n´=L (n´=1, 2, … ) λn´´=L (n´´= 0, 1, 2, …)
Енді кенетикалық энергия үшін**
Толқын ұзындығына мән бере отырып, кванттық шарттарына қойып шығарамыз:
Сызықтық потенциалдық жәшік сақина
(n´= 1, 2, … ) (n´´=0, 1, 2, …)
Сыртқы жәшік пен сақинаның электрондармен толтырылуы алдынғы суретте көрсетілген. Соңғы үш қатарда үш қос π-электрондары қарама-қарсы орналасқан. Жоғары орналасқан қатарлар-молекулалардың қозған қатарлары. Егер гексантиенді циклогексантиенге айналдырғанда жаңа кванттық қатар пайда болады. L периметрі жарты толқын емес, толық толқын ұзындығына тең болу керек, яғни λm = L (m= 0, 1, 2, …) .
Жоғарыда көрсетілгендей кинетикалық энергияның мәні бүтін сандар үшін алынады (кванттық мағына) .
E m әр мағынасы үшін сызықтық жүйеде электронның қозғалысына жалғыз түр сәйкес келеді. Сақинада E m мәні электрон қозғалысы сағат тілі бойымен және сағат тіліне қарсы бағытта сәйкес келеді. Осыдан Хюккельдің ароматтық ережесі шығады. Осылайша барлық ароматты жүйелерді «ароматты» электрондар саны бойынша классификациялауға болады.
2. 3 Екі π-электроны бар ароматтық жүйелер
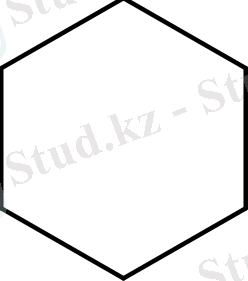
Осы қатардың жалғыз изоциклдық ароматтық жүйенің гипотеттік циклопропенил- катионы болуы тиіс:
Циклопропенил-катионының қатары белгілі. Алғаш рет 1961 жылы Бреслоу трифенилциклопропенил-катионын алды. Бұл қосылыс күшті тұрақтылығымен көзге түседі. Бромның және сутегі катализаторының қатысынсыз қарапайым үш мүшелі циклдің үзілуі және қос байланыстың қосылуы байқалмайды.
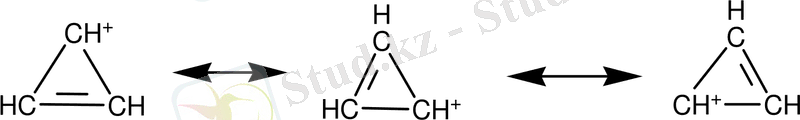
2. 4 Төрт π-электроны бар ароматты жұйелер
Хюккель бойынша циклобутадиен екі π-байланысы және төрт π-электроны бар ароматты болуы тиіс емес. Циклобутадиеннің реакциядан бөлінуі диендердікіндей қасиет көрсетеді( Петтит, 1966ж)
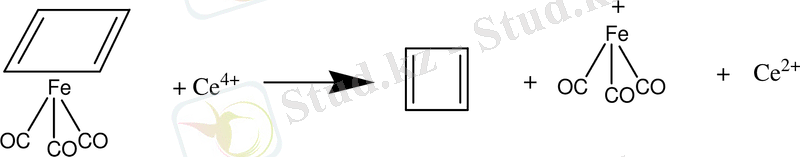
Бөлінген кезден-ақ қосылады:
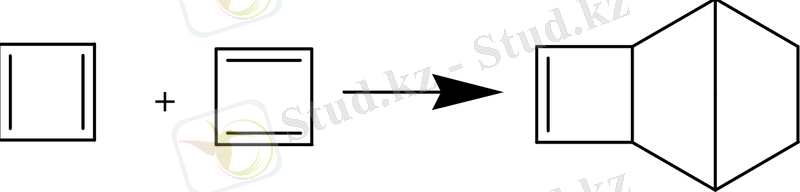
2. 5 Алты π-электроны бар ароматты жүйелер
Бензол және бензоидты жүйелерден басқа, алты π-электрондары бар жүйелер ароматты гетероциклдерді құрайды. Оларға мыналарды жатқызуға болады:
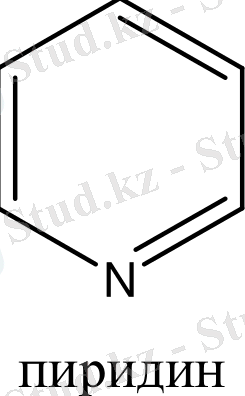
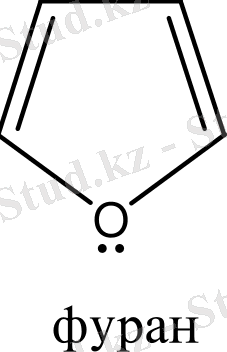
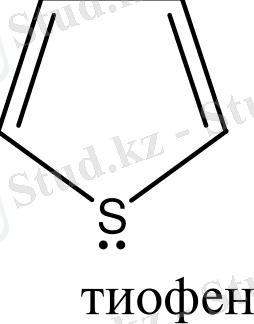
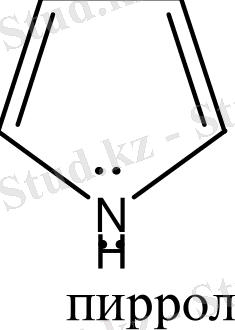
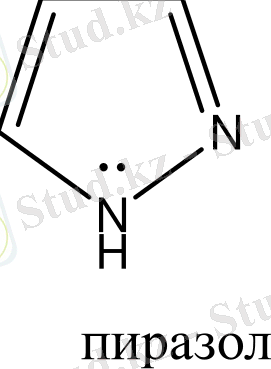
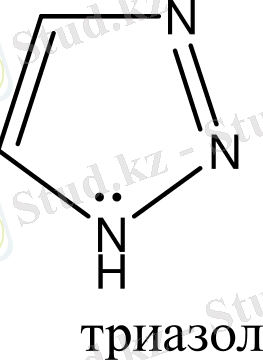
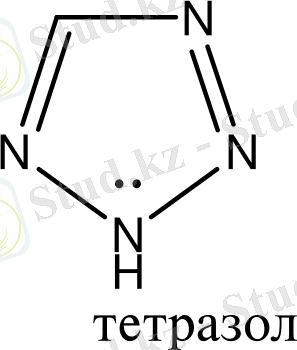
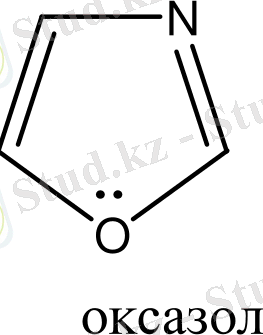
Гетероциклдерге тоқталып кетсек. Циклдің құрамында кіретін атомдардың жалпы санына қарай гетероциклді қосылыстарды: үш, төрт, бес, алты және көп мүшелі гетероциклдер деп бөледі. Бұлардың ішінде алты мүшелі гетероциклді қосылыстардың маңызы үлкен. Алты мүшелі гетероциклдер құрамындағы гетероатомдардың санына қарай бөлінеді. Сонымен бірге бұл қосылыстардың ішінде бензол сақинасымен гетероциклдің және екі немесе бірнеше гетероциклдердің конденсациялануынана түзілген күрделі жүйелер де кездеседі. Сондықтан бұларды белгілі бір жүйеге келтіру үшін, мына төмендегідей классификациялайды.
- Бір гетероатомы бар алты мүшелі гетероциклдер
- Екі гетероатомы бар алты мүшелі гетероциклдер
2. 5. 1 Бір гетероатомы бар алты мүшелі гетероциклдер.
Мұндай гетероциклдердің маңызды өкілі - пиридин. Пиридинді бір СН топшасын азот атомымен алмастырған бензол деп қарауға болады.
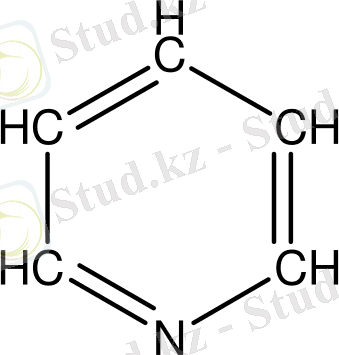
Алыну жолдары. Пиридинді ең алғаш 1851 жылы сұйық майынан алған. Пиридин және оның гомологтарын өнеркәсіпте тас көмір смоласынан алады. Бірақ онда олардың мөлшері өте аз (0, 1% -дай) . Сондықтан қазіргі кезде пиридин және оның гомологтерін синтездеудің бірқатар жолдары бар.
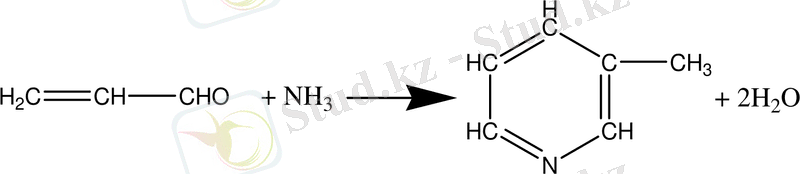
- Акролеиннің аммиакпен конденсациялауынан β-метилпиридин (β-пиколин) алынады:
- Пиридин негіздерін қаныққан альдегидтердің де алуға болады (А. Е. Чичибабин, 1937ж. ) . мысалы, сірке альдегиді аммоний ацетатының қатысуында аммиакпен әрекеттесіп, 2-метил-5-этилпиридин түзеді:
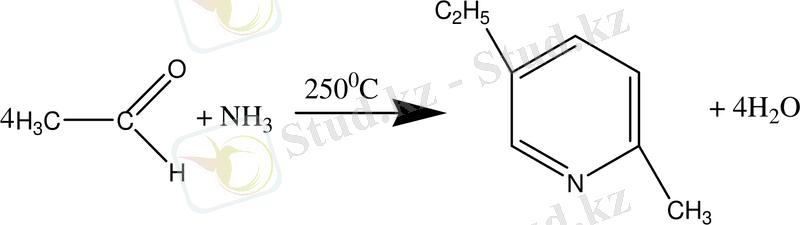
- Никель немесе кобальт катализаторларының қатысуында ацетилен мен аммиак әрекеттесіп, 2-метил-5-этилпиридин түзеді:
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz