Гендік инженерия: негіздері, әдістері және биотехнологиялық қолданбалары


МАЗМҰНЫ
І. Кіріспе
ІІ Негізгі бөлім
2. 1 Гендік инженерия туралы жалпы түсініктеме
2. 2 Гендік инженерияның жұмыс кезеңдері
2. 3 Ген инженериясы негізінде биотехнологиялық өнімдер алу
2. 4 Өсімдіктердің гендік инженериясы.
Қорытынды
Пайдаланылған әдебиеттер
Кіріспе
Гендік инженерия - молекулалық және клеткалық генетиканың қолданбалы саласы. Белгілі қасиеттері бар генетикалық материалдарды In vitro жағдайында алдын-ала құрастырып, оларды тірі клеткаға енгізіп, көбейтіп, зат алмасу процесін өзгеше жүргізу. Бұл әдіспен организмдердегі генетикалық информацияны көздеген мақсатқа сай өзгертіп, олардың геномдарын белгіленген жоспармен қайта құруға болады.
Гендік инженерия ол функционалдық активті генетикалық құрылымдарды рекомбинаттық ДНҚ молекулалары түрінде қолдан құрастыру. Гендік иженерияның мәні жеке гендерді бір организмнен алып басқа организмге көшіру. Бұған рестриктаза мен лигаза ферменттерінің ашылуы мүмкіндік туғызады. Рестриктазалар ДНҚ молекуласын белгілі жерлерден жеке үзінділерге қиып бөлшектейтін ыдыратушы фермент. Қазір ДНҚ молекуласын бір-бірінен өзгеше 120 жерінен үзетін 500-ден астам рестриктазалар анықталған. Алынған полинуклеотид бөлшектерінінің комплементарлық немесе жабысқыш ұштарны ДНҚ лигазасы - бір-біріне желімдеп реттеп жалғасытырып қосады. Осы ферменттердің көмегімен бір ДНҚ молекуласынан қажетті ген бөлініп алынып, басқа ДНҚ молекуласын үзінділерімен құрастырылып рекомбинанттық, яғни жаңа будан ДНҚ жасалады.
Биологиялық қауіпсіздік - адамзаттың ең басты міндеттерінің бірі.
1975 жылы биоқауіпсіздік туралы Халықаралық конференцияда (Асиломар, Колифорния) рекомбинантты ДНҚ молекуласы экспериментінің негізгі қағидасы қабылданды.
1985 жылы Биоқауіпсіздік ақпараттық жұмыс тобы құрылды, оған БҰҰ индустриалды даму Ұйымының елдер-мүшелері кірді, және қоршаған ортаны қорғау Бағдарламасы БҰҰ, сонымен қатар Бүкіл әлемдік денсаулық сақтау ұйымы.
1991 жылы оларға БҰҰ Тағамдық ресурстар мен ауылшаруашылық ұйымы қосылды.
Биотехнология аумағында заңнама жасау әлі толық жөнге келмеді.
Бір жағынан үкімет тарапынан биотехнологиялардың легализациясы болып жатса, екінші жағынан заңнамадағы өзгешеліктер өнімді глобаоды нарыққа шығаруға кедергі жасап отыр.
ІІ. Негізгі бөлім
2. 1. Гендік инженерия туралы жалпы түсініктеме
Гендік инженерия - молекулалық және клеткалық генетиканың қолданбалы саласы. Белгілі қасиеттері бар генетикалық материалдарды In vitro жағдайында алдын-ала құрастырып, оларды тірі клеткаға енгізіп, көбейтіп, зат алмасу процесін өзгеше жүргізу. Бұл әдіспен организмдердегі генетикалық информацияны көздеген мақсатқа сай өзгертіп, олардың геномдарын белгіленген жоспармен қайта құруға болады.
Гендік инженерия ол функционалдық активті генетикалық құрылымдарды рекомбинаттық ДНҚ молекулалары түрінде қолдан құрастыру. Гендік иженерияның мәні жеке гендерді бір организмнен алып басқа организмге көшіру. Бұған рестриктаза мен лигаза ферменттерінің ашылуы мүмкіндік туғызады. Рестриктазалар ДНҚ молекуласын белгілі жерлерден жеке үзінділерге қиып бөлшектейтін ыдыратушы фермент. Қазір ДНҚ молекуласын бір-бірінен өзгеше 120 жерінен үзетін 500-ден астам рестриктазалар анықталған. Алынған полинуклеотид бөлшектерінінің комплементарлық немесе жабысқыш ұштарны ДНҚ лигазасы - бір-біріне желімдеп реттеп жалғасытырып қосады. Осы ферменттердің көмегімен бір ДНҚ молекуласынан қажетті ген бөлініп алынып, басқа ДНҚ молекуласын үзінділерімен құрастырылып рекомбинанттық, яғни жаңа будан ДНҚ жасалады.
Одан кейін рекомбинанттық ДНҚ бірнеше әдістермен тірі клеткаға енгізіледі. Жаңа геннің экспрессиясы өтеді де клетка сол ген белгілейтін белокты синтездей бастайды. Сонымен, клеткаға рекомбинанттық ДНҚ молекуласы түрінде жаңа генетикалық информация енгізіп, ақырында жаңа белгісі жаңа белгісі бар организмді алуға болады. Бұндай организмді трансгендік немесе трансформацияланған организм деп атайды, себебі организмдер өзгеріп басқа қасиетке ие болуын трансформация дейді.
Сөйтіп, гендік инженерияның дамуына негіз болған молекулалық биология мен молекулалық генетиканың мынадай жетістіктер:
- рестректазалармен лигазалардың ашылуы;
- генді химиялық және ферменттерді қолдану арқылы синтездеу әдісі ;
- бөтен генді клеткаға тасымалдаушы векторларды пайдалану;
- бөтен генге ие болған клеткаларды таңдап бөліп алу жолдарының ашылуы.
Алғашқы рет рекомбинаттық ДНҚ 1972 жылы АҚШ та Стенфорд университетінде П. Бергтің лабораториясында жасалған. Онда проберка ішінде үш түрлі микроорганизмнің ДНҚ лары - лямбда фагтің және шек таяқшасы бактериясының ДНҚ фрагменттері мен маймылдың онкогендік вирусының толық геномы қосылған еді.
Өсімдіктердің гендік инженериясы саласында бірінші жұмыстар In vitro өсірілетін клеткалармен 1980 жылы жүргізілген 1983 жылы алдымен күнбағыстың трансгендік каллусы, кейін сол каллустан табиғатта мүлдем болмаған санбин өсімдігі алынды.
Санбин деген ол геномында бұршақтың белогі фазеолинді кодтайтын гендері бар күнбағыс өсімдігі еді.
Гендік инженерия гендерді тасымалдау тәсілі ретінде болашақта екпе өсімдіктердің селекциясының тиімді аспабы бола алады. Қазіргі кезде гендік инженерия алғашқы қадамдарын басып, екпінді дамып келеді.
Гендік инженерияның әдістемелік негізі жарықтың мезофилл клеткаларының немесе каллус ұлпасының протопластары болады. Жаңа генетиканың информацияға ие болған протоплаты өсіріп одан регенерант өсімдігін алуға болады. Генетикалық трансформация үшін сомалық клеткалардан басқа тозаң клеткалары, жұмыртқа клеткасы қолданылады. Сонымен, In vitro өсірілетін клеткаларға гендік инженерияның әдістерін қолданып, өсімдіктің бағалы белгілері бар негізінде жаңа формаларын құруға болады.
2. 2 Гендік инженерияның жұмыс кезеңдері
Гендік инженерияның жұмысы мынадай кезеңдерден тұрады:
- басқа организмге көшірілетін құрылымдық генді алу;
- оны вектордың құрамына енгізу, яғни рекомбинанттық ДНҚ жасау;
- рекомбинанттық ДНҚ-ын өсімдік клеткасына тасымалдау;
- өсімдік клеткаларында бөтен ДНҚ-ның экспрессиясын талдау;
- геномы өзгерген жеке клеткалардан регенерант өсімдігін алу.
Гендерді тасымалдайтын векторлар
Бөтен генді клетка ішіне тасымалдап алып баратын арнаулы ДНҚ молекуласын вектор деп атайды. Оған мынадай талаптар қойылады:
- өз алдына репликациялану, яғни клетка ішіне бөтен генді алып кірген соң клеткамен бірге немесе өзалдына көбейе алатын болуы керек; немесе вектор клетка хромосомасының құрамына еніп, онымен бірге ұрпақ клеткаларға беріліп отыруы керек;
- трансформацияланған клеткаларды анықтау үшін оның ерекше генетикалық белгілері болуы керек;
- құрамында рестриктазалар үзе алатын нуклеотидтер тізбегі болуы керек және репликацияға қабілетін жоғалтпауы керек;
- векторға орналастырылған бөтен ген оның атқаратын қызметін бұзбауы керек, ал вектор болса, ол да енгізілген геннің ішінде дұрыс реттеліп жұмыс істеуін қамтамасыз ететін болуы керек;
- вектордың көлемі кішігірім болуы керек.
2. 3 Ген инженериясы негізінде биотехнологиялық өнімдер алу.
Қазіргі кезде тек ген инженериясы ғана адамға қажетті биологиялық активті заттарды химиялық таза күйде алуды қамтамасыз ете алады. Ген инженериясының қарқынды дамуы арқасында адамның бірқатар ауруларын (оның ішінде генетикалық ауруларды) емдеу және ауыл шаруашылық малдарының өнімділігін жоғарылату мүмкін болды. Енді, олардың мысалдарына тоқталайық.
Алғаш рет медицинада ген инженериясының өнімі - инсулин қолданды. Инсулин ұйқы безінде түзіледі, оның арқасында қандағы глюкозаның артық мөлшері жануар текті крахмал гликогенге айналады. Ұйқы безінде инсулиннің түзілуі бұзылатын болса, адам диабет ауруына 4 ұшырайды: глюкоза гликоген түрінде бөгеліп қалмағандықтан, қанда жүзім қантының мөлшері артады. Есептеу бойынша дүние жүзінде 60 млн. адам диабетпен ауырады, яғни ол жүрек және рак ауруларынан кейін адамның өліміне әкелетін үшінші ауру болып саналады. Диабетпен ауыратын адам тәулігіне гормонның орта есеппен 40 бірлігін қабылдауы қажет. Осы уақытқа дейін инсулиннің негізгі шығу көзі - етке өткізілген сиыр мен шошқаның ұйқы безі болатын. Сиырдың ұйқы безінің салмағы 200-500 г; кристалдық инсулиннің 100 г. алу үшін 800-1000 кг. ұйқы безі қажет. Бұдан басқа, ауру адамдардың біраз бөлігі, әсіресе балаларда бұл гормонға аллергия дамығандықтан, оларды жануар текті гормонмен емдеудің қиындығы бар. Екінші жағынан, инсулинге тәуелді адамдардың саны жылдан жылға арта түсуде. Осы себептерге орай адамның ген-инженерлік инсулинін бактерия клеткасында өндіру қажеттігі туды.
Инсулин гормонының ұзындығы 20 және 30 амин қышқылдарына тең А және В екі полипептидтік тізбектен құралған, олар бір-бірімен қос дисульфидтік байланыс құрады. Организмде инсулин алғашқы кезде 109 амин қышқылдарынан құралған препроинсулин құрамына енеді. Препроинсулиннің ұйқы безі β-клеткаларында синтезделуінде алғашқы 23 амин қышқылы молекуланың клетка мембранасынан өту үшін қажет болады; бұл амин қышқылдар ажырап, 86 амин қышқылдарынан тұратын проинсулин түзіледі. Проинсулиннің орта бөлігі ферменттің әсер етуімен ыдырап кетеді, мұның нәтижесінде инсулин түзіледі.
Адам инсулині генін алғаш рет 1978 ж. «Генентек» фирмасы (АБШ) синтездей алды. Соматостатин гені сияқты инсулиннің синтетикалық гені плазмидаға β - галактозидаза генінің соңына енгізілді. Мұнда әрбір бакте-риялық клеткада инсулиннің шамамен 100 000 молекуласы синтезделді. Е. Соlі клеткасында проинсулиннің биосинтезі іске асты; ол үшін кері транскриптазаның көмегімен иРНҚ-дан оның ДНҚ-көшірмесі (кДНҚ) синтез-делді. Америкалық «Эли Лилли» фирмасының зерттеушілері Е. Соlі клеткасының 20% көлемін проинсулин немесе инсулин алатынын атап көрсетті. Көлемі 1000 л бактерия культурасынан 200 г дейін инсулин өндіруге болады, әншейінде гормонның мұңдай мөлшерін өндіру үшін сиырдың немесе шошқаның 1600 кг ұйқы безін өңдеу қажет болар еді. 1982 жылы АБШ-тың азық-түлік өнімдері, косметикалық, заттар, дәрі-дәрмектер Федералдық Басқармасы (FDA) «Эли Лилли» компаниясы шығаратын «Хемулин» (инсулиннің саудалық аталуы) препаратын сатуға рұқсат берді. Ұлыбритания мен СССР-де рДНҚ технологиясы арқылы бактерия клеткасында инсулин өндіру 1980 жылдары ойдағыдай шешілді.
Инсулиннен кейін генинженерлік фармокология соматотропин деп аталатын өсу гормонын бактериялық, клеткада синтездеуді шындап қолға алды.
Адамдарда соматотропин гипофиздің алдыңғы бөлігінде синтезделеді, оның жетіспеушілігі гипофиздік ергежейлілікке әкеледі. Көп уақыт бойы соматотропинді өліктерден бөліп келді. Алайда, дамыған елдерде осындай жолмен бөлінген гормон гипофиздік ергежейлілікпен ауыратын адамдардың тек үштен біріне ғана жеткілікті болды. Бұдан басқа, өліктерден бөлінген гормонның қоспасы көп болғандықтан, препарат қабылдаған аурулардың 30%-і гормонға қарсы антизаттар синтездейді, мұның өзі гормонның активтілігін жоққа шығарды. Гипофиздік материал баяу дамитын вируспен зақымданған деген де қауіп болды (гормон қабылдаған 4 адамның Крецфельдт-Якоб ауруынан өлуіне байланысты), сондықтан соматотропин қабылдаған балаларды көп жылдар бойы бақылауға алуға тура келеді.
Ген инженериясының әдістері арқылы арнайы құрастырылған бактерия, клеткаларында түзілген өсу гормонының айқын артықшылықтары бар: препараттар биохимиялық тұрғыдан таза, инфекциялық вирустар жоқ және көп мөлшерде синтездеуге болады.
Швецияның «Каби витрум» фирмасы 1978 ж. «Генентек» компаниясымен ген инженериясының әдісі арқылы соматотропинді синтездей алатын бактерия штамын алу үшін келісімге қол қойды. Сегіз айдан соң «Генентек» фирмасының зерттеушілері - Дж. Геддель және т. б. соматотропинді синтездей алатын Е. Coli K 12 штамын алды. Алайда, алынған синтетикалық гормонның N-ұшында метиониннің қосымша қалдығы болды. 1980 ж. «Генентек» компаниясының; зерттеушілері қо-сымша метионині бар синтетикалық гормонның биологиялық активтілігі табиғи соматотропиннен кем түспейтін дәлелдерін FDA-ға ұсынды.
1985 ж. соңынан бастап «Каби Витрум» компаниясы «су гормонын сомтрем деген аталумен Стренгнестегі өзінің зауыттарының ферментерлерінде (әрқайсысының сыйымдылығы 1500 л) кең өңдірістік масштабта шығаруда. Мұнда, 7 сағат ішінде 1 л бактериялық культурадан алынған гормонның мөлшері 60 өліктің гипофизінен алынғанға эквивалентті. Бұл гормонды қолдану нәтижесінде адам бойының жылдың өсуі 8-18 см тең болды. Ал, 1987 ж. «Эли Лилли» компаниясы рекомбинантты ДНҚ негізінде метионині жоқ яғни табиғи гормоннан айнымайтын өсу гормонын өндірістік негізде шығаруды бастады. Бұл, 191 амин қышқылынан тұратын синтетикалық гормон хуматроп деген коммерциялық аталуымен белгілі.
Қазіргі кезде Жапония, Канада, Англия және Францияда рекомбинантты соматотропинді бактериялық клетка арқылы өндірістік жағдайда өндіру кең жолға қойылған.
Рекомбинантты ДНҚ әдістерін пайдаланып, организм өсуінің басқа факторларын (соматостатин, соматомедин т. б. ) синтездеуге болады. Соматостатин генінің өнімін Е. Coli клеткасынан лак-оперонды қолданып, бөлу мүмкіндігін біз жоғарыда талқылаған болатынбыз. Адамда гипофиздің аденомасында акромегалия ауруы (жақ жәйе жіліктердің шеміршек ұштарының сәйкессіз өсуі) дамиды. Аурудың себебі ретінде соматотропиннің мөлшерден тыс синтезделуінен болады. Міне, осындай ауруды рДНҚ негізінде алынған соматостатинмен емдеудің пайдасы өтө зор.
Мал шаруашылығындағы ген инженериясының маңызды жетістіктерінің бірі болып ген-инженерлік соматотропинді зоотехнияда қолдану саналады. Бұл күрделі полифункциялық белок мал шаруашылығында екі бағытта қолдану алды: 1) малдың өсуін стимуляциялау үшін (соматогендік активтілік) ; 2) сүт бездерінің қызметін жақсарту үшін (лактогендік активтілік) . Яғни соматотропин препараты малдың өсуін жеделдету және сауын сиырдың сүттілігін жоғарылату үшін қолданылады. Өсу гормонының соматогендік пен лактогендіктен басқа екі физиологиялық активтілігі бар: инсулиндік және диабеттік. Қазіргі кезде соматотропиннің рекомбинантты ДНҚ технологиясының мақсаты - өсу гормонының бар ғана активтілігінің биотехнологиялық өнімін алу. Мысалы, гормонның N-ұшының алғашқы 150 амин қышқылдарынан айырылған соматотропиннің туындылары алынды. Бұл туынды организмнін; өсуін жеделдете алады, ал оның инсулиндік және диабеттік активтілігі байқалмайды. Гормонды соматогендік және лактогендік бөліктерге бөлу тә-жірибелері де ойдағыдай өтті.
Әр түрлі текті соматотропиндер өздерінің бірінші құрылымы бойынша бір-біріне өте ұқсас, бірақ оларға түр - ерекшелік тән. Басқаша айтқанда, сиырдың гормондық активтілігін күшейту үшін оған тек ірі қара малдан құ-растырылған соматотропиннің рекомбинантты ДНҚ-сының - өнімін ғана енгізу керек. Малдарға адам соматотропинін енгізу арқылы организмнің өсуіне физиологиялық әсер еткенімен, оның активтілігі күткен нәтижені бермейді.
Физиологиялың активті жетілген соматотропиннің молекулалық массасы -22 кД және әр түрлі мал түрлерінде 190-195 амин қышқылдарынан құралған. Гормон, алдымен гипофизде прегормон түрінде синтезделеді. Ерекше протеазалық әсерінен прегормонның N - ұшынан 25 амин қышқылынан құралған, сигналдық тізбек деп аталынатын оның гидрофобтық ұшы ажырайды. Қалған полипептидтік тізбек жетілген соматотропинге сәйкес келеді.
Мал түліктерінде соматотропин генінің клонын алу азғана өзгеріспен адамның осындай генінің рДНҚ-сын алу үлгісіндей өтті (П. Баттери және т. б., 1986) . Соматотропин геніне экзон-интрондық ұйымдастырылу тән болғандықтан және геннің бактерия клеткасындағы экспрессиясын алу үшін, иРНҚ негізінде кДНҚ көшірмелері алынды. Геддель әдістемесі бойынша генді Нае III рестрикциялық ферментімен үзіп, 531 н. ж. құралған ДНҚ тізбегін алды (1-сурет) . Бұл бөлік сигналдық тізбегі жоқ жетілген гормонды ғана коделейді. Алайда, малдың басқа физиологиялық активті белоктарын жетілген полипептидтік тізбек арқылы тікелей микробиологиялық синтездеу мүмкін болғанымен, мұндай әдісті соматотропинді синтездеуде қолдану мүмкін емес, өйткені бактериялық тасығыш-белокты соматотропиннен айыру қиын (химерлі белокты - бактериялық белокты, белок-соматотропиннен метионин бойынша бромцианнан айыруға болмайды, өйткені соматотропиннің құрамында метионин қалдықтары бар) гормонның түререкшелік әсері бұзылуы мүмкін. Сондықтан қтДНҚ-ға, оның бактериялық клеткадағы жұмысын қамтамасыз ететін прокариоттық реттеуші элементтер жалғанады, бұл сонымен қатар соматотропин молекулаларын еркін мономерлі түрде алуға мүмкіндік береді.
Соматотропин молекулаларын прегормон формасында алу да ыңғайлы. Ол үшін жетілген гормон генінің ұшына реттеуші элементтермен қатар белгілі тізбекті коделейтін синтетикалық тізбекті жалғайды. Синтетикалық тізбек Геддель әдістемесі бойынша 84 н. ж. құралған және химиялық жолмен синтезделеді. Соматотропиннің немес оның прегормон формасындағы генін Е. Соlі клеткасына енгізіп, зоотехния үшін аса пайдалы препараттар алады.
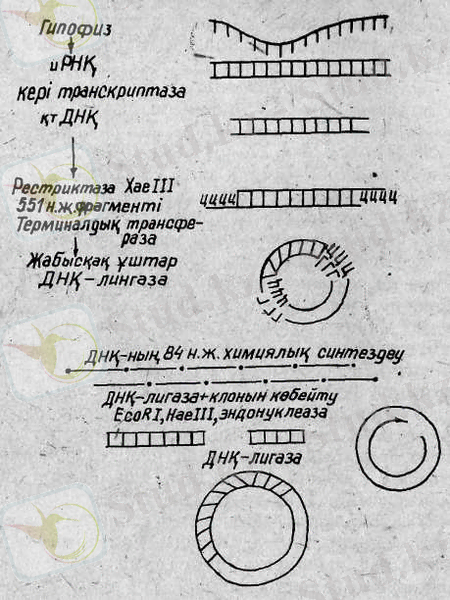
1-сурет. Соматотропин генін құрастыру үлгісі.
Қазіргі кезде ген-инженерлік әдіс арқылы ірі қараның, қойдың, шошқаның және тауықтың соматотропин гені алынды және оның Е. Соlі клеткасындағы клонын алу және экспрессиясы іске асты. Мұқият жүргізілген зерттеулер ірі қараның бактериялардан алынған сома-тотропині сауын сиыр сүттілігінің артуына ықпал ететінін дәлелдеді. Малға тәулігіне 13, 5-тен 40-5 мг дейін соматотропинді енгізгеңде, сиырдан алынған сүт мөлшері препараттың мөлшері мен малдың күтіміне байланысты 10-нан 50%-ке дейін көтерілді. Осы биотехнологиялық өнімді ірі қара сүт шаруашылығында жаппай қолдану кейбір ғалымдардың (Т. Аткинсон және т. б., 1985; Д. Бауман, Мак Гутчеон, 1985) пікірі бойынша сиыр сүттілігін орта есеппен 23-31%-ке көтереді. П. Баттери өз қызметкерлерімен (1986) ұзақ уақыт бойы (188 күн) соматотропин қабылдаған сиырлар сүтінің сапасы бақылау тобынан ешқандай айырмашылығы жоқ екендігін дәлелдеді. Бұдан соматотропин малдың басқа физиологиялық белгілеріне зиянды әсер бермеді.
Кейінгі кезде соматотропинді малдың (ірі қараның, ірі қойдың және шошқаның) еттілігін жақсарту үшін де қолдануда. Малдың түріне, күтіміне және гормондық препараттың мөлшеріне байланысты тәжірибе тобының орта есеппен тәулігіне қосқан салмағы 20-30%-ке артты, бұл малды семірту уақытының қысқаруына әкелді. Бұдан басқа, өсу бірлігіне азық шығынының азайғаны байқалды. Ең бастысы, малдың тірі салмағының артуы еттілік сапасының нашарлауына әкелген жоқ: етте соматотропиннің артық мөлшері болған жоқ. Гормонның 30-200 мг-ын организмнің 1 кг массасына тәулік сайын енгізу торайдың өсуін тездетті және еттің сапасын жақсартты. Еттегі май мөлшері 55%-ке азайды. Соматотропинді қолдану арқасыңда шошқалар 100 кг салмақты қосуы кәдімгі азықтандырумен салыстырғанда 7-10 күнге кеміді.
Қазірге кезде «Монсанто» компаниясы организмге ұзақ уақыт әсер ететін гормондық препараттарды алу жұмыстарын жүргізуде. Мұндай соматотропинді өндірістік жағдайда қолдану өте ыңғайлы (әдетте, гормонды малға күн сайын енгізу керек) . Алайда, генетикалық инженерияға негізделген биотехнологиялық өнімдер сауда объектісіне айналғандықтан мұндай жаңа коммерциялық зерттеулердің технологиясын фирма әдетте құпияда ұстап, оның нәтижесін баспадан шығармайды.
Жаңа зерттеулер соматотропинді организмнің өсуіне әсер ететін басқа гормондармен қоса қолданылу мал өсуін тиімді жеделдететінін көрсетті. Осындай гормонның бірі соматомединнің рекомбинантты гені синтезделді. Оны соматотропинмен бірге қолдану ірі қара мен шошқаның есуін өте тиімді жеделдетті (Т. Вагнер және т. б., 1986) . :АБШ-тың «Биоген» фирмасы бұқаның соматомедин С генінің клонын көбейтіп, оның өнімін бактериялық клеткадан ендірді. Бұл фирманың зерттеушілері өздерінің ғылыми еңбектерін баспада түгел жарияламаса да, олардың пікірі бойынша соматомединнің мал өсуін жеделдеткіш препараты ретінде соматотропинмен салыстырғанда кейбір артықшылықтары бар.
Алдыңғы қатардағы биотехнологиялық фирмалар (мысалы, Дженерал Диагностик Корп, АБШ) рекомбинантты ДНҚ технологиясы арқылы мал өсуін реттейтін белокты заттарды шығаруды бастады. Мысалы, протеаза ингибиторлары белоктың ыдырау жылдамдығын бәсеңдетуі арқылы малдың ет массасының көбеюіне себепші болады. Белоктың препарат β - агонист май қыртыстарын азайтып, ет ұлпасының түзілуін күшейтеді.
Ген инженериясының әдістері медициа үшін қан факторлары (VIII- және IX факторлары) мен иммуномодуляторларын (интepфepoн және интерклейкин) алу үшін кеңінен қолданылады. Интерферон адам және жануар клеткаларында инфекциялық, вирустарға қарсы синтезделеді. Олардың антивирустық активтілігі бар, сонымен қатар қатерлі ісіктердіқ (рак ауруының) көбеюін тоқтата алады. Интерферонның, үш түрін ажыратады: a - интерферон лейкоциттерде вирустарға қарсы түзіледі; β - интерферон - фибробластарға вирустар әсер еткенде түзіледі және иммундық деп аталатын γ - интерферон, Т-лимфоциттерде вирустық немесе бактериялық антигендерге және қатерлі ісіктерге қарсы синтезделеді.
Зерттеу жұмысының басында интерферон генін алу қиын болды, өйткені белоктың құрылымы белгісіз болатын. Бұл синтетикалық генді және клонды табу үшін қажет синтетикалық олигонуклеотидтік сүңгіні құрастыру мүмкіндігін қиындатты. Осы себепке байланысты ген клонын алу үшін интерферон иРНҚ-сының кері транскрипция әдісі қолданылды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz