Магнийорганикалық қосылыстар мен аминоспирттердің винил эфирлерінің химиясы: моноэтаноламин винил эфирінің ацетальдегидпен конденсациясы арқылы жаңа магнийорганикалық туындыларды алу


Кіріспе
1. Магнийорганикалық қосылыстар . . 3
- Магнийорганикалық қосылыстардың алыну жолдары. 4-5
- Магнийорганикалық қосылыстардың химиялық қасиеттері………5-10
- Гриньяр реактиві, оның химиясы10-13
- Аминоспирттердің винил эфирлеріЖай винил эфирлеріне жалпы сипаттама . . . 14-15Винил эфирлерінің химиялық қасиеттері. . 15-19Аминоспирттердің винил эфирлері . . . . 19Ацетилен негізінде аминоспирттердің винил эфирлерін алу . . . … . . . 19-20Аминоспирттердегі байланыс табиғаты . . . … . . . 20-21Аминоспирттер винил эфирлерінің полимерленуі . . . ……21-23Аминоспирттер винил эфирлерінің практикалық қолданылуы . . . …23-25
- Ғылыми - эксперименттік жұмыстарға талдауМоноэтаноламин винил эфирінің ацетальдегидпен конденсациялану реакциясы . . . 26-27Гриньяр реактивінің Шифф негізімен тотықсыздану реакциясы. . . 27-28ИҚ - спектроскопиялық әдіс . . 28-29
- Эксперименттік бөлімБастапқы реагенттердің физико- химиялық қасиеттеріне
сипаттама . . . … . . . 30
4. 2. Моноэтаноламин винил эфирін тазарту . . 31
- N - этилиден винилокси этиламин синтезі31-32
- N -винилокси - этил - екіншілік бутиламин және N -винилокси - этил- екіншілік гексиламин синтездері . . . ………. . 32-33
Қортынды. 34
Пайдаланылған әдебиеттер35-37
Нұсқаулар
Кіріспе
ХХІ қолданылатын металдардың ішінде магний органикалық синтездің есіктерін ашуға табылған негізгі кілт болды.
Магнийорганикалық қосылыстарды оның қышқыл, спирт, көмірсутектер синтезінде қолданылатынын көрсетіп, олардың органикалық синтезде кең қолоданыс табуына жол ашқан Виктор Гриньяр болды. Сондықтан магнийорганикалық қосылыстарды осы ғалымның атымен де атайды, яғни Гриньяр реактиві.
Магнийорганикалық қосылыстар негіз түрінде кетондар, полифункциональды қосылыстармен реакцияға түседі. Сондай - ақ нуклеофиль түрінде қосылу және орынбасу реакциясына қатысады. Бұл қосылыстар қатысында жүретін реакциялар оның әр алуан органикалық синтездер жүргізуде ерекше мәнге ие екенін көрсетеді [46] .
Жұмыстың алға қойған мақсаты - магнийорганикалық қосылыстарды жан - жақты зерттеп, аминоспирттер винил эфирлерінің өкілі моноэтаноламин винил эфирлерінің карбонильді қосылыстармен конденсациялану реакциясын зерттеп, реакция барысында синтезделген мономер негізінде жаңа магнийорганикалық қосылыстардың туындыларын алу.
І. Магнийорганикалық қосылыстар
Магнийорганикалық қосылыстардың қатысымен жүретін синтездер органикалық химиядағы ең маңызды препаративті әдіс болып табылады. Магнийорганикалық қосылыстарды жай R - Mg - Hal формуласымен көрсетуге болады. Олардың мономерлі түрлері төменгі концентрацияда, нуклеофильдік еріткіштерде түзіледі [1, 7] .
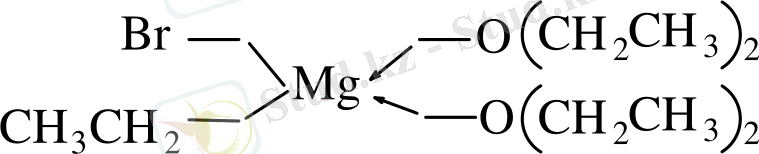 Магнийорганикалық қосылыстар еріткіштерде сольватталып магний және оттек атомы арасында өзара әрекеттесу түзіліп, кристалдық комплекстер пайда болады.
Магнийорганикалық қосылыстар еріткіштерде сольватталып магний және оттек атомы арасында өзара әрекеттесу түзіліп, кристалдық комплекстер пайда болады.
 С - Mg арасындағы коваленттік байланыс күшті поляризацияланған, себебі электрон тығыздығы электртерістілігі аз магний атомынан (ЭТ = 1, 2) электртерістілік мәні жоғары көміртек атомына (ЭТ= 2, 5) ығысқан. Осы кезде көміртек атомында электрондар шоғырланып, байланыстың иондану дәрежесі 34% - ке жетеді. Мұны келесі құрылымдық формуламен көрсетуге болады:
С - Mg арасындағы коваленттік байланыс күшті поляризацияланған, себебі электрон тығыздығы электртерістілігі аз магний атомынан (ЭТ = 1, 2) электртерістілік мәні жоғары көміртек атомына (ЭТ= 2, 5) ығысқан. Осы кезде көміртек атомында электрондар шоғырланып, байланыстың иондану дәрежесі 34% - ке жетеді. Мұны келесі құрылымдық формуламен көрсетуге болады:
- Магнийорганикалық қосылыстарды алу жолдары
Магнийорганикалық қосылыстар галогеналкилдерінің металдарының магниймен әрекеттесуі құрғақ эфир ортасында жүреді. Кей жағдайда каталитикалық мөлшерде иод немесе дибромэтан қосып, инициирлену процесін жүргізеді [10, 17] .
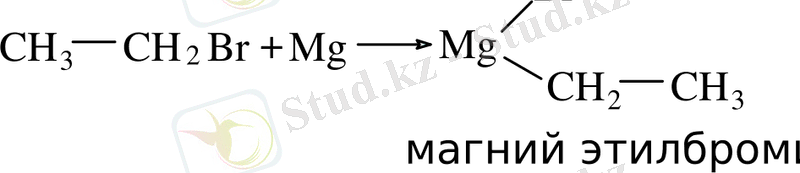
Өндірісте магнийорганикалық қосылыстарды қолдану кезіндегі қауіпсіздік ережесіне сай, бұл қосылыстарды синтездеу барысында эфирсіз әдіс қолданылады.
Магнийорганикалық қосылыстардың галогеналкилден немесе магнийден түзілуі галоид тұздармен немесе әр түрлі металдардың оттекті қосылыстарымен, алкил туындыларымен катализденеді. Мысалы, бензол ортада магнийорганикалық қосылыстардың түзілуі тетрооксисиланмен инициирленеді:

- Магнийорганикалық қосылыстардың химиялық қасиеттері
Магнийорганикалық қосылыстар бос күйінде бөлінеді, жоғары реакциялық қабілеті бар, реакцияда ұзақ уақыт сіңіріледі. Олар алмасу реакцияларына қатысады, Mg - Гал қалдығы сутекпен, алкилді радикалмен, әр түрлі металдармен, бейметалдармен орынбасады. Оларға тән негізгі реакция магнийорганикалық қосылыстардың қосарланған поляризациялы байланыспен қосылу реакциясы. Осы реакциялар магнийорганикалық қосылыстардың органикалық синтездегі маңызды ролін көрсетеді. Реакцияның негізгі мәні жаңадан түзілген С - С байланысына негізделген.
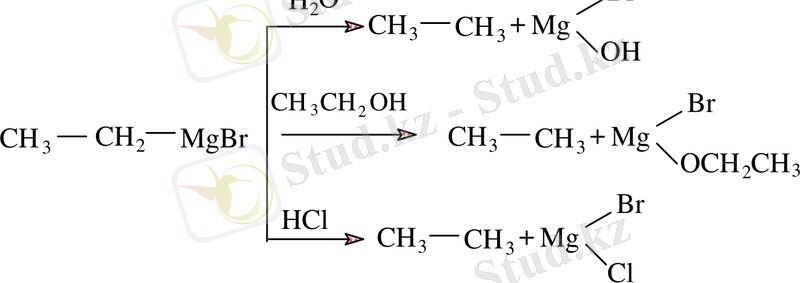 Құрамында қозғалғыш сутек атомы бар қосылыстармен әрекеттесуі су, спирт, қышқыл, көмірсутек түзіп, магнийорганикалық қосылыстарды айырады.
Құрамында қозғалғыш сутек атомы бар қосылыстармен әрекеттесуі су, спирт, қышқыл, көмірсутек түзіп, магнийорганикалық қосылыстарды айырады.
Бұл қосылыстардың тотығу реакциясы:

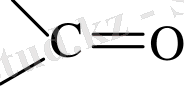 Магнийорганикалық қосылыстардың альдегидтермен, кетондармен және күрделі эфирлермен әрекеттесуі 1, 2 - ші және 3 - ші ретті спирттердің синтезімен аяқталады. Мұндай алмасу типі 3- ші ретті спирттер алуда маңызды.
Магнийорганикалық қосылыстардың альдегидтермен, кетондармен және күрделі эфирлермен әрекеттесуі 1, 2 - ші және 3 - ші ретті спирттердің синтезімен аяқталады. Мұндай алмасу типі 3- ші ретті спирттер алуда маңызды.
Бұл жағдайда магний тобында электртерісті сутек атомына қосылады және түзілген алкоголяттар сумен гидролизденеді.
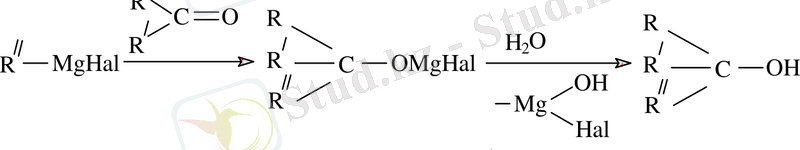
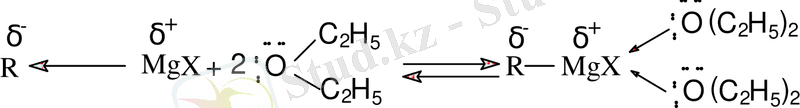
Магнийорганикалық қосылыстарды тек ерітінді күйінде қолданады. Ертінділерде магнийорганикалық қосылыстар эфир молекулаларымен немесе басқа электродонорлы бөлшектермен сольватталған:
Аталған қосылыстардың қасиеті көбінесе С - Mg арасындағы полюсті байланыспен анықталады. Бұл фрагментте көміртек атомында жартылай теріс заряд бар, бірақ ол күшті электртерістілік мәніне ие емес. Осыған байланысты ол электрофильді реагент жағынан оңай шабуылға ұшырайды. Осы қасиеті магнийорганикалық қосылыстарды негіздердің және нуклеофильдердің тотықсыздандырғышы ретінде көрсетеді.
Магнийорганикалық қосылыстарды көміртек атомымен берік байланыс түзбейтін металл - тотықтырғыш галогенидтермен өңдегенде көмірсутекті радикал пайда болады. Ол әрі қарай димерленіп симметриялық алкан береді [10, 11] .
R - Mg - Hal қосылыстарының әсерінен тотықсызданатын және көміртек атомымен берік байланыс түзетін металл галогенидтері металлорганикалық қосылыстардың синтезі үшін қолданылады.
2C 2 H 5 MgBr + ZnCl 2 → (C 2 H 5 ) 2 Zn + 2MgBrCl
4CH 3 MgJ + SiCl 4 → (CH 3 ) 4 Si + 4MgJCl
2CH 3 CH 2 - CH 2 - MgCl + HgCl 2 → (CH 3 CH 2 CH 2 ) 2 Hg + 2MgCl 2
3C 2 H 5 MgBr + PCl 3 → (C 2 H 5 ) 3 P + 3MgBrCl
Магнийорганикалық қосылыстардың иодпен реакциясы алкилиодид синтезінде қолданылады.
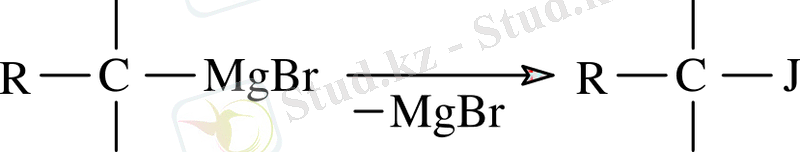
Бұл реакцияны ертіндідегі RМgHal мөлшерін, яғни оны эфирдегі магний және алкилгалогенидтер алуда, магнийорганикалық қосылыстардың шығымын анықтауда қолданылады.
Магнийорганикалық қосылыстың негіз ретінде жүретін реакиялары.
Гриньяр реактивінде магниймен байланысқан көміртек атомында теріс заряд бар. Бұл атом протондық қозғалғыштыққа ие емес. Осыған магнийорганикалық қосылыстар күшті негіздер болып табылады. Айтылғандар оның реакцияда, яғни құрамында сутек бар, протонды қозғалғыштықта ие (сутектің қозғалғыш атомдары деп аталады) қосылыстармен реакцияда көрсетіледі.
RCH 2 - MgHal + H 2 O → RCH 3 + Mg(OH) Hal
Бұл реакция дейтерияны нақты анықталған молекула орнына ендіру үшін қолданылады:
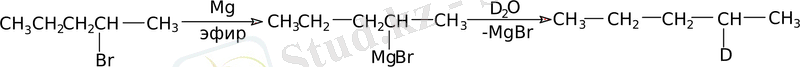
Гриньяр реактивін аммиактың эфирлі ертіндісінен өңдегенде магнезиламин түзіледі, ол эфирмен комплекс береді:
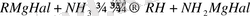
Магнийорганикалық қосылыстардың ацетиленмен әрекеттесуі «Иоцич компонентін» береді:

Бұл айналым магнийорганикалық қосылыстар синтезінің алмасу реакциясының мысалы болып табылады.
Аналогиялық түрде сәйкес магнийорганикалық қосылыстар α - ацетилендерден алынады [23, 46]
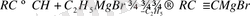
Негіз ретіндегі Гриньяр реактивінің қасиеттерін органикалық қосылыстық құрамындағы «қозғалғыш сутек атомын» анықтауда қолданылады. Анализденетін қосылысты метилдигалогенидпен өңдейді. Бұл кезде молекуладағы «қозғалғыш» сутек атомдарының санына сәйкес метан мөлшерлі түрде бөлінеді:

екі қозғалғыш сутек
атомы бар молекула
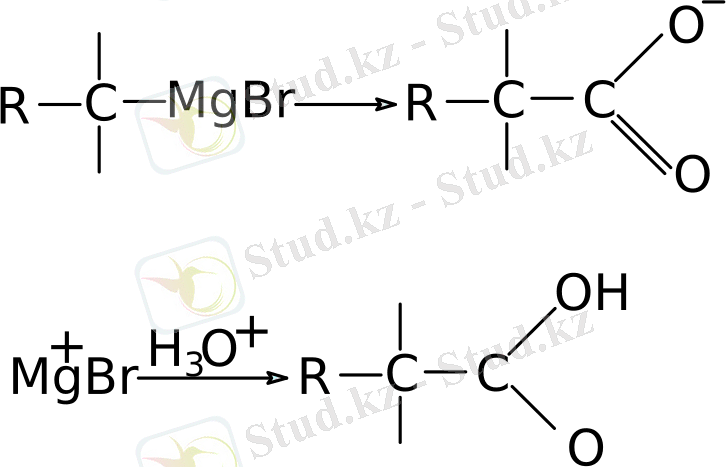
Магнийорганикалық қосылыстардың галоген түрінде реакцияға түсуі препаративті органикалық химияда үлкен мәнге ие. Бұл жағдайда магнийорганикалық қосылыстардың молекуладағы реакция орталығы болып тағы да магниймен байлансықан көміртек атомы табылады, бірақ ол нуклеофильді қасиет көрсетеді, яғни көміртек - көміртек байланысын түзу үшін электрофилге электрон жұбын береді. Карбон қышқылдарының синтезі оған жай мысал бола алады:
Осындай орынбасуға магнийорганикалық қосылыстардың аллилгалогенидтермен әсері мысал бола алады:
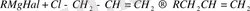
Магнийорганикалық қосылыстарды алкилдеу негізінде қарастырылған бұл реакция алкан - 1 алудағы ең тиімді әдіс болып табылады. Мысал ретінде 2 - метилпентен - 1 синтезінің схемасын келтіруге болады:
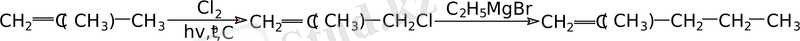
«Аллильді» жағдайда тұрған галогеннің қозғалғыштығы эфирдегі аллилмагний галогенидін алғанда қиындық туғызады, себебі соңғы түзіліс бастапқы аллилхлоридпен реакцияласып диаллил береді. (гексадиен - 1, 5) :
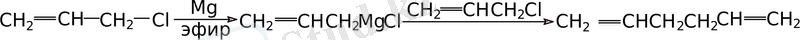
Бұл реакцияны қосарланбаған диендер синтезі үшін қолданады. Себебі қосарланбаған жүйе изомеризация кезінде қосарланған жүйеге ауысады:
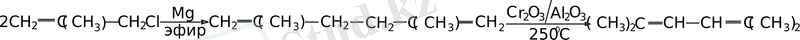
Радикалдың екі еселенуін болдырмау үшін, аллилмагнийхлорид алғанда оны былай дайындайды: эфирдегі магнийдің көп мөлшеріне сұйытылған аллилхлоридтің эфирдегі ертіндісін қосады немесе реакцияны эфирде емес тетрагидрофуранда жүргізеді.
Еріткіш ретінде тетрагидрофуранды қолдану винил типті алкилбромидтерден магнийорганикалық қосылыстар алуға мүмкіндік бермейді, бұны эфирде жүзеге асыру мүмкін емес:
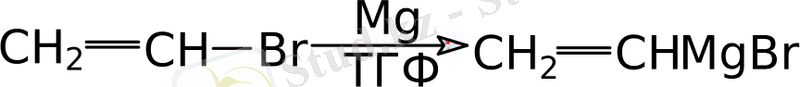
Мынаны ескеру керек, алкилгалогенидтер ішінде бірінші ретті иодидтердің практикалық мәні ерекше және олардың өзі салыстырмалы қатаң жағдайда, аз шығымдармен магнийорганикалық қосылыстармен алкилдене алады:
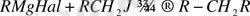
Сонымен қатар магнийорганикалық қосылыстар тотықсыздандырғыштар, негіздер, нуклеофильдер қасиеттеріне ие, ал магний атомы координациялық қанықпағандық көрсетеді. Бұл олардың қасиеттерінің көптүрлілігі, жеңіл дайындалуы және қауіпсіз қолданылуы олардың синтетикалық органикалық химияда кең қолданылуына алып келді [15] .
1. 3 Гриньяр реактиві, оның химиясы
Толық магнийорганикалық қосылыстар - R 2 Mg және аралас магнийорганикалық қосылыстар - RMgX. Мұндағы, R - алкил немесе арил радикалы, Х - галоген. RMgX типті қосылыстың маңызы зор. Ол Гриньяр реактиві деп аталады. RMgX типті қосылыстарды көбіне RX эфир ортасында магниймен әрекеттестіріп алады. Реакция мына теңдеумен өрнектеледі:
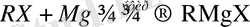 (1)
(1)
Гриньяр реактивін алу кезінде негізгі реакциялармен бірге жанама процестер өтеді. Оған мысал ретінде Вюрц реакциясын қарастыруға болады:
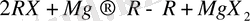 (2)
(2)
Бұл реакцияның өту жеңілдігі Х табиғатына және R құрылысына байланысты [13, 14] .
Бірдей радикал болғанда RX реакциялық қабілеттілігі мына рет бойынша кемиді:
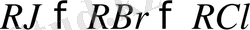
Осы реттілікпен көрсетілген жанама процестердің де жүру жеңілдігі төмендейді. Сондықтан R-MgX шығымын жоғарылату үшін алкилхлорид немесе бромидтер қолдану тиімді. Бұл әсіресе екінші, үшінші ретті алкилгалогенидтерге, бромидтерге және иодидтерге қатысты, себебі олар магниймен әрекеттескенде өзіне қатысты және сәйкес алкендерге жеңіл айналады.
RX реакциялық қабілеттілігі радикал құрылысына байланысты. Галогені аллилді немесе бензилді орында тұрған қосылыстар магниймен реакцияға оңай түседі. Бірақ олар Гриньяр реактивін алу үшін және оңай өтетін жанама процестерді болдырмау үшін магнийдің аса сұйытылған ерітінділерін қолдану керек.
Гриньяр реактивін алу үшін активті RX қосылысынан реагенттерді эфирде қыздыру жеткілікті. Кей жағдайда, әсіресе арилгалогенидтермен жұмыс істегенде, магнийді алдын - ала активтеу қажет. Активатор ретінде көбінесе иод қолданылады.
Иодтың каталитикалық ролі былай түсіндіріледі, ол магниймен әрекеттесіп бір валентті MgJ радикал - электрон тасымалдаушыны түзеді.
Mg + J 2 → MgJ 2 MgJ + Mg → 2 MgJ
Активатор ретінде сонымен қатар активті алкилгалогенидтерді қолданады, мысалы, этилбромид, бутилбромид.
Қолданылатын реакцияның (1) және Гриньяр реактивінің RMgX формуласымен бейнеленуі практикалық қатынаста қолданыс тапқанымен толық дәлелді емес. Көбінесе (1) теңдеуде көп көңіл бөлінетін магнийорганикалық қосылыстар түзуде қолданылатын эфир тек қана еріткіш ретінде емес, ол сонымен қатар реакцияға қатысады. Магниймен оттекті эфир арасындағы байланыстың түзілуі негізінде Гриньяр реактиві эфир ерітіндісін берік ұстап тұратындығы дәлелденген [8, 16] .
Электртерістілік айырмашылықтарына сәйкес RMgX қосылыстарында С - Mg байланысы күшті поляризацияланған, сондықтан RMgX нуклеофильді реагент болып табылады, яғни оң зарядталған реакциялардың орталығы бар қосылыстарға қарағанда реакциялық қабілеті жоғары. Мұндай реагенттер әр алуан. Сондықтан магнийорганикалық қосылыстар синтезде кең қолдану табады және әр түрлі органикалық кластардың қосылыстарын алуға мүмкіндік туғызады.
RMgX маңызды реакциялары. Магнийорганикалық қосылыстар активті сутек атомы бар (мысалы, су, спирт, қышқыл, ацетилен) заттармен реакцияға түседі. Бұл қосылыстар RMgX қосылысын айырады, көмірсутектер түзеді:
 (3)
(3)
Гриньяр реактивін дайындауда және әрі қарай синтезінде барлық реактивтер және ыдыс құрғақ болуы керек. Олай болмаса реакция шығымының өнімі ғана емес, RMgX түзілуі де төмендейді.
Абсолютті эфирде магнийдің бутилбромидпен реакциясы 5 минуттан соң басталады, ал 1л эфирде 208 немесе 468 мг су болғанда реакция 27 мин немесе 12 сағат кейін, 1л эфирде 520 мг су болғанда реакция мүлдем жүрмейді. (3) реакция теңдеуі көмірсутектер алуда қолданылады. Көбінесе Гриньяр реактивімен күрделі көміртек қаңқасы бар көмірсутектер синтезі жүзеге асырылады, ол RMgX қосылысының қозғалғыш галогені бар заттармен әрекеттесу жолымен жүзеге асырылады:

Магний этилбромидінің ацетиленді қосылыстармен реакциясы келесі түрде жүреді:

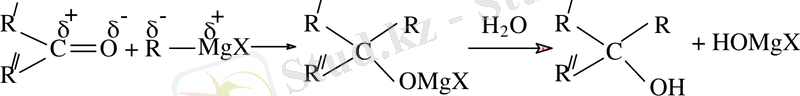 RMgX қосылысының басқа маңызды реакция тобы оның карбонилді қосылыстармен әрекеттесуі жалпы түрде былай көрсетіледі:
RMgX қосылысының басқа маңызды реакция тобы оның карбонилді қосылыстармен әрекеттесуі жалпы түрде былай көрсетіледі:
ІІ. Аминоспирттердің винил эфирлері
2. 1 Жай винил эфирлеріне сипаттама
Егер спирттерді судағы сутегінің алкил радикалының орынбасу өнімі ретінде қарастырсақ, онда екі сутегінің орнын басатын өнімі жай эфирлер болып келеді (ROR) . Олардың сумен әрекеттесуі тепе - теңдікке әкеледі:
ROR + HOH ↔︎ 2 ROH
Ол тепе - теңдік жоғарғы температурада орнайды.
Эфирлер ұшқыш болып келеді; ол спиртпен салыстырғанда суда еруі нашар.
Көршілес С - Н байланысының тұрақтылығының нашарлауы спирт молекуласындағы гидрооксил тобына ( - ОН) байланысты. Жай эфирлер өкілдері ретінде винил эфирлері реагент бойынша 1928 жылы алынды.
Мысалы, винилметил эфирі 1930 жылы диметилацетальдың каталитикалық ыдырау нәтижесінде алынды:
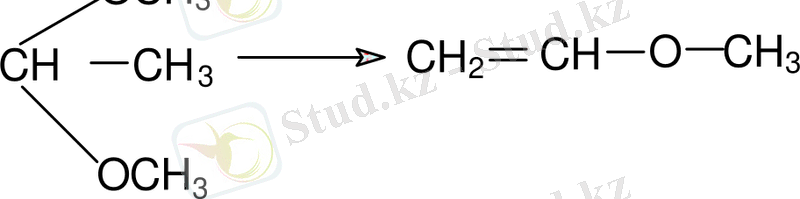
Винилметил эфирі метил спиртінің венилгалогенидімен қатысында әрекеттесуі келесі өнім береді:
CH 2 = CHCl + NaOCl 3 → CH 2 = CH - OCH 3 + NaCl
CH 2 ClCH 2 Cl + NaOH + NaOCH 3 → CH 2 - CH - OCH 3 + 2 NaCl + H 2 O
Винилметил эфирлерінің гомологтары осы жолмекн алынады. Винил эфирлерінің полифункциональды қасиеттерін әр түрлі химиялық қосылыстар алуда ацетальдегид пен диметилацеталь (мысалы, винилметил эфирі), полимер мен сополимерді басқа да көптеген органикалық синтездерде алғашқы қосылыс ретінде қолдануға болады. Винил эфирлерінің активтілігі мен полифункциональдығы оның құрылысымен түсіндіріледі [44] .
Винил эфирлерінің құрылысы мен химиялық өасиеттері.
Винил эфирлерінің жай формуласы ROR.
Винил эфирлерінің құрылысында екі активті орталығы бар: қос байланыс және көміртегі - оттегі байланысы. Винил спиртінен эфирге өтуге таутомерия мүмкін емес, эфир оттегінің оксоний қосылыстарын түзу қабілеті көп артады.
Көптеген жай эфирлер сияқты винилалкил эфирлері эфир оттегіндегі бос жұп электрондарының болуына байланысты негіздік қасиетін көрсетеді, ол сутегінің протон формасы ретінде қосылуын оңайлатады.
Жай винил эфирлері реакциондық қабілеті жоғары болғандықтан әр түрлі синтездерде қолданылады [1, 6] .
2. 2 Винил эфирлерінің химиялық қасиеттері.
Химиялық қасиеттері бойынша жай винил эфирлері көптеген этилен туындыларынан айырмашылығы көп. Басты реакцияланғыш орталығы ретінде қос байланыс және эфирдегі оттегі болып табылады.
Оттегі атомы мен қос байланыстың әсер етуі винил спиртінде айрықша байқалады, онда гидроксильдегі сутегінің үзілуі және оның қос байланыс бойынша қосылуы болады.
Винилалкил эфирлерінің басқа жай эфирлер сияқты негіздік қасиеті бар. Эфир оттегіндегі бос жұп электрондарының болуы сутегінің протон формасы ретінде қосылуын оңайлатады.
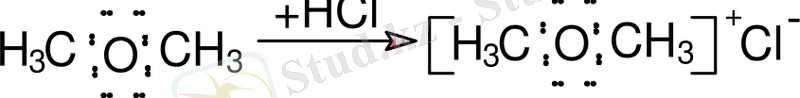 Координационды байланыстың пайда болуы оң зарядталған ионның пайда болуымен түсіндіріледі, пайда болған оксоний ионы хлор ионымен байланысады.
Координационды байланыстың пайда болуы оң зарядталған ионның пайда болуымен түсіндіріледі, пайда болған оксоний ионы хлор ионымен байланысады.
Оксоний қосылыстары органикалық ионогенді қосылыстар болып келеді. Винилалкил эфирлерінің қасиеттері оттегі атомына жақын орналасқан қос байланысқа байланысты. Осы эфирлердің аса күшті байқалатын қасиеттерінің бірі - құрамында қозғалғыш сутегі атомы бар заттармен қосылуы [2, 9] .
Бұл қосылысуы мынадай жағдайда жүреді, сутегі атомы көміртектің β - атомына, ал молекуланың қалған бөлігі жай винил эфиріндегі α - көміртек атомына қосылады:
CH 2 = CH - OR + HX → CH 3 - CHX - OR
Мұнда Х - Hal, - OR, - COOR және т. б.
α, β - қанықпаған жай эфирлері деп аталатын жай винил эфирлері құрамында жай эфирлік емес, карбонильді, карбоксильді және осы сияқты топтары бар α - β - қанықпаған қосылыстардан көп айырмашылығы бар. Мына типтегі қосылыстар СН 2 = CH - COOH, CH 2 = CH - COOR, CH 2 = CH - COH көптеген жағдайда су элементін, галогенсутектік қышқылдарды және басқа қосылыстарды қосып алып β - орынбасатын өнімдерін түзеді.
CH 2 = CH - COOH + HX → CH 2 X - CH 2 - COOH
Жай винил эфирлерінің сипаттамалы химиялық реакцияларына тоқталамыз.
- Гидролиз.
Жай винил эфирлерінің гидролизі ацетальдегид пен спирт түзе жүреді.

- Спирттердің қосылу реакциясы.
Винилалкил эфирлеріне спирттердің қосылуы көп жылу бөле жүреді.

Бұл реакция катализатор қатысында (металл хлоридтері, минерал қышқылдары), сонымен қатар катализатор қатысынсыз қыздыру арқылы нәтижесінде әртүрлі құрылыстағы ацетальдар түзіледі.
- Органикалық қышқылдардың винилалкил радикалдарымен әрекеттесуі ациларейдің түзілуіне әкеледі.
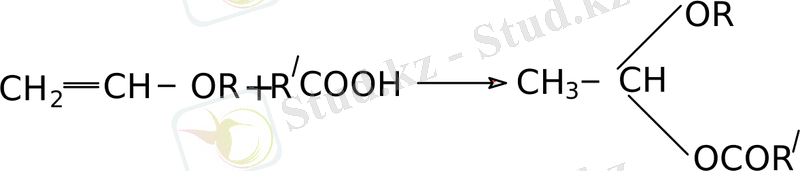
- Галогенсутекті қышқылдардың қосылуы өте көп мөлшерде жылу бөле жүреді, реакция нәтижесінде реакциялық қабілеті жоғары және тұрақсыз α - галоид эфирлері пайда болады.
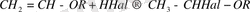
- Галоидтардың қосылуы.
Галоидтардың винилалкил эфирлеріне қосылуы күшті экзотермиялық реакция

Алынған α, β - дигалоидэтилалкил эфирлеріндегі галоидтың α - атомы реакциялық қабілеті өте жоғары.
- Ароматтық қосылыстармен конденсациялау.
Винилбутил эфирін бензолмен конденсациялауда аллюминий хлориді қатысында бөлме температурасында α - фенилэтилбутил эфирі және н - бутилбензол түзіледі.
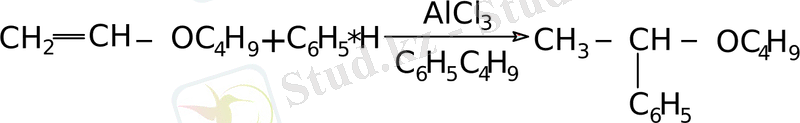
Өте қатаң жағдайда негізгі өнім ретінде - винилалкил эфирі пайда болады.
- Диен көмірсутектерімен конденсациялау.
Бұл реакцияны жүргізу үшін белгілі жағдай қажет: температура 180 - 200°С және қысым 5-7 атмосфера. Винилалкил эфирі циклопентадиенмен әрекеттескенде 2 - алкоокси - бицикл - (2, 2, 1) - гептен - 5 түзіледі.
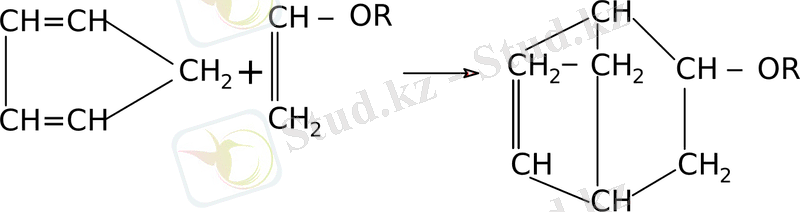
Әр түрлі винил эфирлерінің ациклон мен конденсациялау барысында барлық жағдайда да 1, 4 - дифенил - 2, 3 - (1, 8 - нафталин) - бензол алынды.
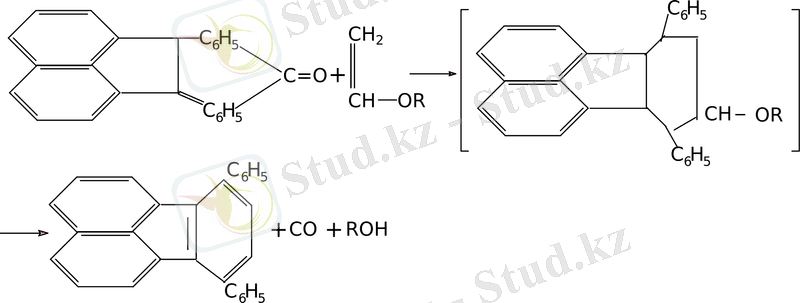
Винил эфирін басқа циклон кластарымен конденсациялау кезінде эндокарбониль көпіршесі мен эфир қалдығының бөлінуі байқалады.
- Полимеризациялану.
Винилалкил эфирінің полимеризациясы қышқыл катализатор қатысында (хлорлы сутек, бромды сутек, галоидтар темір хлориді, алюминий хлориді) жүреді және әртүрлі консистенциядағы (сұйық, майлыдан қатты полимерге дейін) жоғары молекулалық қосылыс түзіледі. Винил эфирлері ауыл шаруашылығында көп қолданылады.
2. 3. Аминоспирттердің винил эфирлері
Аминоспирттердің винил эфирлері азот және құрамында оттек винил туындыларының органикалық синтезінде қолданылатын ерекше орынға ие.
Құрамында амино - және винилокси - топтарының болуына байланысты олар аминдердің, сонымен қатар винил эфирлерінің синтетикалық потенциалын құрайды.
С - О және С - С арасындағы байланыстарға қарағанда С - N арасындағы байланыс энергиясы төмен. Бұл жағдай винил эфирлерін синтездеудің негізгі әдісі - спирттерді ацетиленмен винилдеу, аминоспирттер үшін тиімді еместігін және де аминотоптың элиминирленуіне әкелетінін көрсетеді.
Аминоспирттер винил эфирлерінің синтезінде олардың селективтілігі мен шығымын көтерудегі химиялық айналымдарда алифатикалық аминдер мен жай винил эфирлері үшін қолданылатын әдістерден басқа арнайы әдістер қолдану қажет [39, 42] .
2. 4. Ацетилен негізінде винил эфирлерін алу жолдары
- Аминоспирттердің ацетиленмен әрекеттесуі.
Қазіргі уақытта аминоспирттер винил эфирлерін синтездеудің кең тараған әдісі аминоспирттердің негіздерін катализдеп, оның ацетиленмен қосылуы.



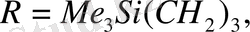
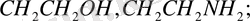
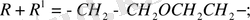
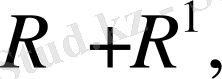

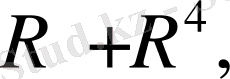
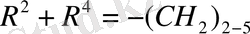
Бұл реакцияны 30 жылдардан бастап - әр түрлі құрылымды аминоспирттердің винил эфирлерін алу үшін қолданған Катализатор ретінде винилденетін аминоспирттердің калийлі немесе натрийлі алкоголяттары, немесе осы металдардың гидроксидтері қолданылды.
Аминоспирттердің орынбасарларының ацетилдермен әрекеттесуі.
Диацетиленді спирттердің аминоспирттермен реакциясы 105 - 110 о С ацетон, калий гидроксиді қатысында жүреді, бұл кезде ацетон спирттен бөлініп, түзілген диацетилендер аминоспирттерді қосып алып, 52% шығымға ие винилацетилен туындыларын береді.
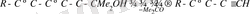
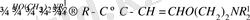
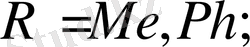

Диацетилен және басқа орынбасылған ацетилендерді қолдану үшіншілік амин тобы бар винил эфирлерінің синтезімен шектеледі, себебі біріншілік және екіншілік амин тобы бар аминоспирттер бұл ацетилдермен қосылып кәдімгі аминдер тәрізді еноламиндер түзеді [28, 36] .
2. 5 Аминоспирттердегі байланыс табиғаты
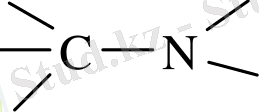
 Азот атомына көміртектердің дара, қос, үш
Азот атомына көміртектердің дара, қос, үш
байланыс түзуінде қолданылатын гибридті орбитальдар бере алатын
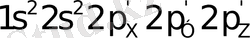 электрондық конфигурация тән. Осы барлық жағдайда орбитальдардың біреуі бос электрон жұбы үшін қолданылады, көміртектің және гибридтенбеген азот атомының р - орбитальдарының қаптасуы нәтижесінде қос және үш байланыс түзілгенде бір және екі π - байланыстар пайда болады. Дара, қос және үш азот - көміртек байланыс энергияларының және олардың орташа ұзындық мәндері 1, 47 А° және 73 ккал/моль; 1, 29 А° және 147 ккал/моль; 1, 16 А° және 213 ккал/моль [28, 33] .
электрондық конфигурация тән. Осы барлық жағдайда орбитальдардың біреуі бос электрон жұбы үшін қолданылады, көміртектің және гибридтенбеген азот атомының р - орбитальдарының қаптасуы нәтижесінде қос және үш байланыс түзілгенде бір және екі π - байланыстар пайда болады. Дара, қос және үш азот - көміртек байланыс энергияларының және олардың орташа ұзындық мәндері 1, 47 А° және 73 ккал/моль; 1, 29 А° және 147 ккал/моль; 1, 16 А° және 213 ккал/моль [28, 33] .
2. 6 Аминоспирттердің винил эфирлерінің қасиеттері
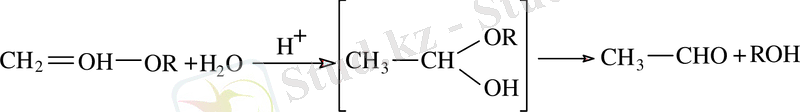 Жай винил эфирлерінің гидролизі ацетальдегид және спирт түзілуіне әкеледі:
Жай винил эфирлерінің гидролизі ацетальдегид және спирт түзілуіне әкеледі:
Органикалық қышқылдардың винилалкил эфирлерімен әрекеттесуі ацетальдарды түзеді:
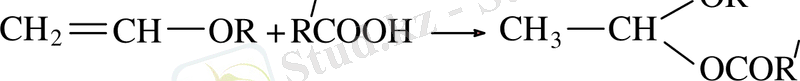
Винилалкил эфирлеріне галоид қосылғанда α, β - дигалоидоэтилалкил эфирлері түзіледі:
СН 2 =СН - OR + Cl 2 → CH 2 Cl - CHCl - OR
β - этаноламин винил эфирі және винилацетат арасындағы реакция суықта жақсы жүреді, бұл кезде N - ацетил - β - этаноламин винил эфирі түзіледі, сонымен қатар су және тұрақты шайырлы өнім түзіледі:
CH 2 =CH-O-CH 2 -CH 2 NH 2 +CH 2 =CHOCOCH 3 →
→CH 3 -COH+CH 2 =CH-O-CH 2 - NHCOCH 3
Винил эфирлері β - этаноламинмен әрекеттесіп аминоацетальдар түзеді:
OR
СН 2 =СН - OR + HOCH 2 - CH 2 - NH 2 →CH 3 - CH
OCH 2 CH 2 NH 2
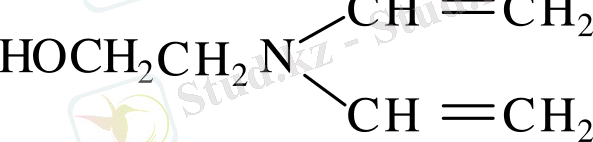
Винилдеу реакциясы. М. Ф. Шостаковский моноэтаноламиннің винилдеу реакциясын терең зерттеді. Себебі моноэтаноламинде винилдеуге қатысты екі активті топ ( - ОН және - NH 2 ) бар, бұл винил (- СН = CH 2 ) радикалын екі топтың біреуімен немесе бір мезгілде екеуімен де байланысуына мүмкіндік туғызады. СН 2 = СН - ОСН 2 - СН 2 - NH 2 негізгі реакция өнімімен қатар төменде көрсетілген екі өнімді бөліп алады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz