Органикалық химия пәні үшін электронды оқулық әзірлеу және инновациялық ақпараттық технологияларды енгізу


Кіріспе
Қазіргі кезде заман ағымына сай ақпараттануы жоғары оқу орындарында жаңа инновациялық технологияның енгізілуіне мүмкіндік береді.
Білім берудегі инновациялық технологияның негізгі бағыты ретінде жаңа ақпараттық технологияның жетілдірілуі және қолданылуы жатады. Жаңа ақпараттық тезнологияның жетілдірілуі оқыту-бақылау бағдарламаларына деген қызығушылықтарына тудырып, оның оқу процесіне кеңінен қолдануына мүмкіндік туғызады.
Органикалық химия - химияның үлкен және жеке бөлігі. Ол көміртегі қосылыстарының химиясын: олардың құрылысын, қасиеттерін, алу жолдарын, іс жүзінде қолдануын қарастырады. Бейорганикалық және органикалық химия арасына нақты шекара қоюға болмайды.
XIX ғасырдың басында органикалық химия жеке ғылым болып бөлініп шықты. Бұған ашылған жаңалықтар және органикалық заттар мен (әсіресе өсімдіктер мен тірі организмнен алынған) жүргізілген зерттеулер әсер етті. XIX ғасырдың бірінші жартысында алғаш рет органикалық заттар синтетикалық жолмен алынды.
Органикалық химия адам өмірі мен оның тұрмыстық іс әрекетінде үлкен роль атқарады. Органикалық заттарды немесе органикалық шикі заттарды өңдейтін өндірістің маңызды салалары: каучук, резина, смола, (шайыр), пластмасса, талшық өнеркәсібі, мұнай химия өндірісі, тамақ, фармацевтика, бояу өндірісі. Біздің ғасырда- синтетикалық жоғарғы молекулалы қосылыстардың - полимерлер өндірісінің маңызы өте жоғары.
Елбасы жолдауы бойынша, біз инновациялық оқу тәжірибемізге енгізіп, ойлау қабілеті дамыған, өз бетінше шешім қабылдай білетін білімді ұрпақты даярлаумыз керек.
Инновациялық оқыту дегеніміз- оқушылардың мүмкіндігі мен шамасына қарай мәселенің байыбына барып, үлгі көрсетер өнегелеріне еліктеп, тағлымдық жолдарын қабылдау, оған сын көзбен қарай отырып, шығармашылық олауға үйрету.
Адамзат қоғамында болып жатқан елеулі өзгерістер жаңа ақпараттық технологияның қолдануымен байланысты кәсіби мамандарды дайындау барысында жаңаша талаптар қояды.
Жоғары оқу орнындағы оқытушылар студенттердің білім негіздерін меңгеру әдістері мен тәсілдерін үйретуді, ұйымдастыруды басты мақсат ретінде қарастырады. Ал компьютер білімді меңгеруді жеңілдететін тиімді құралға айналып отыр. Химия және биология ғылымдары мамандарын дайындауда экспериментальды бөлімімен қатар компьютердің қолдану маңызы зор.
Ақпараттық технологияның бағдарламалық - педагогикалық әдісі мен байланысы қазіргі кезеңдегі бақылау жүйесінің қалыптасуына көмектеседі.
Химиядан білім беру стандарттарының болуы, көптеген бағдарламалар мен оқулықтардың басып шығарылуы химия курсы бойынша оқытуды толығынан жақсарта алмайды. Соған орай қазіргі кезеңдегі ақпараттану заманында білім беруді жүйелеу және таңдау принциптерін анықтау мәселесі туады. Химиялық ақпараттануының үдемелі дамуы және химиялық білім берудегі сағат санының азаюы химиялық пәндердің тіршілікпен байланысын аса күшейту арқылы, инновациялық технология жетістіктерін қолдану арқылы оқу үрдісіне қатысты білім алушылардың активтілігін және өз алдына дайындалу мүмкіндігін арттыруы арқылы осы қарама- қайшылықтарды жоюға мүмкіндік береді.
Осыған, дипломдық жұмыстың мақсаты :
Курстың толық түрдегі теориялық негізі, тест тапсырмалары, есептер мен жаттығулары, зертханалық жұмыстары құрастырылып, жинақталуы.
Жаңа ақпараттық технологиялардың жетілдірілуі оқыту-бақылау бағдарламаларына деген қызығушылықты тудырып, оның оқу процесінде кеңінен қолдануына мүмкіндік туғызады. Осыған орай, аталған курстың толық түрдегі негізінде эдектронды оқулықты құрастыру.
Жаңа технологияны меңгерудің қажетті шарттарының бірі-мұғалімнің кәсіптік білімін жетілдіру болып табылады. Сондықтан, тәжірибелік алаң негізінде аталған дипломдық жұмыстың орындалуы кезеңдерін мектеп оқушылары қатысында жүргізу.
Жұмыстың өзектілігі: Химиялық ақпараттанудың үдемелі дамуы -химиялық пәндердін тіршілікпен байланысын күшейту және инновациялық технологияның жетістіктерін қолдану белсенділігін арттыру болып табылады.
Электронды оқулық - дарынды балаларға арналған мектеп-интернат оқушылардың сабақтарында қолданылып, оқыту іс - әрекетінің жүйелілігін іске асырып, оның орындалу толықтығымен қамтамасыз етіліп, оқу үрдісін бақылау барысында құндылығын байқатты.
Органикалық химия курсы бойынша қазақ бөлімінде оқитын студенттердің мемлекеттік тілде оқулықтардың жетіспеушілік мәселесін шешуге мүмкіндік туғызады.
Осы әдістемелік нұсқау болашақта химия курсы бойынша білім алатын басқа да мамандықтар түрлерінде қолдануға ұсынылады.
1-тарау Органикалық химия пәні
Барлық заттар үлкен екі топқа бөлінеді:органикалық және бейорганикалық. Қазіргі кезде органикалық заттардың 18 миллионнан астам түрлері белгілі. Олардың кейбіреулері табиғатта кездеседі, бірақ көбінесе жасанды-синтездік жолмен алынады. «Органикалық заттар» атауы, олардың тек қана тірі организидерде болатындығын - деген ой ерте кезден қалыптасқан. Бірақ уақыт өткен сайын, органикалық зат ұғымы өзгеріп, оның тірі организмге тікелей қатысы жоқ болуы мүмкін деген тұжырым жасалды.
Органикалық заттар табиғатта көп жерде кездеседі. Олар көбінесе өсімдіктерде, жануарлар организмдерінің негізгі құрам бөліктері болып саналады .
Органикалық қосылыстар құрамында көбінесе тек қана екі химиялық элемент- көміртегі және сутегінен құрылған, орасан заттарды қамтитын көмірсутектер классы. Көмірсутектерден басқа оттек, азот, күкірт және т. б. элемент атомдары бола алады. Барлық көмірсутектердің жалпы формуласы С n Н m түрінде өрнектеуге болады.
Органикалық химия адам өмірі мен оның тұрмыстық іс әрекетінде үлкен роль атқарады. Органикалық заттарды немесе органикалық шикі заттарды өңдейтін өндірістің маңызды салалары: каучук, резина, смола, (шайыр), пластмасса, талшық өнеркәсібі, мұнай химия өндірісі, тамақ, фармацевтика, бояу өндірісі. Біздің ғасырда - синтетикалық жоғарғы молекулалы қосылыстардың - полимерлер өндірісінің маңызы өте жоғары.
1. 1 А. М. Бутлеров ашқан органикалық қосылыстардың химиялық құрылыс теориясы
1861 жылы қыркүйектің 19 Шпейерде Александр Михайлович Бутлеров дәрігерлердің халықаралық съзінде «Химиялық құрылыс теориясы туралы» баяндамасында, органикалық химияның негізгі теориясының қағидаларын жазған .
А. М. Бутлеров жасаған органикалық химия құрылыс теориясының негізгі қағидалары осындай:
1. Молекулада атомдар тәртіпсіз орналаспайды, олар өздерінің валенттілігіне сәйкес өзара бірімен-бірі белгілі ретпен байланысады .
2. Заттардың қасиеттері молекула құрамына қандай элементтің атомдары және қанша мөлшерде кіргеніне ғана байланысты емес, сол сияқты молекуладағы атомдардың байланысу ретіне, олардың бір-біріне өзара әсер ету тәртібіне де байланысты .
3. Молекула түзетін атомдар немесе атомдар тобы өзара біріне-бірі әсер етеді, молекуланың реакциялық қабілеті соған тәуелді болады [1] .
А. М. Бутлеров жасаған теорияларға дейін, ғалымдар атомдар арасында химиялық байланыстың ретін түсінуге болмайды - деген тұжырымды ұсталған. Кейбір ғалымдар болса, ондай құрылысты химиялық әдіспен танып- білу мүмкін емес, тіпті олардың бар екенін мойындамады. Бірақ А. М. Бутлеров оның бәрін теріске шығарды. Оның ойы бойынша, егер химиялық реакцияларды пайдалана отырып, оның ішкі молекулалық құрамын және химиялық эксперименттің нәтижесін танып білу екендігін болады .
А. М. Бутлеров химиялық құрылысты химиялық әдіспен анықтауға және оны тиісті формуламен өрнектеуге болады деп есептеді.
Заттардың құрамын зерттеу негізінде валенттілік ұғымы (1853) енгізіледі де, көміртектің төрт валентті екені дәлелденеді. Химияда әрбір заттың өзіне тән сандық және сапалық құрамы бар екені белгілі. Алайда құрамы бірдей (молекулалық формуласы) бірақ, қасиеттері әр түрлі заттарды Й. Берцилиус изомерлер деп атады. Мысалы: қант тәрізді глюкозаны С 6 Н 12 О 6 және сол сияқты фруктозаны алсақ, олардың формулалары бірдей бірақ фруктоза глюкозаға қарағанда тәттірек және қасиеттерінде де айырмашылықтары бар екені айқындалды .
Изомерлердің болуы органикалық қосылыстардың құрылыс теориясының негізгі қағидаларынан шығады.
Құрылыс теориясы бойынша А. М. Бутлеров бутанның екі изомерінің бар екендігін айтқан болатын (көмірсутектерде, бутаннан бастап, молекулаларда атомдардың қосылу реті әртүрлі болуы мүмкін) . 1867 жылы А. М. Бутлеров өзі айтқан изомерді синтездеді, бұл құрылыс теориясының дұрыс екендігіне дәлел болды. Ол екеуінің эмпирикалық формуласы C 4 H 10 болғанымен, молекула құрылысы бойынша нормаль бутаннан өзгешелігі бар изобутан еді:
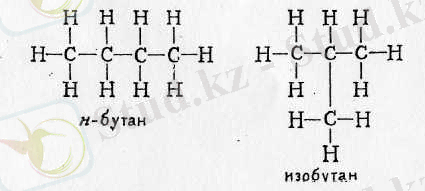
немесе қысқартылған түрде:
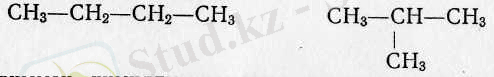
Сонымен, химиялық құрылыс теориясы органикалық қосылыстардың әралуандығын түсіндіреді. Ол төрт валентті көміртегінің көміртегі тізбектерімен сақиналарын түзетіндігіне, басқа элементтердің атомдарымен қосылуына және изомерлерінің болуына байланысты.
Химиялық құрылыс теориясында молекуладағы атомдардың және атомдар тобының өзара әсер етуіне көп көңіл бөлінеді. Бұл кез-келген заттың (органикалық немесе бейорганикалық) молекуласында кездеседі. Оны келесі қосылыстарды: NaOH, А1(ОН) 3 , С 2 Н 5 ОН, NO 2 -OH- азот қышқылы, SO 2 (OH) 2 (күкірт қышқылы) мысал етіп алып түсіндірейік. Олардың барлығының құрамында гидроксиль тобы ОН-(гидроксо-немесе- окситобы) бар. Дегенмен сулы ерітіндіде заттардың қасиеттері келесі ретпен өзгереді: NaOH- күшті негіз, А1(ОН) 3 - амфотерлі гидроксид, С 2 Н 5 ОН - бейтарап зат, азот және күкірт қышқылдары Н + ионын түзеді. ОН - тобының әртүрлі химиялық қасиет көрсетуі онымен байланысқан атомдардың және атомдар тобының әсеріне байланысты болады. Орталық атомның бейметалдық қасиеттерінің артуына байланысты негіздер тәрізді диссоциациялану төмендеп, қышқылдар тәрізді диссоциациялау артады (Na, A1, С 2 Н 5 , N 2 , SO 2 қатарында) .
Өзара тікелей байланыспаған атомдарда біріне-бірі әсер етуі мүмкін. Мысалы, хлорэтан СН 3 -СН 2 -С1 мен хлорэтилендегі СН 2 =СН-С1 хлордың әртүрлі реакциялық қабілеті хлор атомына этиль (СН 3 -СН 2 -) және виниль (СН 2 =СН-) тобының әртүрлі әсер етуіне байланысты. Хлорэтан молекуласындағы хлор өте реакцияшыл, ал хлор этилен молекуласындағы хлор инертті.
Молекуладағы атомдардың өзара әсер ету заңдылығын анықтауда А. М. Бутлеровтың шәкірті В. В. Марковниковтың еңбегі өте зор. Қазіргі қөзқарас бойынша құрылыс теориясының негізгі қағидалары кеңістік және электрондық құрылысты көрсететін толықтырулар қажет өтеді. Онда құрылыс теориясының негізгі қағидаларының 2 пунктінде органикалық қосылыстардың қасиеттері олардың молекулаларының құрамымен сондай-ақ олардың химиялық, кеңістік және электрондық құрылысымен анықталады деп жазу керек.
А. М. Бутлеровтың химиялық құрылыс теориясы химияның теориялық фундаментінің негізгі бөлігі болып саналады. Маңызы бойынша оны Д. И. Менделеев ашқан элементтердін, периодтық системасымен салыстыруға болады. Ол, іс жүзінде, алынған көп материалдарды реттеуге, жаңа заттардың бар екендігі алдын ала болжауға және де оларды, алудың жолдарын көрсетуге көмектесті. Бұл органикалық синтезді химияда бұрын соңды болып көрмеген жетістіктермен қамтамасыз өтті. Қазіргі кезде химиялық құрылыс теориясы органикалық химиядағы барлық зерттеулерде негізгі басшылыққа алынады [2] .
1. 2 Органикалық қосылыстардың гомолог қатары
Кейбір органикалық қосылыстар химиялық қасиеттері ұқсас, бірақ бір-бірінен СН 2 - тобына өзгеріп отыратын заттардың тобын гомологтық қатар деп аталады.
Салыстырмалы молекулалық өсу ретінде қарай орналастырылған гомологтар гомологтық қатар түзеді. СН 2 тобы гомолог айырымы деп аталады.
Гомологтық қатардың барлық мүшелерінің молекула құрамын бір жалпы формуламен өрнектеуге болады. Қарастырылған қаныққан көмірсутектердің гомологтың қатары үшін С п Н 2 п +2 формуласы тән, мұндағы п - көміртегі атомының саны. Ең қарапайым өнімі - метан СН 4 . Оның гомологтары: этан С 2 Н 6 , пропан С 3 Н 8 , бутан С 4 Н 10 , пентан C 5 H 12 , гексан C 6 H 14 , гептан С 7 Н 16 және т. Б. Болып келеді. Басқа гомологтың формуласын алдыңғы көмірсутекке гомолог айырымын қосып алуға болады.
Органикалық қосылыстардың барлық кластары үшін гомологтық қатар құруға болады. Гомологтық қатардағы бір мүшенің қасиеттерін біле отырып сол қатардың өкілдерінің қасиеттері туралы қорытынды жасауға болады. Бұл органикалық химияны оқығанда гомолог түсінігінің қажет екендігін көрсетеді.
1. 3 Органикалық қосылыстардың жіктелуі
Органикалық қосылыстардың барлығын көміртегі қаңқасының табиғатына қарай ациклді және циклді деп бөлуге болады.
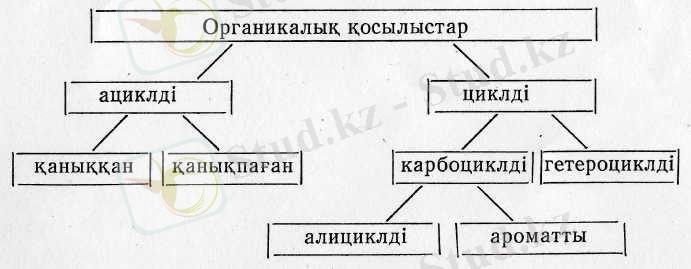
1. 4 Реакциялардың жіктелуі
Органикалық реакцияларды жіктеудің бірнеше жолы бар.
Химиялық айналымдардың сипатына байланысты органикалық реакциялар орынбасу, қосылу, айырылу, қайтатоптасу (изомерлену), тотығу, полимерлену және де т. б. түрлерге бөледі [3] .
Орынбасу реакциялары. Бастапқы молекуладағы атомның (не атомдар тобының) орнын басқа атом (не атомдар тобы) басып, жаңа молекула түзіледі:
СН 4 + Cl 2 →CH 3 Cl+ НCl
Қосылу реакция дегеніміз-екі немесе одан да көп заттардан бір жаңа зат түзіледі. Көміртек қаңқасы бар бастапқы молекулаға басқа атом не атомдар тобы қосылады:
СН 2 = СН 2 + Br 2 →СН 2 Br-СН 2 Br
Айырылу реакциясы дегеніміз- бастапқы органикалық қосылыстан құрылымы қарапайым бірнеше зат түзіледі (бастапқы молекуладан атомдар тобы үзіледі) :
СН 3 -СН 2 Br→ СН 2 = СН 2 +HBr
Изомерлену (қайтатоптасу) реакциялары. Реакциялардың бұл түрлерінде реакцияға түскен заттың молекулалық формуласы өзгермейді, атомдар мен атом топтарының молекула ішіндегі байланысу реті өзгеріп, жаңа зат түзіледі.
Тотығу және тотықсыздану реакциялары. Тотығу реакциясы көміртектің өзінен электртерістігі үлкенірек элементпен (галоген, оттек, т. б. ) жаңа байланыс түзуі арқылы жүреді. Реакция барысында көміртек атомының тотығу дәрежесі өседі. Тотықтырғыштың әсерінен (оның формуласын жазбай-ақ [О] арқылы белгілеуге де болады) реагент оттек қосып алады немесе сутек бөлінеді:
CH 4 +[O] →CH 3 OH
Жану реакциясы тотығу реакциясының жиі үшырасатын түрі. Реакция толық жүрсе, көміртек диоксиді мен су түзіледі:
2С 2 Н 6 + 7O 2 →4СO 2 +6Н 2 O
Тотықсыздану реакциясы барысында көміртек атомының тотығу дәрежесі кеміп, жаңа С-Н байланыстар түзіледі. Тотықсыздандырғыштың әсерінен ([H] деп белгілеуге болады) реагент сутек қосып алады немесе оттектен айырылады.
Гидрлеу реакциясы тотықсыздану реакциясының жиі ұшырасатын түрі. Сутек еселі байланысқа қосылады. Реакция өршіткі (VIII топ металдары: Ni, Pt, Pd) қатысында өтеді:
C 2 H 2 +H 2 →C 2 H 4
Полимерлену реакциялары қосылу реакцияларына жатады. Құрамында еселі байланысы бар қарапайым заттар - мономерлер бір-бірімен қосылып, құрамы күрделі жоғары молекулалы қосылыс - полимер түзеді:
nCH 2 =CH 2 →(-CH 2 -CH 2 -) n [4] .
1. 5 Есептер мен жаттығулар
- Органикалық химия - . . .
- «Органикалық химия» деген атауды ұсынған ғалым . . .
- Органикалық қосылыстардың химиялық құрылыс теориясының негізін қалаған ғалым . . .
- Изомерия дегеніміз- . . . заттар.
- Көмірсутектер - құрамына тек қана . . . элемент кіретін органикалық қосылыстар.
- Құрамында 14 сутегі атомы бар қаныққан көмірсутегінің изомерінің саны.
- Химиялық өзгерістер нәтижесінде түзілетін Х заты:CH4→X→C2H6→CO2.
- Қосылыстардың жалпы формуласы СпН2п+2.
- Органикалық қосылыстардағы көміртек атомының арасындағы химиялық байланысының түрі . . .
- А. М. Бутлеровтың химиялық құрылыс теориясының негізгі қағидалары?
- Химиялық байланыстыі қайсы координациялық (донорлы-акцепторлы) байланыс деп аталады? Льюистің октетті формулаларын қолданып, келесі реакция теңдеулерін аяқта:
1) СН 3 NH 2 +HBr → 4) BF 3 + NH 3 →
2) C 2 H 5 O - C 2 H 5 + HCl→ 5) (CH 3 ) 3 N + O→
3) AlBr 3 + Br 2 →
- Келтірілген қосылыстардың ішінен қайсысы Льюис қышқылы, ал қайсысы негізі
болып табылатынын көрсет.
- Органикалық және бейорганикалық қосылыстардың молекулаларында семиполярлы байланысы бар, мысалдарды келтір. Қандай байланысты семиполярлы деп атайды?
- Сутектік байланыстың анықтамасын құрастыр. Сутектік байланыс құрастыра алатын (молекулаішілік және молекулааралық) қосылыстардың мысалдарын келтір. Қосылыстың қандай физикалық қасиетіне сутектік байланыс әсер етеді?
- Көміртегі атомының электрондық конфигурациясын анықтайтын формулаларын келтір: 1) қозған күйінде; 2) негіздік күйінде; 3) карбкатион (С+) ; 4) карбанион (С-) . Неліктен көміртегі донорлы-акцепторлы механизм бойынша химиялық байланысты құра алмайтындығын түсіндір. Карбкатион және карбаниондағы орбиталь осьтерінің арасындағы бұрыштардың мағынасын түсіндір?
- Орбитальдардың «гибридтенуі» терминін қалай түсінуге болады? σ және π - байланыстардың құрылу барысында орбитальдардың өзгеруі қалай орындалады? σ - байланыстың 6 түрін және π - байланысының 3 түрінің, осы байланыстардың құрастыруына қатысатын атомдық обитальдардың шеткі беттерін қолданып, сызбанұсқаларын көрсет.
- Көміртегі атомының sp3-, sp2-, және sp гибридті орбитальдарының олардың кеңістіктік құрылысын ескере отырып графикалық сызбанұсқасын келтір.
- Атомдық орбитальдардың шеткі беттері туралы түсініктерді қолданып, метан, этан, пропан, изобутан молекулаларының сызбанұсқаларын сал. Бұл молекулаларының шар-стерженьді модельдерін құрастыр.
- Келтірілген қосылыстардың қай орынбасарлары +І және - І эффекті көрсетеді,
1) СН 3 - СН 2 - СНСl - COOH
2) CH 3 - CHCl - CH 2 COOH
3) (CH 3 ) 2 - CHCOOH
4) CH 3 - COOH
5) O 2 NCH 2 - COOH
6) HCOOH
7) CN - CH 2 - COOH
- Қай атомның индуктивті эффекті нөлге тең?
1. 6 Зертханалық жұмыс тақырыбы:Органикалық қосылыстардың сапалық құрамын көміртек пен сутекті анықтау
Жұмыстың мақсаты: Органикалық қосылысының сапалық құрамын анықтау.
Жұмыстың міндеті: Органикалық қосылыстардың құрамында көміртек, сутегі, хлор, күкірт және азотты анықтауды үйрену.
Құрал - жабдықтар мен реактивтер: сахароза, мыс (ІІ) оксиді, мыс (ІІ) сульфаты, ізбес суы, мочевина, металдық натрий, натрий цианиді, 5%- ті темір (ІІ) сульфаты, темір (ІІ) хлориді, тиомочевина, қорғасын ацетаты немесе нитраты, 2% натрий нитропрусиді, натрий гидроксиді, этил спирті, сірке қышқылы, 10% -ті тұз қышқылы, 1% -ті күміс нитраты, мыс сымы, спиртшам, пробиркалар.
Сұрақнама:
1. Органикалық қосылыстардың сапалық құрамын анықтау.
2. Сапалық құрамын анықтау барысындағы реакция теңдеуін жазу.
Тапсырмалар:
1. Көміртектің сапалық реакция теңдеуін жаз.
2. Сутектің сапалық реакция теңдеуін жаз.
3. Күкірттің сапалық реакция теңдеуін жаз.
4. Азоттың сапалық реакция теңдеуін жаз.
5. Хлордың сапалық реакция теңдеуін жаз.
1-тәжірибе. Органикалық заттар олардың құрамындағы негізгі элементтерді анықтау әдістерімен танысу.
Құрғақ пробиркаға 0, 2-0, 3г сахароза, 1-2г мыс (II) оксиді ұнтағын салу керек. Пробиркадағы заттарды араластыру. Пробирканың жоғарғы бөлігіне (тығынғы жақын жерге) аз ғана мақтаны салып, содан кейін аз мөлшерде мыс (II) сульфатын орналастыру. Пробирканы тағын арқылы газ жүретін түтікпен жауып көлденең бағытта штативке бекіту керек.
Газ жүретін түтікшенің бос жағын известь (немесе барий) суы қуйылған пробирқаға батыру керек. Пробирканы біртіндеп қыздыру. Ізбес суының өзгерісі бар ма? Мыс сульфаты түсінің өзгеруі не себепті? Реакция теңдеулерін жазу.
2-тәжірибе. Органикалық заттарда азот, күкірт, галогендерді анықтау.
Органикалық зат құрамындағы азотты натрий арқылы анықтау. Мочевина құрамындағы азотты анықтау (тәжірибе тартпа шкафта жүргізіледі) .
а) Органикалық затты металл натриймен қосып балқыту процесінде ол ыдырайды, нәтижесінде құрамындағы азот - көміртек және натриймен натрий цианидін түзеді:
Органикалық азот қосылысы + Na →NaCl + …
3-тәжірибе. Түзбеген натрий цианидін берлин көгі (берлинская лазурь) қосылысына айналдыру арқылы анықтау.
а) Құрғақ пробирқаға мочевинаның бірнеше кристалдарын және тазартылған кішкене натрий түйіршігін қосып, баяу қыздырады. Қатты қызған пробирканы суық суы бар стаканға батырғанда, пробирка шатынап сынады. Шыны сынығымен қоса суды қайнатады. Сақ болу керек! Қоспада әрекеттіспеген натрий болуы мүмкін. Алынған ерітіндіні суыту қажет. Ертіндінің бір бөлігіне бірнеше тамшы темір (II) сульфатының 5% ерітіндісімен және сонша мөлшерде темір (III) хлориді қосылысын тұз қышқылы көмегімен қышқылдайды. Нәтижесінде көк түсті тұнба (берлин лазурь) түзіледі. Бұл-органикалық заттардың құрамында азотты анықтаудын негізгі әдісі. Тәжірибе сонынан қорытынды жасау және тиісті реакция тендеуін жазу.
4-тәжірибе. Органикалық зат құрамындағы күкірті анықтау.
Органикалық зат құрамындағы күкіртті анықтау жоғарыда көрсетілген азотты анықтау әдісі металл натрий қолдану арқылы реакция нәтижесінде натрий сульфиді түзілуімен түсіндіріледі. Одан әрі сульфид-ионды (S 2- ) сапалық реакциялар көмегімен анықтайды. Бүл тәжірибені жүргізуде қолданылатын реактивтер: тиомочевина, металл натрий, қорғасын ацетаты немесе нитраты ертіндісі, NaOH ерітіндісі, натрий нитропруссиді ерітіндісі (2%) ерітіндісі. 10% HCl ерітіндісі, этил спирті, сірке қышқылы. Натрий сульфиді ерітіндісін пайдаланып тәжірибелерді орындау:
Ерітіндінің бір бөлігіне 0, 5мл 2% қорғасын ацетаты ерітіндісін қосу немесе қорғасын нитраты ерітіндісін және NaOH ерітіндісін қолдануға болады. Ерітінді түсінің өзгеруін және тұнба түзілуін бақылау. Реакция теңдеуін жазу.
Ерітіндінің екінші бөлігіне 0, 5мл 2% натрий нитропруссиді ерітіндісін қосу. Ертіндінің түсі-қызыл-жасыл, бірте-бірте қоңыр түске ауысады.
Реакция теңдеуі: Na 2 [Fe(CN) 5 NO] + Na 2 I → Na 4 [Fe(CN) 5 (NO) I] .
Үшінші пробиркаға 10% сүйытылған түз қышқылын қосады, нәтижесінде күкіртсутек бөлінеді.
5-тәжірибе. Галогендерді анықтау.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz