Химиялық реакция жылдамдығының кинетикасы: температуралық әсер, катализ және есептер


Жоспар
- Кіріспе;
- Негізгі бөлім;
- Химиялық реакция жылдамдығы
- Реакция жылдамдығына температура әсері
- Реакция жылдамдығына катализатор әсері, катализ түрлері
- Химиялық реакция жылдамдығына байланысты есептер
- Қорытынды;
- Қолданылған әдебиеттер.
Кіріспе
Реакция жылдамдығы - гомогенді жүйелер үшін реакция жылдамдығы деп уақыт бірлігінде реагенттер мен өнімдер концентрациясының өзгеруін айтады. Уақыттың бас кезінде реагенттер концентрациясы ең үлкен, ал өнімдер концентрациясы нөлге тең. Реакция жүруі кезінде реагенттер концентрациясы азаяды, ал өнімдер концентрациясы өседі. Катализатор дейтініміз - реакцияның жылдамдығын өзгертіп, бірақ реакция нәтижесінде өздері химиялық өзгермей қалатын заттар. Әрбір реакцияның өзіне лайықты катализаторлары болады, ол катализатор басқа реакцияларға әсер етпеуі мҥмкін. Кей жағдайда әр түрлі катализаторлар қолданып, бір заттан бірнеше өнімдер алуға болады. Реакцияға катализатор қатысқандықтан ондағы актив молекулалар саны артады, содан барып реакциялар жылдамдығы артады. Катализаторлар қатты, сұйық және газ күйінде де болады. Қатты катализаторлардың катализаторлық активтігінен айырылып қалуы оның улануы, мұндай заттар катализатордың уы деп аталады
Химиялық реакция жылдамдығы
Жүйедегі химиялық үдерістерді термодинамикалық тұрғыдан оның дамуын, өзгерісін қарастырғанда уақыт атты фактор ескерілмесе химиялық кинетиканың негізгі міндеті - химиялық реакциялардың жүру механизмі менреакция жылдамдығын зерттеу болып табылады.
Жүйенің басқа бөліктерінен бөліну беті арқылы оқшауланған, оның кез келген нүктесінде материалдық дүниенің физика-химиялық қасиеттері бірдей болатын жүйенің бір бөлігі фаза деп аталады. Фаза санына байланысын реакцияларды гомогенді (бір фазада) және гетерогенді (екі немесе одан да көп фазада) деп бөледі.
Химиялық реакцияларды кинетикалық зерттеу үш түрлі мақсатта жүргізіледі:
1) реакция жылдамдығының концентрацияға тәуелділігін;
2) реакцияның кинетикалық параметрлерін (жылдамдық, жылдамдық константасы, активтендіру энергиясы) ;
3) химиялық реакцияның жүру механизмін анықтау.
Химиялық реакцияның жылдамдығы деп уақыт бірлігінде жүйедегі жүретін реакциялардың элементар актісіндегі зат концентрациясының өзгерісін (гомогенді реакция) айтады.
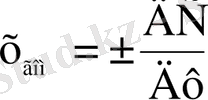 {моль ∙л
-1
∙с
-1
} (6. 1)
{моль ∙л
-1
∙с
-1
} (6. 1)
Ал, гетерогенді реакция үшін - оның элементар актісіндегі фазаның бөліну бетінде концентрацияның уақыт бірлігіндегі өзгерісін айтады.
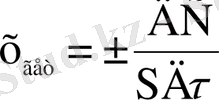 (6. 2)
(6. 2)
Бұл формулалардағы таңбалар реакция жылдамдығын реакция нәтижесінде түзілген зат концентрациясымен есептегенде оң таңбалы, себебі уақыт өткен сайын ол зат концентрациясы артады. Ал реакцияға қатысқан зат концентрациясының өзгерісі бойынша теріс таңбалы болады, себебі реакцияға қатысқан зат концентрациясы уақыт өткен сайын азаяды. Уақыттың өте аз бөлігіндегі концентрация өзгерісін лездік жылдамдық деп атайды, ол суреттегі (6. 1) бұрыштың тангенсімен анықталады. Зат концентрациясының уақытқа байланысты өзгерісін көрсететін графикті кинетикалық қисығы деп атайды.
(6. 2) формуладағы S -меншікті беттік аудан, бұл шама неғұрлым кіші мәнді болса, яғни бөлшек ұсақ болса, реакция жылдамырақ жүреді.
А → В







Сурет 6. 1 Заттар концентрациясының уақытқа тәуелділігі
(1) - С(А) = f (τ) (2) - C(B) = f (τ) .
Реакция жылдамдықтарының мәні әртүрлі болады. Ең баяу жүретін реакцияларға геохимиялық өзгерістер жатады. Олар мыңдаған жылдар бойы жүре береді, ал өте тез жүретіндері - қопарылысты реакциялар, олар көзді ашып жұмғанша-ақ өте шығады.
Реакция жылдамдығы әр түрлі факторларға: зат табиғатына, оның концентрациясына, катализатор (өршіткі) қатысына, температураға; егер әрекеттесетін заттың агрегаттық күйі газ болса - қысымға, ал кристалды зат болса, оның беттік ауданына және т. б. тәуелді(реакция жүретін ыдыс формасына, жарық интенсивтілігіне, әрекеттесуші заттарды араластыру жылдамдығына) .
Реакция жылдамдығына әсер ететін әр факторды сандық жағынан толық бағалау үлкен қиындық тудырады.
Енді осы факторлардың ішіндегі маңыздыларының жылдамдыққа әсерін мысалдар келтіре қарастырайық.
Зат табиғатының әсері бәрімізге белгілі сілтілік металдардың ең химиялық белсенді металдардың бірі (Na) және сілтілік-жер металының (Са), сумен әрекеттесуін қарастырып, жылдамдықтарын салыстыратын болсақ, әрине υ 1 > υ 2 болады.
2Na + 2HOH = 2NaOH + H 2 (υ 1 )
Ca + 2HOH = Ca(OH) 2 + H 2 (υ 2 )
Реакция жылдамдығына температура әсері
Атом-молекулалық ілім тұрғысынан температура артқан сайын молекулалардың қозғалыс жылдамдығы артып, олардың бір-бірімен соқтығысу дәрежесі артатыны түсінікті. Ал, осының заңдылығы Вант-Гофф ережесімен анықталады.
Температураны әрбір 10 о С-қа арттырған сайын реакция жылдамдығы 2-4 есе артады.
Бұл ереженің математикалық өрнегі:
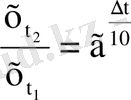 (6. 4)
(6. 4)
мұндағы
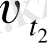 ,
,
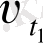 - әр түрлі температурадағы реакция жылдамдығы,
- әр түрлі температурадағы реакция жылдамдығы,
t 2 >t 1 , γ - температуралық коэффициент, оның мәні 2-4 аралығында болады.
Молекулалардың кез келген соқтығысуы реакцияға әкеліп жеткізбейді, тек химиялық белсенді молекулалар соқтығысы реакцияның жүруіне себепші болады, олай болса, молекулалар өзара әрекеттесуі үшін олардың белгілі бір энергия қоры болуы қажет.
Жылдамдық константалары белгілі болса, температуралық коэффициенті мына формула бойынша есептеуге болады:
= Ig γ(6. 5)
Химиялық әсерлесу актін жүзеге асыруға қажетті минимальды энергия қорын активтендіру энергиясы (Е а ) деп атайды, ол әрекеттесетін зат табиғатына байланысты болады. Активтендіру энергиясы неғұрлым үлкен болса, реакция жылдамдығы аз және керісінше Е акт мәні кіші болса, реакция жылдамдығы жоғары болады.
Температура артқан сайын химиялық белсенді молекулалар саны артады. Осындай молекулалар соқтығысы жалпы соқтығысатын молекулалар санына тәуелді. Жылдамдық константасы мен активтендіру энергиясының байланысын Аррениус формуласы береді:
K = A· e -EA/RT (6. 6)
Мұнда, А - тұрақты шама, температураға байланыссыз.
Егер логарифмдесек:
IgK = lgA - (6. 7)
Сонда (6. 7) теңдеуі y = ax+b түзуінің теңдеуіндей болады. Осыдан lgK - 1/T арасындағы байланыс графигін құрып, активтендіру энергиясының сандық мәнін анықтауға болады.
Жылдамдық константасы екі температурада берілсе:
Екі теңдікті бірінен екіншісін алсақ:
lg K
lgA α
1/T•10 3
α
1/T•10 3
lg K
lg A
а ә
Сурет 6. 2Реакцияның активтендіру энергиясын анықтауға арналған
lnA - 1/T арасындағы байланыс. а - эндотермиялық үдеріс, ә - экзотермиялық үдеріс.
Реакцияның активтендіру энергиясының сандық мәнін есептеп те шығаруға болады. Ол үшін мына формуланы пайдаланамыз:
(6. 9)
Активтендіру энергиясы химиялық реакциялар үшін 40-400 кДж/моль аралығында болады.
Сонда, реакцияның жүру барысының энергетикалық өзгерістерін сызбанұсқамен беруге болады; оны реакцияның энергетикалық диаграммасы деп атайды: реакцияға қатысатын зат → химиялық белсенді кешен → реакция өнімі.
Химиялық белсенді кешен
Химиялық белсенді кешен
E
E
E A
Реакция өнімі
Бастапқы
заттарΔH>0
E A
Бастапқы
заттар
ΔH U С
Реакция өнімі
ΔH<0
U D
U A U B
a) реакция координатасы ә) реакция координатасы
Сурет 6. 3 Реакциялардың (A→B - Q, ΔH>0 (a) C → D+Q, ΔH<0 (ә) энергетикалық диаграммалары
А - диаграммасы U(А) >U(В) болатындығын және а-реакциясының эндотермиялық, ә-реакциясында U(C) >U(В), олай болса ол - экзотермиялық екендігін көрсетеді.
Реакция жылдамдығына катализатор әсері, катализ түрлері
Катализатор деп реакция нәтижесінде жұмсалмайтын, бірақ реакция жылдамдығына әсер ететін затты айтады.
Катализатор қатысында жүретін химиялық үдерістерді катализ дейді.
Катализдің бірнеше түрі бар:
а) оң және теріс катализ,
ә) гетерогенді және гомогенді катализ,
б) автокатализ,
в) биокатализ.
Енді, осылардың әрқайсысына жеке тоқталайық. Оң катализ кезінде катализатор реакция жылдамдығын арттырса, теріс катализде - кемітеді. Теріс катализде қолданылатын катализаторды ингибитор деп атайды.
Енді неліктен жылдамдық осындай өзгеріске ұшырайтындығын түсіну үшін шартты түрде алынған бір реакцияның энергетикалық диаграммасын қарастырайық.
а)
ә)

Сурет 6. 4 А → В, (а) С→ Д (ә) реакцияларына катализатор әсері
а) оң катализ; ә) теріс катализ.
Теріс катализ
кезінде реакцияның активтену энергиясының шамасы артады:
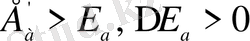 , ал
оң катализ
кезінде активтендіру энергиясының шамасы кемиді:
, ал
оң катализ
кезінде активтендіру энергиясының шамасы кемиді:
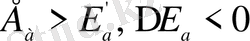 .
.
Сонда, катализатор реакцияның активтендіру энергиясының шамасын өзгертеді. Активтендіру энергиясының шамасы неғұрлым кіші мәнді болса, реакция жылдам жүреді, үлкен мәнді болғанда реакция жылдамдығы баяулайды, өйткені энергетикалық барьер артады.
Гетерогенді және гомогенді катализ реакцияға қатысушы заттармен пайдаланатын заттың агрегаттық күйіне байланысты.
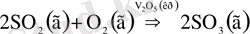
Мысалда V 2 O 5 - кристалды зат, ал әрекеттесуші және түзілген зат - газдар болуына байланысты бұл гетерогенді катализге жатады. Ал, осы реакцияны жылдамдығына әсер ету үшін азоттың (ІІ) оксидін (газ) пайдалансақ - гомогенді катализ болады.
Гомогенді катализдің жүруін аралық химиялық белсенді заттың (кешенді қосылыс) пайда болуы арқылы түсіндіреді.
Катализатор А мен В затымен химиялық белсенді кешенді қосылыс түзеді:
А + Kt → AKt
соңынан осы зат екінші реагентпен әрекеттескенде катализатор босап шығады:

Ал, гетерогенді катализді адсорбциялық теория түсіндіреді. Адсорбция деп фазааралық бөліну бетінде заттың өздігінен шоғырлануы. Біздің республикамызда осы теорияның негізін салушылардың бірі академик Д. В. Сокольский мектебі Отанымыздың екінші астанасы Алматыда катализдер институты жұмыс істейді.
Бұл жағдайда да катализатор бетінің химиялық белсенді нүктелеріне әрекеттесуші зат молекуласы адсорбцияланып, аралық химиялық белсенді қосылыс түзеді, ал келесі сатысында катализатор босап шығады.
Катализатордың химиялық белсенділігі реакциялық жүйеде кездесетін бөтен заттардың қатысына да байланысты. Оның химиялық белсенділігін арттыратын, бірақ өзі катализатор болмайтын заттарды активатор немесе промотор деп атайды. Мысалы аммиак синтезі үшін пайдаланылатын катализаторлар (Fe, Mo, W, Co, Ni) қиын балқитын оксидтер (Al 2 O 3 , Cr 2 O 3 , MgO) қатысында реакция жылдамдығы артады. Катализатордың химиялық белсенділігін кемітетін заттарды катализатор уы деп атайды, олар катализатордың химиялық белсенділігін қайтымды тіпті қайтымсыз да етіп істен шығаруы мүмкін.
Гетерогенді катализдің қалалардағы ауаны автокөліктердің шығаратын улы газдарының мөлшерін азайту үшін маңызы зор. Мұндай катализатордың уы бензин құрамындағы қорғасын антидетонатор ретінде қосылатын затта болады.
Катализатор қайтымды улануы кезінде катализатор арқылы әрекеттесуші заттың жаңа порциясын (бөлімін) өткізсе болады, ал қайтымсыз уланғанда регенерациялап, немесе катализаторды жаңалауға тура келеді.
Автокатализ кезінде реакция кезінде шыққан өнімнің біреуі сол реакцияға катализатор болады.
NH 4 OH + HCl → NH 4 Cl + HOH
NH
3
+ HCl
 NH
4
Cl
NH
4
Cl
Бұл реакцияда су катализатор ролін атқарады.
Биокатализ - жан-жануар және адам организмінде асқазанда жүретін әртүрлі ферменттер қатысында жүретін күрделі реакциялар.
Ал, өсімдіктер дүниесінде олардың жапырақтарында күн сәулесі әсерінен пайда болатын хлорофилл дәндерінің әсерінен жүретін реакцияларды жатқызуға болады. Мысалы, суға ерітілген бір кесек қант бөлме температурасында бірнеше күн тұрса да еш өзгеріссіз қалады. Ал адам ағзасында қант тез тотығып, негізінен көмірқышқыл газы мен суға айналады.
C 2 H 22 O 11(c) + 12O 2(г) → 12CO 2(с) + 11H 2 O (с)
Бұл үдерістің жүруіне ағзада болатын ферменттер деп аталатын ерекше белокты молекулалы өршіткілер әсер етеді.
Химиялық реакция жылдамдығына байланысты есептер
6. 1 Мына реакция теңдеуімен өрнектелетін: А 3 В 2 (с) → 3А(с) + 2В(с) реакцияға алынған А 3 В 2 затының бастапқы концентрациясы 2, 5 моль/л болса, оның 20%-і жұмсалғаннан кейінгі заттар концентрациясын және реакцияның бастапқы және есеп шартында көрсетілген жағдайдағы жылдамдығын есептеңіз.
Берілгені: Шешуі:
1) С о (А 3 В 2 ) = 2, 5 моль/л 2) А 3 В 2 (с) → 3А(с) + 2В(с)
∆С(%) = 20% ν, моль 1 3 2
С(А), С(В) 3) алдымен жұмсалған А 3 В 2 -затының
υ о , υ τ - ? концентрациясын есептейміз.
С τ (А 3 В 2 ) = С о -∆С(А 3 В 2 ),
∆С(А 3 В 2 ) = 2, 5·0, 2 = 0, 5моль/л
С τ (А 3 В 2 ) = 2, 5 - 0, 5 = 2 моль/л.
4) енді реакция нәтижесінде түзілетін А және В заттарының концентрациясын теңдеу бойынша есептейміз.
1 моль А 3 В 2 жұмсалса:3 моль А түзіледі
0, 5 моль А 3 В 2 жұмсалса: Х моль А түзіледі
Х = 1, 5 моль/л
1 моль А 3 В 2 жұмсалса: 2 моль В түзілсе
0, 5 моль А 3 В 2 жұмсалса: Х моль В түзілсе
Х = 1 моль/л
5) енді реакцияның кинетикалық теңдеуін жазып, жылдамдықтарын есептейміз.
υ = К· С(А 3 В 2 ) υ о = К· С(А 3 В 2 )
υ τ = К· С τ (А 3 В 2 ) ; υ о = 2, 5 К; υ τ = 2К
Жауабы: 1, 5; 1 моль, 2, 5 К, 2 К
6. 2 Реакцияның температуралық коэффициенті 3-ке тең бастапқы температура 80 0 С болғанда реакция 5 секундтажүрсе, оның температурасын 40 0 -қа дейін төмендеткенде реакция қанша уақытта жүреді?
Берілгені: Шешуі:
1) γ = 3 2)
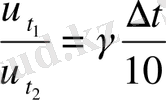
t
1
= 80
0
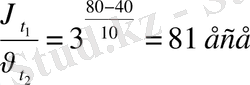
t
2
= 40
0
3)
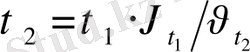
τ 1 = 5 сек τ 2 = 5· 81 = 405 сек = 6мин, 75 сек
τ 2 - ? Жауабы: 6 мин, 75 сек.
6. 3 Мына тепе-теңдікте 2SO 2 + O 2 ↔︎ 2SO 3 заттардың тепе-теңдік орнаған кездегі концентрациялары 5 моль/л болса, тепе-теңдік константасын және күкірттің (ІV) оксиді мен оттегінің бастапқы концентрацияларын есептеңіз.
Берілгені: Шешуі:
1) [SO 2 ] =[O 2 ] =[SO 3 ] =5 моль/л 2) 2SO 2 + O 2 ↔︎ 2SO 3
C б (SO 2 , O 2 ) - ? ν, моль 2 1 2
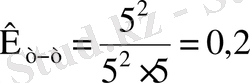 К - ? 3)
К - ? 3)
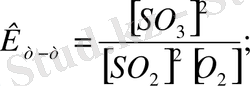
Енді реакцияға қатысқан SO 2 және O 2 заттарының бастапқы концентрациясын SO 3 затының тепе-теңдік орнаған сәттегі концентрациясы бойынша есептейміз, өйткені ол заттың реакцияның басындағы концентрациясы нөлге тең болады.
Реакция теңдеуі бойынша пропорция құрамыз.
4) 2 моль SO 2 жұмсалғанда : 2 моль SO 3 түзіледі = Х моль SO 2 жұмсалғанда : 5моль SO 3 түзіледі.
∆С(SO 2 ) = X = 5 моль SO 2 .
5) С о (SO 2 ) = [SO 2 ] + ∆C; C o (SO 2 ) = 5 + 5 = 10 моль/л
6) 1 моль О 2 : 2 моль SO 3 =Xмоль О 2 : 5 моль SO 3
∆C(O 2 ) = X = 2, 5 моль
7) С о (О 2 ) = [O 2 ] + ∆C(O 2 )
C o (O 2 ) = 5 + 2, 5 = 7, 5 моль/л
Жауабы: 10 моль/л; 7, 5 моль/л; 0, 2.
6. 4 Реакцияның H 2 + J 2 ↔︎ 2HJ белгілі температурадағы тепе-теңдік константасы 30, 5. Көлемі 1 л ыдыста 0, 35 моль иодты сутек болса, тепе-теңдік концентрацияларын есептеңіз.
C(HJ) = 0, 35 моль/л
К т = 30, 5
[H 2 ] , [J 2 ], [HJ] -?
2) H 2 + J 2 = 2HJ
ν, моль 1 1 2
3)
4) ΔC(HJ) = х моль → [HJ] = 0, 35 - х
[H 2 ] = [J 2 ] = 0, 5х
5) Теңдіктің екі жағында квадрат
түбірден шығарсаң
5, 52 =
3, 76х = 0, 35моль; х = 0, 093 моль
6) [HJ] = 0, 35 - 0, 093 = 0, 257 моль/л
[H 2 ] = [J 2 ] = 0, 5 ∙ 0, 093 = 0, 0465 моль/л
7) Жауабы: 0, 0465 моль/л; 0, 257 моль/л
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz