Термодинамиканың бастамалары мен негізгі заңдары: тарихи, теориялық және қолданбалы аспектілер


Термодинамика бастамаларының дүниетанымдық мәні
Термодинамика (грек. θέρμη - "жылу", δύναμις - "күш") - физика ғылымындағы жылудың жұмыс және басқа энергия түрлерімен арадағы қарым-қатынасын зерттейтін тармағы. Термодинамика - тәжірибелерден жинақталған нәтижелерге сүйенетін феноменологиялық ғылым. Ол көптеген құрамдас бөліктерден тұратын макроскопиялық жүйелер - термодинамикалық жүйелерді зерттейді. Мұндай жүйелерде жүретін процестер макроскопиялық шамалар, мысалға қысым немесе температура арқылы сипатталады және олар молекулярлық деңгейде қолдануға келмейді.
Термодинамика заңдылықтары жалпы сипатта қолданылады және заттардың атомдық деңгейдегі құрылымына тәуелді емес. Сондықтан термодинамика ғылым мен техниканың энергетика, қозғалтқыштар, фазалық ауысу, химиялық реакциялар, секілді көптеген салаларында қолданылады. Термодинамиканың физика мен химияның бірқатар салаларында, химиялық технология, аэроғарыштық технология, машина жасау, жасушалық биология, биомедициналық инженерия секілді алуан түрлі салаларда алатын орны ерекше.
Адамдар ертеден суық пен ыстықтың ара-жігін айырып, температураны дененің жылыну дәрежесін сипаттайды деп есептеген. Жылу жайлы ғылымның дамуы температураны өлшеуге арналған құрал - термометрдің пайда болуымен басталады. Ең алғашқы термометрді 16 ғасырдың соңында Галилей жасады деп есептелінеді.
Термодинамика механикалық жұмыс жасауға дененің ішкі энергиясын пайдаланудың негізгі тәсілдерін зерттейтін эмпирикалық ғылым ретінде пайда болды. Алғашқы бу машиналары 18 ғасырдың екінші жартысында ойлап табылды және өнеркәсіптік төңкерістің негізгі алғышарты болды. Ғалымдар мен инженерлер оның тиімділігін арттыру тәсілдерін іздей бастады, 1924 жылы Сади Карно өзінің "Оттың қозғаушы күші және осы күшті дамытатын машиналар жайлы" шығармасында жылу машиналарының пайдалы әрекет коэффицентінің максималды көрсеткішін анықтады. Термодинамика осы шығарманың жазылуынан бастау алды деп есептеледі.
19 ғасырдың 40-жылдарында Майер мен Джоуль механикалық жұмыс пен жылудың арасындағы байланысты сипаттайтын энергияның сақталуы мен табиғаттағы айналымы заңын сандық түрде анықтады. Осы ғасырдың 50-жылдарында Клазиус пен Кельвин сол кезеңге дейін жинақталған деректерді жүйелеп, энтропия мен абсолют температура ұғымдарын енгізді.
19 ғасырдың соңында феноменологиялық термодинамика ғылымы термодинамикалық потенциалдар тəсілін енгізіп, термодинамикалық тепе-теңдіктің шарттарын, фазалардың тепе-теңдігі мен капиллярлық құбылыстарды зерттеген Гиббстың еңбектерінде дамытылды. 1906 жылы Нернст кейінірек "Термодинамиканың үшінші бастамасы" деп аталып, оның аты қойылған теореманы жариялады.
 Термодинамиканың негізгі заңдары нақты түрде көрсетілген алғашқы еңбек 1909 ж. жазылған Каратеодоридің шығармасы еді.
Термодинамиканың негізгі заңдары нақты түрде көрсетілген алғашқы еңбек 1909 ж. жазылған Каратеодоридің шығармасы еді.
Термодинамикалық поршень
Күй теңдеуі - термодинамикалық жүйенің температура, қысым, көлем және химиялық потенциал секілді макроскопиялық шамаларын өзара байланыстыратын теңдеу. Күй теңдеуі термодинамикалық құбылыстар орын алатын жүйелерде ақиқат болады. Алайда, шынайы өмірдегі құбылыстардың күй теңдеулері аса қиын болады.
Жүйенің күй теңдеуі термодинамика постулаттарының ішіне кірмейді және олардың салдары болып табылмайды. Ол өзге қайнарлардан (статистикалық физиканың зерттеулері нәтижесінде алынған тәжірибелерден, модельдерден) алынған болуы керек. Термодинамика, өз кезегінде, заттардың ішкі құрылысына қатысты сұрақтарды қарастырмайды.
Күй теңдеуінде белгіленген қатынастар тек термодинамикалық тепе-теңдік жағдайында ғана ақиқат болады.
Термодинамиканың нөлінші бастамасы - бұл заң бойынша үшінші жүйемен термиялық тепе-теңдікте болатын екі жүйе де өзара тепе-тендікте болуы тиіс.
Термодинамиканың бірінші бастамасы - термодинамикалық жүйелер үшін керек энергияның сақталу заңы; бұл заң бойынша жүйеге берілетін жылу оның ішкі энергиясын өзгертуге және жүйенің сыртқы күштерге қарсы жұмысына жұмсалады.
Дене күйінің барлық энергиясы - микроскопиялық қозғалысының толық түріндегі сыртқы кинетикалық энергиясы Е к және салмақ күші өрісі, электрлі немесе магнит өрісі жағдайындағы потенциалды энергия Е n , сонымен қатар, дене бөлшектерінің құрамдық әрекеттері мен қозғалу энергиясын жасаушы ішкі энергия U қосындыларынан тұрады:
{\displaystyle ~E={E_{k}}+{E_{n}}+{U}}Қаралып отырған жылу динамикалық жүйе шамаланса, онда дененің орталық салмақтық алмасу жылдамдығы өте аз (С=0), яғни қозғалыссыз жұмыстық дене көлемінің өзгеруі туралы сөз болады, сондықтан Е к =0. Айталық, Е р =0 сонымен, бұл жерде толық энергия ішкімен бірдей (E=U), ал жүйе энергиясының өзгеруі - жұмыстық дененің, ішкі энергиясының өзгеруіне келтіреді. Жылу динамикасының бірінші заңына сәйкес, жұмыстық дененің энергиясы кезінде, қабылданған жағдайға тиісті кезіндегі жүйенің өтуі 1 бастапқы күйінен 2 соңғы мәндеріне артуы, денеге берілген жылулық dQ және мәніне келуі dL істелінген жүйе жұмысына тең: dU=dQ-dL немесе әдетте былай жазу қабылданған -
{\displaystyle ~Q=dU+dL}Сыртқы ортамен әрекеттестігі жоқ болғандағы кезінде (dQ=0 және dL=0), формуладағы dU=0, яғни жүйе энергиясы өзгеріссіз сақталады. Жүйелер қатнасының жекеленген жылулығы үшін, ондағы dQ=0 екені белгілі.
Теңдеу жұмыстық дененің еркінше алынған санды массасы m арналып жазылған, ал меншікті мәндері үшін былай жазылады:
мұндағы q - меншікті жылулық саны; l - меншікті жұмыс; u - меншікті ішкі энергия, q, u, l бірлік өлшемі Дж/кг.
Бұл теңдеу үшін, жылудинамикасының бірінші заңының талдаушы тұжырымдалуын көрсетеді, осыған сәйкес жүйеге жеткізілген жылу, жүйелердің ішкі энергиясына жұмсалады және жұмыстың атқарылуына қарсы денеге түскен сыртқы күш. Олар, қайтымдыға да және сыртқы қайтымсыз процесстер үшін де әділетті. Себебі, қабылданған жағдайдағы жылу алмасуы кезінде, дене мен орта арасының соңғы температура айырмашылығы кезінде, қайтымсыз жылуалмасуына сәйкес келеді.
Қоршаған ортаның жұмыс жүйесін қарастыралық, сыртқы күштердің әрекетінен дене көлемінің өзгеруі жүреді. Механиканың жалпы ережесі бойынша, бұл жұмыс денеге түскен күш көбейтіндісімен, оның жылжуын анықтайды. Егер күш, бет ауданының элементіне әрекет етсе, ол элемент, қысым болады, ал осы элементтің ауданының көбейтіндісінің жылжуы, нормалы бағытпен бетке жатып, сол элементтің беттік көлемі болса, онда элементарлы жұмыс, қоршаған орта жүйесімен жасалу кезіндегі, дене көлемінің шексіз аз өзгеруінің көбейтіндісі ретінде анықталады:
V 1 ден V 2 дейінгі көлемнің соңғы өзгеруі кезінде:
{\displaystyle ~dL=pdV}{\displaystyle ~{L_{1-2}}=\int \limits _{V_{2}}^{V_{1}}p\mathrm {d} v. }мұндағы V - көлем, м 3 .
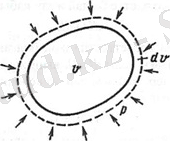
Дене көлемінің өзгеру жұмысы
Газ жағдайының өзгеру процессін зерттеуде, графикалық әдістер (кеңінен пайдаланады) негізінің PV - диаграммасы деп, аталуын кеңінен қолданады.
Дене көлемінің, жұмыстан өзгеруін анықтау жағдайында абцисс өсі бойынша, V шамаларын қояды. Мұндай бейнелерді қолдану, әдетте піспекті қозғалтқыштардың процессін зерттеу кезінде қолданады, мұндағы цилиндр ішіндегі дене көлемінің, піспек жолының жүріп өтуіне, пропорционалды болады.
Энергия -ғылымдағы өте маңызды физикалық түсінік болып табылады. Энергия деп физикада материяның қозғалысының әр түрлі формаларының жалпы шамасын көрсететін скалярлық физикалық өлшемді айтамыз.
Жүйенің энергиясы дегеніміз сол жүйенің белгілі бір жұмыс жасауға қабілеттілігі. Қандай да болмасын термодинамикалық күйде болатын кез келген термодинамикалық жүйенің толық энергиясы болады.
W - толық энергия
Толық энергия мынадай құраушы бөліктерден тұрады:
- Жүйенің механикалық қозғалысынан кинетикалық энергиясынан Wмех
- Сыртқы күш өрісіндегі(гравитациялық, электромагниттік) жүйенің потенциялық энергиясы Wn
- Ішкі энергия U
W = W мех + W n + U
Дененің немесе термодинамикалық жүйенің ішкі энериясы деп оның термодинамикалық күйіне байланысты ғана болатын энергияны айтады. Ішкі энергия жүйені құрайтын барлық бөлімдердің қозғалыс және әрекеттесу энергиясынан тұрады. Мыс, көп атомды молекуладан тұратын газдың ішкі энергиясы мынадай энергия жиынтығынан тұрады:
- Молекуланың жылулық бағытталған және айналмалы қозғалысының кинетикалық энергиясы.
- Молекуладағы атомның тербелмелі қозғалысының кинетикалық және потенциялық энергиясынан
- Молекула аралық әрекеттесулерден туындаған потенциялық энергиядан
- Атом дар мен иондардың, электрон қабықтарының энергиясынан
- Атом ядроларындағы нуклондардың әрекеттесуінің кинетикалық, потенциялық энергиясынан.
1847жылы неміс физигі және физиологы Герман Фон Гельмгольц (1821 - 1894) энергияның сақталу заңын тұжырымдады. Изоляцияланған жүйенің толық энергиясы тұрақты болады, энергия сақталады. Энергия бір формадан екінші формаға мыс, кинетикалық энергиядан потенциялық энерияға, ешқандай шығынсыз ауыса алады.
Жүйенің ішкі энергиясын жұмыс арқылы немесе жылу беру арқылы өсіруге болады. Бөлшектердің қозғалысы дененің температурасымен байланысты болады. Температура жоғары болған сайын бөлшектер жылдам қозғалады. Жүйенің температурасының өсуі жылу берілу деп аталады.
Жылу деп денеге температура айырмашылығы салдарынан берілетін энергияны айтады.
ХІХ ғасырдың 40-жылдарында неміс дәрігері және физигі Юлиус Роберт Майер (1817-1879) жылудың жай ғана энергиясының басқа бір түрі екендігін анықтады.
Жылудың физикалық бірлігі Джоуль болып қабылданған. Ол механикалық энергияның да бірлігі. Демек жылу дегеніміз - механикалық энергия. Осы кезге дейін физиктер жылудың калория деп атаған бірлігін пайдаланып келген.
1Калория 1кг суды1 0 С -қа13., 5- 14, 5 0 С дейін көтерілуге жұмсалатын жылу мөлшері. 1калория 1г суды1 0 С көтерілуге кететін жылу мөлшері.
1Кал = 10 3 кал = 1ккал
Джоуль мен каллорияның арасындағы карым - қатынасы.
1кал =4, 186Дж
1 Кал = 4186кДж
Егер де біз денеге күш түсіріп оны ауыстырсақ онда жұмыс жасалады. Ауыр затты көтеру төмен қарай бағытталған гравитациялық күшті жеңіп, Һ биіктікке жеткізу үшін белгілі бір жұмыс жасалынады. Демек
А = F*S cosa = 1H * м= 1kг*м 2 /c 2 = 1Дж
Жұмыс бірлігі (Дж) - ағылшын ғалымы Джеймс Прескот Джоульдің(1818 - 1889) құрметіне берілген
Қуат деп жұмыстың орындалу және энергияның жұмсалу дәрежесін айтады.
Қуат = Жұмыс /Уақыт Р = А/ t = 1Дж/с = 1Вт
Қуат бірлігі 1Вт бу машинасын ойлап тапқан Шотланд инженері Джеймс Ваттың құрметіне берілген (1736 - 1819)
Термодинамиканың бірінші заңы - энергияның сақталу заңы деп атаса да болады. Бұл заң адамзаттың барлық іс- тәжірибелерінде және табиғаттың барлық құбылыстарында орындалады. Энергия негізінен бір-біріне өтіп тұратын екі формада болады:
1. Жылулық энергиясы.
2. Жұмыс энергиясы.
Сол себептен термодинамиканың бірінші заңы жылулық энергиясымен жұмыс арасындағы қатынастарды анықтайды. Әлбетте бұл қатынас жүйенің ішкі энергиясының немесе жүйенің жалпы энергиясының өзгерісі ∆U процесінде қаралады. Жекешеленген изоляцияланған жүйенің ішкі энергияның тұрақтылығының төмендегі қорытынды келіп шығады.
Жүйенің прцесс кезінде ішкі энергияның өзгеруі осы жүйеге берілген жылулық мөлшерімен осы жүйенің атқарған жұмысы арасындағы айырмашылыққа тең болады, яғни ∆U=Q─W
Бұл жерде ∆U- дененің ішкі энергияның өзгерісі, ал Q- жүйеге беретін жылулық, ал W- жүйенің атқарған жұмысы. Q=∆U+W
Жүйеге берілген жылулық жүйенің ішкі энергиясын өзгертуге жұмыс істеуге жұмсалады. Соңғы теңдеу термодинамиканың бірінші заңының матаматмкалық сипаттамасы саналады.
Термодинамиканың бірінші заңы былайша анықталады:
Жүйеге берілген жылулық, жүйенің ішкі энергиясын асыруға ∆U және сыртқы жұмыстар V- жұмыс орнындауға жұмсалады. Егерде жүйе өзгерісі өте кішкентай болса, бұл теңдецді былайша жазсақ болады:
δQ=dU+δW
δQ - өте аз мөлшердегі жылулық, dU - өте аз мөлшердегі ішкі энергияның өсуі, δW - элементар жұмыс.
Егерде жүйе бір жағдайдан екінші жағдайға өтетін болса, онда жүйенің ішкі энергиясы бір жағдайда өседі, кейбір жағдайда азаяды. Сол себептен ішкі энергия өзгерісі ∆U оң және теріс шамаларға ие болады. Термодинамиканың бірінші заңының бірнеше анықтамалары бар, бірақ олардың барлығы бір түрлі мағынаны сипаттайды.
Физикада қоршаған ортамен жүйе шекарасы арқылы масса және энергия алмасу ерекшеліктеріне байланысты жүйелер 3 түрлі болып жіктеледі:
1. Изоляцияланған жүйелер қоршаған ортамен энергиямен де, массамен де алмаспайтын жүйелер.
2. Жабық жүйелер қоршаған ортамен тек энергиямен алмасып, затпен алмаспайтын жүйелер.
3. Ашық жүйелер қоршаған ортамен энергиямен де, затпен де алмасатын жүйелер.
Егер де дене Q - жылу мөлшерін қабылдаса, онда оның ішкі энергиясы осы мәнге өседі U = Q немесе басқа сөзбен айтқанда дене Q мөлшерде жылу қабылдаса белгілі бір жұмыс А орындай алады. Мыс, газдың көлемі ұлғайып, поршенді көтеруі мүмкін. Жылу қабылдаған дене жұмыс жасаса ішкі энергияның өсуі азырақ болады. Дененің ішкі энергиясының өзгеруі дене қабылдаған энергиямен жасалған жұмыстың айырмасына тең болады:
U = Q - A (1)
Немесе басқаша айтқанда жүйенің сыртқы ортадан алған жылуы оның ішкі энергиясын өсіруге және сыртқы күштерге қарсы жұмыс жасалуына жұмсалады.
Q = U + A (2)
Жұмыс сыртқы қысым күштеріне қарсы жұмыс және максималды пайдалы жұмыстан құралады.
A = *A max + PdV (3)
Мұндағы *A max -максималды пайдалы жұмыс, PdV - сыртқы қысым күш қарсы жұмыс.
Tеңдеу термодинамиканың І-заңы д. а. Мұнда ешқандай жаңа физикалық идея жоқ. Бұл тек энергияның санталу заңының жаңаша, ішкі энергияны ескере отырып, айтылатын түрі. Бұл заң- адамзаттың көп ғасырлық тәжірибесінің жалпы қорытындысы.
Термодинамиканың екінші бастамасы ) - статистикалық нысандардың (мысалы, атом, молекулалардың) үлкен санынан тұратын жүйелердің өз бетінше ықтималдығы аздау күйден ықтималдығы молырақ күйге ауысу процесін сипаттайтын табиғаттың түбегейлі заңы.
Термодинамиканың І заңының негізгі энергия өзгеруімен байланысты жүретін процесстердің қай бағытта және қанша уақыт жүретіндігін анықтау мүмкін емес. Табиғатта жүріп жататын процестермен күнделікті байқайтынымыз олардың көпшілігі өздігінен сыртқы әсерсіз тек белгілі бір бағытта ғана жүреді. Мыс, су биіктеу жерден сайлау жерге ағады. Газдар қысымы жоғары облыстан қысымы төмен облыстарға таралады. Жылу қызған денеден жылуы төмендеу денеге беріледі. Кері бағытта осы аталған процестер өздігінен жүре алмайды, жүргізуге болады, бірақ ол кезде бұл процестер өздігінен жүрмейтін процестер болып табылады. Өздігінен жүретін процестің ерекшелігі олардың қайтымсыздығы. Кез келген өздігінен жүретін процесті пайдалы жұмыс алу үшін пайдаланса болады. Мыс, диірмен, турбина, поршень. Өздігінен жүрмейтін процестер тек жүйеге сырттан энергия енгенде ғана жүре алады. Термодинамикада қайтымсыз процеспен қатар қайтымды процестер де қарастырылады. Қайтымды процестер идеалды жағдайда ғана мүмкін болады. Әртүрлі физикалық және химиялық процестердің қайтымдылығының және қайтымсыздығын және жылудың жұмысқа және керісінше өту мәселесін термодинамиканың ІІ заңы қарастырады.
Бұл заң да тәжірибе жолымен ашылған және оның бірнеше тұжырымдамалары бар:
1. Клаузиус постулаты 1850 ж
Жай қызған денеден қатты қызған денеге жылу түрінде энергияның өздігінен өту процесі мүмкін емес.
2. Томсон тұжырымдамасы 1851ж
Шексіз уақыт бір бастаудан жылу түрінде энергия пайдалана отырып жұмыс жасайтын мәңгілік двигатель, екінші реттік мәңгілік двигатель жасау мүмкін емес.
3. Молекулалық кинетикалық көзқарас тұрғысынан термодинамиканың ІІ заңын былай тұжырымдаса болады:
Табиғаттағы барлық процестер өздігінен ықтималдылығы аз күйден ықтималдылығы жоғары күйге өтуге ұмтылады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz