Газ күйі: заңдар, моль, молярлық масса және молярлық көлем


Жоспар
Кіріспе
Негізгі бөлім
1. Газ заңдары
2. Моль. Газдың молярлық массасы және молярлық көлемі
Қорытынды:
Пайдаланылған әдебиеттер
Кіріспе
Газ (фр. gas , гр. chaos - бей-берекет) - заттың атомдары мен молекулалары бір-бірімен әлсіз байланысқандықтан, кез келген бағытта еркін қозғалатын және өзіне берілген көлемге толық жайылып орналасатын агрегаттық күйі. «Газ» атауын ғылыми қолданысқа 17 ғасырдың басында голланд ғалымы Ян Баптист ван Гельмонтенгізген. Газ молекулаларының соқтығысу уақыты олардың еркін жолға кететін уақытынан әлдеқайда аз болады. Химиялық элементтердің өте кіші бөлшекке бөлініп, бейтарап ұшуы. Негізгі тұрмыстағы газдар пропан, бутан, неон және тағыда басқа Газ қатты дене мен сұйықтық тәрізді еркін бет түзбейді және ол берілген көлемді толық толтырып тұрады. Газ тәрізді күй - заттардың (жұлдызаралық заттар, тұмандықтар, жұлдыздар, планеталардың атмосферасы, тағыда басқа) ғаламдағы ең көп таралған күйі. Химиялық қасиеттері бойынша газдар және олардың қоспалары (активтілігі аз инертті газдар мен қопарылғыш газдар қоспасына дейін) сан алуан болып келеді. Газға атомдар мен молекулалардан тұратын жүйе ғана емес, кейде басқа бөлшектерден - фотондардан, электрондардан, броундық бөлшектерден, сондай-ақ плазмадан тұратын жүйелер де жатқызылады.
Газ күйінің бөлшектері (атомдар, молекулалар, және иондар) электр өрісі жоқ кездегі еркін қозғалысы.
Нақты (реал) газдар. Газдың тығыздығы артқан сайын оның қасиеттері идеал газ күйінен ауытқи бастайды. Бұл жағдайда соқтығысулардың рөлі артып, молекулалардың мөлшерлері мен олардың өзара әсерлерін ескермеуге болмай қалады. Мұндай газды нақты (реал) газ деп атайды.
Газдардың күйін сипаттайтын шамалар: қысым, көлем, температура. Газдарды сипаттағанда көбінесе қысым мен температураны тұрақты етіп алып, көлемнің өзгерістерін қарастырамыз, көлемнің өзгерісі газдар үшін деңгейлес болады, себебі олардың молекулааралық қашықтықтары шамамен бірдей.
Негізгі бөлім
1. Газ заңдары
Газ заңдары бойынша есептеулер Заттың газ күйін зерттеуден табылған бірнеше заңдар бар. Солардың физикада жиі қолданылатындары: Бойль-Мариотт, Гей-Люссак және Авогадро заңдары. Тұрақты температурада алынған газ массасының қысымы көлеміне кері пропорционал болады (Бойль-Мариотт заңы) :
 = немесе
= немесе
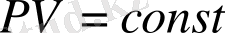
Қысым тұрақты болғанда, алынған газ массасының көлемі абсолюттік температураға тура пропорционал болып өзгереді (Гей-Люссак заңы) :
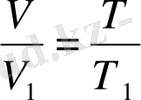
Газдың күйі температура, қысым және кӛлемі бойынша сипатталады. Қысым 1 атм (немесе 760 мм. с. б., 101, 325 кПа), температура
 болғандағы жағдай, қалыпты жағдай деп аталады. Осы жағдайда қысым Р
0
, температура Т
0
және кӛлем V
0
болып белгіленеді. Химиялық есептеулерде, көбінесе, тәжірибе кезінде табылған көлемді қалыпты жағдайдағы көлеммен алмастыруға тура келеді. Бойль-Мариотт және Гей-Люссак заңдарын біріктіретін теңдеу:
болғандағы жағдай, қалыпты жағдай деп аталады. Осы жағдайда қысым Р
0
, температура Т
0
және кӛлем V
0
болып белгіленеді. Химиялық есептеулерде, көбінесе, тәжірибе кезінде табылған көлемді қалыпты жағдайдағы көлеммен алмастыруға тура келеді. Бойль-Мариотт және Гей-Люссак заңдарын біріктіретін теңдеу:
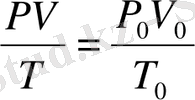
Газдар арасындағы химиялық реакцияларды мұқият зерттеп, Гей- Люссак кӛлем қатынас заңын ашты.
Реакцияласушы газдардың көлемдерінің өзара және реакциядан шығатын газдардың көлемдеріне қатынасы кішкене бүтін сандар қатынасындай болады.
Бұл заңның мәнісін Италия физигі Авагадро түсіндірді.
Бірдей температурада және бірдей қысымда алынған әртүрлі газдардың бірдей көлемдерінде молекулалар саны да бірдей болады. (Авогадро заңы) .
Кез-келген заттың 1 моліндегі молекулалар саны бірдей, яғни 6, 023∙1023 молекула болады (Авогадро саны) . Бұдан газдардың молекуласы бірдей жағдайда бірдей кӛлем алатыны кӛрінеді және тәжірибе жүзінде дәлелденген. Кез-келген газдың бір молекуласы, қалыпты жағдайда 22, 4 л кӛлем алады. Мұны газдардың мольдік кӛлемі деп атайды.
Біркелкі жағдайда өлшенген көлемдері бірдей газдардың массаларының қатынасы, сол газдың біреуінің екіншісімен салыстырмалы тығыздығы деп аталады. Газдардың тығыздығын тәжірибе жүзінде, көбінесе, сутек ( D H ) немесе ауа (D ауа ) бойынша анықтайды.
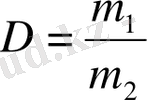
Газдың тығыздығы мен молекулалық массасы арасында тәуелділік бар. Авогадро заңы бойынша бірдей жағдайда, көлемдері бірдей екі газдың молекулалар саны бірдей болатындықтан, олардың массаларының қатынасы, молекулалық массаларының қатынасындай болады:
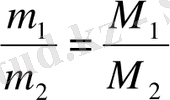
Мұндағы бірінші газдың екіншісі бойынша тығыздығын
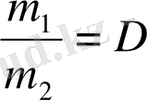 -мен белгілесек,
-мен белгілесек,
 болып шығады. Газ күйін Клапейрон - Менделеев теңдеуімен де кескіндеуге болады:
болып шығады. Газ күйін Клапейрон - Менделеев теңдеуімен де кескіндеуге болады:
PV = nRT.
R − әмбебап газ тұрақтысы. Көлем - л, қысым - атмосферамен алынғанда оның мәні:

көлем -мл, қысым - мм с. б. болып алынса,

қысым - кПа берілетін болса,
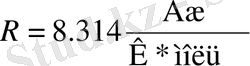 -ға тең.
-ға тең.
Клапейрон - Менделеев теңдеуін пайдаланып газдардың әртүрлі жағдайдағы массасын, қысымын және көлемін есептеп шығаруға болады.
Физика курсынан тығыздық дегеніміз газдың көлем бірлігінің массасы екендігін білесіңдер:
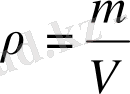 {\displaystyle \rho ={\frac {m}{V}}; } г/л бұдан
{\displaystyle \rho ={\frac {m}{V}}; } г/л бұдан


{\displaystyle \nu ={\frac {m}{M}}}
Біз осыған дейін қарастырған газдардың тығыздықтары бойынша олардың 1 молінің алатын көлемін есептейік:
 , г/л
, г/л
Енді осы газдардың 1 молінің көлемдерін тапсақ:
{\displaystyle V(H_{2}) ={\frac {2}{0, 089}}=22, 47} л;
{\displaystyle V(O_{2}) ={\frac {32}{1, 43}}=22, 37}
л;
{\displaystyle V(N_{2}) ={\frac {28}{1, 25}}=22, 4}
л;
{\displaystyle V(O_{3}) ={\frac {48}{2, 143}}=22, 39}
л;
{\displaystyle V(CO_{2}) ={\frac {44}{1, 964}}=22, 4}
л;
{\displaystyle V_{m}=22, 4} л/моль.
Осы есептеулерден көрініп тұрғандай 1 моль газдың көлемі шамамен бірдей екен, оның сандық мәні 22, 4 л. Мольдік көлем (V m ) t 0 С = 0 0 С, р = 1 атм = 101, 3 кПа жағдайында анықталған, бұл қалыпты жағдай (қ. ж. ) деп аталады.
 =>
=>
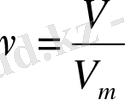 {\displaystyle V_{m}={\frac {V}{\nu }}} {\displaystyle \nu ={\frac {V}{V_{m;
{\displaystyle V_{m}={\frac {V}{\nu }}} {\displaystyle \nu ={\frac {V}{V_{m;
 ендеше {\displaystyle \nu ={\frac {m}{M}}={\frac {N}{N_{A}}}={\frac {V}{V_{m
ендеше {\displaystyle \nu ={\frac {m}{M}}={\frac {N}{N_{A}}}={\frac {V}{V_{m

Бірдей жағдайда алынған газдардың тең көлемдерінде молекула сандары бірдей болады. Бұл - Авогадро заңы. Ол 1811 жылы ашылған.
Химияда тығыздықтан басқа
салыстырмалы тығыздық
деген түсінік те пайдаланылады.
Бірдей жағдайда тең көлемде алынған ғаздардың массаларының қатынасын салыстырмалы тығыздық деп атайды.
{\displaystyle D={\frac {m(1) }{m(2) }}={\frac {M(1) }{M(2) }}}
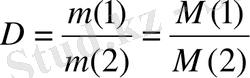
Бір газдың екінші газбен салыстырғандағы тығыздығы олардың молярлық массаларының қатынасындай болады. Салыстырмалы тығыздық сутегі мен ауа бойынша беріледі.
Сонда

{\displaystyle D_{H_{2}}={\frac {M(x) }{M(H_{2}) }}}
{\displaystyle D_{aya}={\frac {M(x) }{aya}}}
М(Н 2 ) = 2 г/моль;
М(ауа) = 29 г/моль
М{х) = 2D(H 2 ) ; М(х) = 29D(aya), мұндағы х - белгісіз газдың мольдік массасы.
Қалыпты жағдайдағы газдың тығыздығы мына формуламен анықталады:
{\displaystyle \rho ={\frac {M}{V_{m(г/
2. Моль. Газдың молярлық массасы және молярлық көлемі
Химиялық есептеулерде масса, көлеммен қатар зат мөлшері қолданылады. Заттар молекулалардан, атомдардан немесе иондардан тұрады. Заттағы құрылымдық бөлшектердің мөлшерін моль арқылы анықтайды. Зат мөлшерінің өлшем бірлігі - моль болып табылады. Моль дегеніміз массасы 12-ге тең көміртегі атомының 0, 012 кг қанша атомдар болса, құрамында сонша құрылымдық бөлшектер - молекулалар, атомдар немесе иондар болатын зат мөлшері.
Моль дегеніміз құрамындағы құрылымдық бірліктердің саны үлкен нақтылықпен анықталған: Практикалық есептеулерде оны 6, 02 ∙10 23 Авагадро саны деп атайды.
Молярлық масса - заттың формулалық бірлігі молінің массасы. Ол заттың массасы мен мөлшері арқылы есептеледі: М = m / n
Молярлық масса г/мольмен өлшенеді. Кез - келген заттың бір молінде құрылымдық бірлігі бірдей саны болса, онда молярлық масса заттың салыстырмалы молекулалық (немесе атомдық) массасына пропорционал:
M=K/Mr
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz