Сутектік және металдық байланыс, кристалдық құрылымдар және катализаторлар


Сутектік байланыс. Металдық байланыс. Кристалдар, қатты денелер
Катализаторлар.
Металдық байланыс
Металдардың көбісінің атомдарының сыртқы энергетикалық деңгейінде электрондардың саны аздау болады. 16 элементте бір-бірден электрон, 58 элементте - екіден, 4 элементте - үштен электрон бар, тек қана Рd-де бірде-бір электрон болмайды. Іе, Ln және Рb элементтердің атомдарының сыртқы деңгейінде 4 электроннан бар, Sb мен Ві 5 және Рb-6 электрон бар. Бірақ та бұл элементтер айқын металдарға жатпайды.
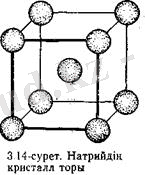
Металл элементтер жай заттарды - металдарды түзеді. Кәдімгі жағдайда бұл кристалл заттар (сынаптан басқасы) . 3. 14-суретте натрийдің кристалл торының схемасы келтірілген. Бұдан натрийдің әрбір атомы іргелес сегіз атоммен қоршалғаны көрініп тұр. Натрий мысалында металдардағы химиялық байланыстың табиғатын қарастырамыз.
Басқа металдар тәрізді натрий атомында артық валентті орбиталдар бар және электрондар жетіспейді. Мысалы, валентті электрон (З¾ 1 ) 9 бос орбиталдың біреуінен орын алуы мүмкін З¾ (біреу), Зр (үш) және Зd (бес) . Кристалл торының түзілуі нәтижесінде атомдар жақындасып көршілес атомдардың валентті орбиталдарымен қаптасады, осының арқасында электрондар бір орбиталдан екінші орбиталға еркін өтіп металл кристалындағы барлық атомдар аралығында байланыс туғызады.
Химиялық байланыстың мұндай типін металдық байланыс деп атайды.
Металдық байланысты сыртқы энергиялары бір-біріне жуық орбитал-дарының жалпы санына қарағанда сыртқы деңгейінде валентті электрон
 дары аз элементтер түзеді, ал иондану знергиясы аздау болғандықтан атомдағы валентті электрондар әлсіз ұсталып тұрады. Металл кристалдарындағы химиялық байланыс күшті деколалденген, яғни байланыс түзетін электрондар ортақтасқан («электрон газы») және жалпы электронейтрал металл кесегінің барлық өне бойында қозғалады.
дары аз элементтер түзеді, ал иондану знергиясы аздау болғандықтан атомдағы валентті электрондар әлсіз ұсталып тұрады. Металл кристалдарындағы химиялық байланыс күшті деколалденген, яғни байланыс түзетін электрондар ортақтасқан («электрон газы») және жалпы электронейтрал металл кесегінің барлық өне бойында қозғалады.
Металдық байланыс қатты және сұйық күйдегі металдарға тән. Бұл өзара біріне-бірі жуық орналасқан атом агрегаттарының қасиеті. Алайда бу күйіндегі металдардың атомдары басқа барлық заттардағыдай, өзара коваленттік байланыспен байланысқан. Металл буы жеке молекулалардан (бір атомды және екі атомды) тұрады. Байланыстың беріктігі металл молекуласына қарағанда кристалда жоғарылау, сондықтан металл крис-талының түзілу процесі энергия бөле жүреді.
Металдық байланыстың коваленттік байланыспен кейбір үқсастығы бар, себебі оның негізі - валентті электрондардың ортақтасуы. Алайда коваленттік байланысты түзетін электрондар қосылған атомдарға жуық орналасады және олармен берік байланысады. Металдық байланысты түзетін электрондар бүкіл кристалдың өне бойында еркін қозғалады, сондықтан оның барлық атомдарына қатысты болады. Осының нәтижесінде кова-ленттік байланысы бар кристалдар сынғыш, ал металдық - серпімді болады, яғни олар соғылғанда пішінін өзгертеді, жұқа беттерге жаншылады және сымға созылады.
Металдардың физикалық қасиеттері металдық байланыспен түсіндіріледі.
Қатты денелердегі кристалдық байланыс
ҚАТТЫ ДЕНЕ - заттың агрегаттық күйі; пішінінің орнықтылығымен және атомдарының жылулық қозғалыс әсерінен тепе-теңдік қалпының маңында мардымсыз аз тербелістер жасайтындығымен сипатталады. Атомдарының орналасу сипатына қарай Қ. д-лер кристалдар және аморф денелерге бөлінеді. Кристалдар атомдары кеңістікте белгілі бір тәртіппен орналасады. Сондықтан оның қасиеттерінде кеңістіктік периодтылық байқалады. Аморфтық денелерде атомдар бей-берекет орналасқан нүктелердің төңірегінде тербеліп тұрады. Қ. д-лердің орнықты күйі (минималь ішкі энергиясы бар) кристалдық күй болып табылады. Ал аморф денелер, термодинамика тұрғысынан, әрқашан белгілі бір метастабильді күйде (уақытша тепе-тең) тұрады. Ол уақыт өткен сайын кристалдана бастайды. Табиғаттағы барлық заттар (сұйық гелийден басқасы) атмосф. қысым кезінде Т>0 К темп-рада қатаяды. Қ. д-лердің құрылымы қатаю процесінің өту ерекшелігіне, балқыманың құрылымы мен табиғатына байланысты анықталады. Қ. д. қасиеттерінің табиғатын кванттық теория негізінде ғана толық түсінуге болады. Кристалдардың кванттық теориясы аморф денелердің кванттық теориясына қарағанда толығырақ зерттелген. Қ. д. қасиеттерін оның атомдық-молек. құрылысы, атомдық (атомдар, иондар, молекулалар) және субатомдық (электрондар, атомдық ядролар) бөлшектерінің қозғалыс заңдары арқылы түсіндіруге болады. Қ. д-лердің (металдардың, минералдардың, т. б. ) макроскопиялық қасиеттері туралы деректерді жинақтау мен жүйелеу 17 ғ-да басталды. Қ. д-лерге әсер ететін мех. күштерді, жарықты, электр және магнит өрістерін, т. б. сипаттайтын бірнеше эмпирикалық заңдар (Гук заңы (1660), Дюлонг және Пти заңы (1819), Ом заңы (1826), Видеман-Франц заңы (1853), т. б. ) ашылды.
Кристалдар - атомдары мен молекулалары кристалдық тор түзетін қатты денелер. Кристалдар (грекше krystallos, оның алғашқы мағынасы мұз дегенді білдіреді) қатты денелердің тепе-теңдік күйі болып табылады. Белгілі бір термодинамикалық (қысым, температура) жағдайда кристалдық күйде болатын химиялық заттың нақты, тек өзіне тән кристалды атомдық құрылымы болады. Бұл құрылым атомдардың орналасуына байланысты кристалдардың сыртқы симметриясын және олардың анизотропиялық қасиеттерін бейнелейді. Табиғатта және техникада кездесетін қатты материалдардың көпшілігі - поликристалдар. Олар ретсіз орналасқан ұсақ кристалдардан (кристалиттер) құралады. Бұған көптеген минералдар, техникалық металдар мен қорытпалар жатады. Кристалдардың жеке ірі түрі монокристалл деп аталады. Табиғатта салмағы жүздеген килограмға жететін кварц, дала шпаты, флюорит кристалдарымен қатар мөлшері өте ұсақ алмас кристалы да кездеседі. Термодинамикалық тепе-теңдік жағдайда өсірілген кристалдардың пішіні белгілі бір симметриялы, дұрыс көпжақ түрінде болады. Олардың жақтары жазық болып келеді де, қырлары түзу сызық бойымен тұрақты бұрыш жасай қиылысады, яғни кристалдану кезінде кристалдардың жақтары өзіне-өзі параллель жылжиды. Бұл заңдылық геометриялық кристаллографияда бұрыштардың тұрақтылық заңы деп аталады.
Геометриялық кристаллографияның ІІ заңы - бүтін сандар заңы - кристалдық заттардағы микропериодтылықтың макроскопиялық көрінісі болып табылады. Кристалдық тордың кез келген атомдық жазықтығы координаттық осьтер бағытында тор периодының бүтін сандарымен сипатталады. Кристалдың жақтары симметриялы болады, жақтары мен қырлары бір-бірімен симметрия амалдарының нәтижесінде беттесе алады. Әрбір амал симметрия осіне, жазықтығына не центріне байланысты орындалады. Кристалдық көпжақтар да симметрияның белгілі бір элементтерінің жиынтығымен сипатталады. Симметрияның 32 класы (32 нүктелік тобы) бар. Әрбір класс симметрияның белгілі бір элементтерімен сипатталады. Кристалдық тордың ерекшелігіне қарай кристалдың сыртқы пішіні белгілі бір класқа және сингонияға бөлінеді. Температураның не қысымның өзгеруіне байланысты кристалдардың құрылымы да өзгереді. Кейбір кристалды күйлер (фазалар) метастабильді (салыстырмалы тұрақты) күйде болады. Берілген зат құрылымының әр түрлі бірнеше кристалдық фазада болуы полиморфизм (мысалы, ақ және сұр қалайы, алмас және графит, кварцтың түрлері, т. б. ) деп аталады. Қатты кристалдарға қарағанда, сұйық кристалдар мен аморфты денелерде (мысалы, шыны) атомдардың орналасу тәрітібі нашар сақталады. Кристалдардың өсуі кезіндегі тепе-теңдік шарттарының бұзылуы, кристалдану кезінде қоспалардың араласуы тәрізді әр түрлі әсерлердің салдарынан кристалдың идеал құрылымында ауытқулар байқалады. Кристалдық тор атомдарының орнын басатын аз мөлшерде қоспа атомдарын өндіру тәсілі кристалдың қасиеттерін өзгерту үшін техникада кең қолданылады. Мысалы, Al 2 O 3 кристалына 0, 05% хром қосу арқылы кванттық электроникада пайдаланылатын лағыл (рубин) алынады. Кристалдардың бірқатар қасиеттері (жылулық, серпімділік, акустикалық) атомдардың өзара әсеріне байланысты анықталады. Мысалы, графитте атомдар жеке қабаттар түрінде орналасады. Оның көршілес екі қабаты арасындағы қашықтық бір қабаттағы атомдар арасындағы қашықтықтан үлкен болады. Сондықтан деформация кезінде графит жеке қабаттар бойынша біртіндеп ыдырайды. Бұл құбылыс графитті қарындаш ретінде пайдалануға мүмкіндік береді. Кристалдар электроникада, оның ішінде, кванттық электроникада ерекше орын алады. Аса қатты кристалдар (алмас, т. б. ) материалдарды өңдеуде және бұрғылау ісінде пайдаланылады. Лағыл, сапфир, т. б. кристалдар сағат және басқа да дәл өлшеуіш аспаптардың негізгі элементі болып есептеледі. Зергерлік істе қымбат асыл тастар (табиғи және синтетикалық) пайдаланылады. Қазіргі кезде синтетикалық кристалдар кеңінен қолданылуда.
Кристалдық тор - кристалл заттардағы атомдардың, иондардың, молекулалардың белгілі бір ретпен орналасуы. Кристалдық тор бір-біріне тығыз орналасқан параллелепипедтерден немесе кубтардан тұрады. Параллелепипед пенкубтар кристалдық тордың ұяшығы болып табылады. Атомдар, иондар немесе молекулалар төбелері (бұрыштары) кристалдық тордың түйіндері, ал олар арқылы өтетін түзу сызықтары қатарлары деп аталады. Бір қатарда жатпайтын үш түйін арқылы өтетін жазықтықты жазық торап дейді. Элементар ұяшықтың үш бағыттағы сызықтық өлшемдері мен оның жақтарының аралық бұрыштары кристалдық тордың параметрлері болып табылады. Кристалдық тордың өлшемдері, атомдары мен молекулалардың , электронография, нейтронография көмегімен анықталады. Кристалдық тор статистикалық тұрғыдан тұрақсыз болады, атомдар мен иондар өзінің тепе-теңдік қалпынан белгілі бір амплитудада тербеліп тұрады. Температура өскен сайын бұл тербеліс артады, ал балқу температурасына жеткенде, кристалдық тор ыдырап, зат сұйықтыққа айналады.
Кез келген затты қатты күйіне айналдыруға болады. Ал қатты заттар кристалдық торларының болуымен сипатталады. Кристалдық торлар деп - түйіндеріндегі бөлшектер белгілі бір ара қашықтықтан кейін жүйелі қайталанатын ретті құрылымды айтамыз. Егер заттың құрамында құрылыс бірліктері ретсіз орналасса, зат аморфты болады. Кристалдық торлар түйіндеріндегі бөлшектердің табиғатына қарай жіктеледі. Олардың төрт түрі белгілі.
Сутектік байланыс
Сутектік байланыс табиғатта кең таралған және оның көптеген химиялық және биологиялық процестер үшін маңызы зор. Сутектік байланысты тек молекуласындағы сутек атомы күшті электртерістілікті атомдармен (F, O, Cl, N, S, және т. б. ) байланысқан зат қана түзе алады. Сутектік байланыс тек молекулааралық қана (әртүрлі молекулалар арасында) болмай, ол бір молекуланың ішінде де (бір молекула ішіндегі әртүрлі топтар арасында) бола алады. Сутек атомы - ішкі электрондық кауызы жоқ және өте кіші өлшемде болғандыктан, көрші теріс полюстенген атомның электрондық қауызы ішіне еніп кетуге қабілетті. Мысалы. құмырсқа кышқылындағы Н - О байланысты түзуші электрондар, электртерістілеу оттек атомына ығыскан. Сутек атомының ядросында (протонда) электрондық бұлт мүлдем калмайды. Мұндайда осы сутек атомы ядросы мен теріс зарядталған кышкылдың көрші молекуласындағы оттек атомының арасында электростатикалық тартылу туындайды. Бұл сутектік байланыстың пайда болуына әкеледі. Бұл байланыстың түзілуіне сутек атомындағы «жартылай бос» I S - орбиталімен және электртерістілікті атомның бөлінбеген электрон жұбы орбиталінің донорлы - акцепторлық әрекеттесуі белгілі бір дәрежеде үлес қосады. Сутектік байланыстың түзілуін көрнекілеп, оны үш нүкте арқылы белгілей отырып көрсетуге болады. Сутектің байланыстың энергиясы (8-40 кДЖ/моль) мен ұзындығы коваленттік байланыстың энергиясы мен ұзындықтарымен және вандерваальстік күштің арасындағы аралық мәнде болады. Әйтсе де бұл энергия молекулалар арасындағы ассоциация (бірігу) үшін жеткілікті екен. Молекулааралық сутектік байланыстардың түзілуі заттар касиеттерінің өзгеруіне әкеледі (айтарлықтай: тұтқырлықтың, диэлектрлік тұрақтының, балқу және кайнау температураларының өзгеруі, балку және бу түзу жылуының жоғарылауы) . Мысалы: судың, фторсутектің және аммиактың қайнау және балку температуралары апомальды жоғары Көптеген қосылыстарда ковалентті полярлы H - О және Н - N байланыстар болады, сондықтан да сутектік байланыстар тек суда ғана болып коймастан, сан алуан кристалдык заттарда, полимерлерде, белоктарда, тірі организмдерде байқалады.
Сутектік байланыс сутек атомы өте теріс электрлік атоммен, мысалы оттегі, фтор, азот, хлор және т. б. атомдармен байланысқан кезде пайда болады. Осындай атом электрондарды тартып алады да, теріс зарядталады, ал электроны кетіп қалған атом оң зарядталады. Сутектік байланыс зарядтардың электростатикалық тартылуына негізделген.
Мысал ретінде, су молекулалары арасындағы сутектік байланысты алайық (4-сурет) . Судың бір молекуласындағы оттек атомдары мен басқа молекуласындағы сутек атомдары арасында орныққан
 байланысын кішкене диполь ретінде алуға болады (
байланысын кішкене диполь ретінде алуға болады (
 оттегінің заряды, ал
оттегінің заряды, ал
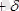 - сутегінің заряды) . Осы зарядтар арасындағы тартылыс сутектік байланыстың пайда болуына алып келеді, ол 4-суретте нүктелермен кескіңделген. Тартылыстың болуына сутегі атомы өлшемінің аздығы себеп болады, ол өзіне теріс электрлік атомның жақындауына жағдай тудырады. . Сонымен қатар, бұл ара қашықтық
- сутегінің заряды) . Осы зарядтар арасындағы тартылыс сутектік байланыстың пайда болуына алып келеді, ол 4-суретте нүктелермен кескіңделген. Тартылыстың болуына сутегі атомы өлшемінің аздығы себеп болады, ол өзіне теріс электрлік атомның жақындауына жағдай тудырады. . Сонымен қатар, бұл ара қашықтық
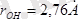 тең, бұл су молекуласының өзіндегі
тең, бұл су молекуласының өзіндегі
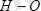 коваленттік байланыс ұзындығы
коваленттік байланыс ұзындығы
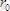 -дан да көп үлкен, ол
-дан да көп үлкен, ол
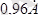 -ге тең. Бұл заңды да, себебі коваленттік байланыс энергиясы сутектік байланыс энергиясынан бірнеше дәрежеге жоғары. Су үшін ол
-ге тең. Бұл заңды да, себебі коваленттік байланыс энергиясы сутектік байланыс энергиясынан бірнеше дәрежеге жоғары. Су үшін ол
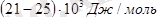 .
.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz