Химиялық термодинамиканың негіздері: термохимия және химиялық кинетика


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТІРЛІГІСЕМЕЙ КАЛАСЫНЫҢ ШӘКАРІМ АТЫНДАҒЫ МЕМЛЕКЕТТІК УНИВЕРСИТЕТІ
Инженерлік-технологиялық факультеті
Техникалық физика және жылу энергетика кафедрасы
ТАҚЫРЫБЫ:
« Химиялық термодинамиканың негіздері »
Тексерген: Шалаганова А. Н
Орындаған: Серікқазы Т. Д.
Тобы: ТЭ-701
Семей 2018
Мазмұны
КІРІСПЕ3
1 ХИМИЯЛЫҚ ТЕРМОДИНАМИКАНЫҢ ДАМУ ТАРИХЫ4
2 ТЕРМОХИМИЯ5
3 ХИМИЯЛЫҚ КИНЕТИКА7
3. 1 Химиялық реакция жыдамдығына әсер ететін факторлар. Вант-Гофф ережесі. Аррениус теңдеуі. Активтену энергиясы. Актвтенген комплекс. 7
ҚОРЫТЫНДЫ10
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР ТІЗІМІ11
КІРІСПЕТермодинамика - энергияның түрленуiне қатысты жалпы заңдарға негiзделген жылулық процесстер туралы ғылым. Бұл заңдар молекулалық құрылымдарына байланыссыз барлық денелер үшiн орындалады.
Термодинамика адамзаттың көп жылғы еңбегінің нәтижесінде пайда болып, тәжірибе жүзінде тағайындалған екі заңынан: термодинамиканың бірінші және екінші заңы (бастамасы, сондай ақ Нернсттің жылулық теоремасына, немесе термодинамиканың үшінші заңынан (бастамасынан), құрылады. Термодинамиканың заңдары макроскопиялық жүйелердің әртүрлі жағдайдағы физикалық қасиеттерінен көптеген мәліметтер алуға мүмкіндік береді. Термодинамиканың бірінші бастамасы энергияның түрлену процестерінің сандық және сапалық жақтарын қарастырады; екінші бастамасы осы процестердің бағытын көрсетеді.
Термодинамика өзара бір-бірімен, сондай-ақ басқа да денелермен әсерлесетін және энергия алмасатын макроскопиялық денелер жиынтығы- термодинамикалық жүйені қарастырады [1] .
1 ХИМИЯЛЫҚ ТЕРМОДИНАМИКАНЫҢ ДАМУ ТАРИХЫXIX ғасырдағы теориялық химияның негізгі жетістіктерінің бірі химиялық реакцияның бағытын көрсететін заңдылықтың анықталуы. Тәжірибелер көрсеткендей, заттар әр түрлі химиялық қасиеттерге ие, бірі басқа заттармен әрекеттеседі, ал екіншлері әрекеттеспейді. Химиялық реакциялар әр түрлі жылдамдықпен, жылу бөлінумен немесе жұтылумен жүреді, қайтымды және қайтымсыз болады және т. б. Көптеген әйгілі ғалымдар осы сұрақтарға көңіл бөлген. Химиялық әрекеттесуді Ле Шателье, Като Максимилиан Гульдберг, Петер Вааге сияқты химиктер зерттеген.
Химиялық термодинамика - физикалық химияның химиядағы термодинамикалық құбылыстарды (химиялық реакция, фазалық ауысулар (еру, булану, кристалдану, т. б. ), сонымен қатар заттардың термодинамикалық қасиеттерінің олардың құрамы мен агрегаттық күйіне тәуелділігін қарастыратын саласы. Химиялық термодинамика термохимия, химиялық тепе-теңдік және ерітінділер (олардың ішінде электролиттер) туралы ілімдермен және электродты потенциалдар, беттік құбылыстар термодинамикаларымен тығыз байланысты. Химиялық термодинамика термодинамиканың жалпы заңдары (нөлінші, бірінші, екінші, үшінші) мен ережелерін пайдаланады.
Химиялық термодинамиканың дамуы бірден екі жолмен жүргізілген:
1. термохимиялық;
2. термодинамикалық.
Термохимияның жеке ғылым ретінде қалыптасуында Петербург университетінің профессоры Герман Иванович Гесстің алатын орны үлкен. Гесс заңының негізі - жылулық эффект пен химиялық реакцияның байланысы [1] .
1867 жылы Марселен Бертло термохимия негізінде химиялық реакцияның бағытын түсіндіретін химиялық туыстықтың алғашқы теориясын ұсынды. Термодинамиканың теориялық химия бөлімі ретінде жалпы жетістіктері энтропия туралы оқуларда көрінді. Ол өз кезегінде химиялық туыстық теорясымен байланысы жоқ зерттеу жүргізудің жаңа түрінің пайда болуына әсер етті. Классикалық химиялық термодинамиканың негізі ДжозайУиллиард Гиббстің «Гетерогенді заттардың тепе-теңдігі туралы» (1878) атты еңбегінде көрініс тапты. Бұл еңбекте заттарды графикалық түрде бейнелеу әдістері, термодинамикалық потенциалдар әдісі және фазалар заңы көрсетілген. Пьер Дюэмом әрі қарай дамытқан Гиббс заңдары термодинамиканың дамуында үлкен серпіліс болды, өйткені бұл әдістер дөңгелек процестерден едәуір тиімді әрі жеңіл болды.
Химиялық термодинамика химияның мына салаларымен тығыз байланысты:
1. аналитикалық химия;
2. электрохимия;
3. коллоидтті химия
4. адсорбция және хроматография [1] .
2 ТЕРМОХИМИЯТермохимия - химиялық динамиканың бөлімі, ол химмиялық реакциялардың жылу эффектісін және реакцияның жүру барысындағы элементтердің физико-химиялық параметрлеріне тәуелділігін қарастырады. Сонымен қатар термохимия мақсатына жылудың фазалық өтулер, ерулер, қосылу, тағы басқа процестер, жылу сыйымдылықты меңгеру және заттардың энтальпиясы мен энтропиясы кіреді. Термохимияның негізгі тәсілі - калориметрия болып табылады. Кей жағдайларда калориметриялық емес те тәсілдер (тепе-теңдік константасын өлшеу нәтижелерінен жылу эффектілерін санау) қолданылады, алайда бұл жағдайларда нәтижелер онша дәл болмайды.
1840 жылы Гесс атты химик тамаша заң ашты, кейіннен осы заңға оның аты беріліп, бұл заң реакцияның жылу эффектісін, заттардың түзілу жылулығын немесе олардың жануын есептеуге мүмкіндік береді. Сонымен қатар тузілуі қиын, ал кейде мүлде мүмкін емес реакцияның жылу эффектісін табуға жол ашты. Есептеуге қажетті стандартты жылу түзілулер ∆Н түз фундаменталды термохимиялық анықтамаларда жиылған.
ХІХ ғасылдың ортасында Томсон және Бертло ой тұжырымдады, олардың айтуы бойынша, энергиясыз болып жатқын химиялық реакциялар максималды жылу бөлінген жаққа ағады. Олармен және олардың шәкірттерімен термохимияның негізгі эксперименталдық тәсілдері жасалды және көптеген реакциялардың жылу эффектілері өлшенді.
Жалпы алғанда Бертло-Томсеннің мәлімдемелері шындыққа сай болмады, бірақ термохимияда белгілі бір шартта химиялық реакциялардың ағу мүмкіндігін зерттеу маңызы сақталды.
Сонымен, термодинамиканың бірінші және екінші бастамасының жалпы теңдеуді жазайық:
Мұндағы: ∆Н - энтальпия өзгеруі, [Дж/кг] ;
∆S -энтропияның өзгеруі, [Дж/кг] ;
Т - температура, [К] ;
R - газ тұрақтысы, [Дж/(кг∙К) ] ;
К р - кез-келген реакцияның тепе-теңдік констартасы.
Энтальпия өзгеруін (жылу эффект) лабораторияда оңай есептеуге болады. Мұны көбіне реакция шекарасын қоршап жасайды: бұл кезде энергия алмасу жүзеге асады. Егер реакция экзотермиялық болса, онда су қызады, ал егер эндотермиялық болса, онда суиды. Егер судың температура өзгеруін өлшесе және су массасы мен оның меншікті жылу сыйымдылығы белгілі болса, бұл жағдайдахимиялық реакция кезінде жұтқан немесе бөліп шығарған энергия мөлшерін табуға болады [2] .
Басқа тәсілдер мен өлшеулерге қарағанда 1 - суретте көрсетілген қондырғы көмегімен ∆Н-тың нақты шамасын алуға болады. Бұл қондырғы - калориметрлік бомба деп аталады және заттардың жану жылуын өлшеуге арналған.
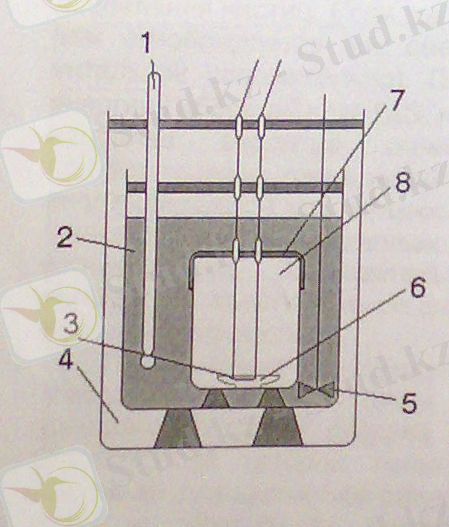
Калориметрлік бомба: 1 - термометр;
2 - су;
3 - үлгіні жағу үшін арналған спираль;
4 - ауа кеңістігі;
5 - араластырғыш;
6 - үлгі салынған ыдыс;
7 - қысымдағы оттегі;
8 - бомба калориметр.
Кейбір реакциялармен ∆Н өлшеуге болады. Мысал ретінде метанның жану реакциясын алуға болады. Бұл реакцияның ∆Н қарапайым асүйлік жабдық пен газ плитасын қолданып табуға болады.
Ал басқа реакцияларға мұны орындау қиынға түседі. Мысалға, СаСО 3 түзілу (еру) реакциясына 800 0 С-дан артық температура қажет. Бұл жағдайда берілген энергияны табу үшін суды қолдану қиынға түседі. бұл жағдайларда энтальпияның өзгеруін табу жанама жүріп, энтальпиялық циклдер қолданылуымен жүзеге асады.
Жоғарыда айтылғандай, калориметрия реакцияның жылу эффектісін анықтауға, соның ішінде ол тұздардың еру жылуын немесе басқа қосылыстардың суда, не басқа еріткіштерде еруін анықтау үшін пайдаланылады. Бұл термохимияның ең қызықты мақсаты болып табылады, өйткені тұз еріген кездегі бөлінген жылу заттарды қыздыру немесе суыту үшін пайдаланылады [2] .
3 ХИМИЯЛЫҚ КИНЕТИКАХимиялық кинетика -химиялық реакцияның жылдамдығы мен механизмі туралы ілім. Хиимиялық кинетика - химиялық технология процестерінің жаңа түрлерін құру мен оларды жетілдірудің ғылыми негіздері. Химиялық кинетика әдістерін биологияда және жаратылыстану ғылымының басқа салаларында қолданады. Химиялық реакцияның молекулалығы- химиялық реакцияның бірлік актісіне қатынасатын молекула сандарымен анықталады. Реакция молекулалығы бойынша мынандай айырмашылықтар байқалады:
1. мономолекулярлы реакциялар-бірлік актіде бір молекула қатысады;
2. бимолекулярлы реакциялар- реакцияның елементарлы актісінде екі молекула қатынасады;
3. үшмолекулярлы реакциялар- элементарлы актісінде үш молекула қатынасады.
Төртмолекулярлы және одан да көп реакциялардың болу мүмкіншілігі нольге тең. Реакцияның реті деп реакцияның жылдамдық теңдеуіндегі концентрацияның стехиометриялық көрсеткішінің қосындысын айтады. Реакцияның реттігі мен молекулалығы тек қарапайым реакцияларға ғана сәйкес келеді. Реакцияның реттігін эксперимент әдісімен анықтайды, ол үшін реакция жылдамдығының концентрацияға тәуелділігін зерттейді. Реакция реті тәжірибе бойынша анықтаған реакцияның реттігін химиялық реакция бойынша табылған шамаға сәйкес келмесе, онда реакция күрделі бірнеше сатымен жүреді деп күмәнсіз айтуға болады.
3. 1 Химиялық реакция жыдамдығына әсер ететін факторлар. Вант-Гофф ережесі. Аррениус теңдеуі. Активтену энергиясы. Актвтенген комплекс.Химиялық реакцияның жылдамдығы әр түрлі болады. Кейбіреулері өте тез, біреулері баяу болады. Оның жылдамдығы басқа процесстердің жылдамдығы сияқты уақытпен өлшенеді. химиялық реакция жылдамдығына : әрекеттесуші заттардың табиғаты, қысым, температура, әрекеттесуші заттардың концентарциясы және катализатор әсер етеді.
Әрекеттесуші заттардың табиғатының әсері. Заттың табиғатының химиялық реакцияның жылдамдығына әсері үлкен. Кейбір реакциялар өте тез, біреулері баяу жүреді. Мысалы:
1. 2Rb+2H 2 O=2RbOH+H 2 (қопарылыс болады) .
2. Ag+H2O=реакция өте баяу жүреді, айлап, жылдап өтеді.
Температураның әсері. Заттардың өзара әрекеттесулері үшін олардың бөлшектері бір- бірімен соқтығысуы қажет. Соның нәтижесінде бөлшектердің электрон бұлттарының тығыздықтары өзгеріп, жаңа химиялық байланыстар түзіледі. Жылдамдықтың тем-ға тәуелділігін Вант- Гоффтың эмпирикалық ережесімен бағалуға облады: «температура әрбір 10ºС-қа артқанда реакцияның жылдамдығы 2-4 есе өседі»
Аррениус теңдеуі. Аррениус көптеген реакцияларда температура жоғарылаған кезде жылдамдықтың артып сызықты болмайтынына назар аударады. Реакция жылдамдығының константасы мына теңдеуге бағынады.
(2) теңдеу Аррениус теңдеуі деп аталады.
Мұндағы: Е акт - активтену энергиясы, [Дж] ;
R- молярлы газ тұрақтысы, [Дж/(кг∙К) ] ;
Т-абсолют температура, [К] ;
А-молекулалар арасындағы бір секунд ішіндегі жалпы соқтығысу саны. Соқтығысу молекулалардың рекацияға қолайлы ориентациялары кезінде молекулалар арасында болады [3] .
Реакция жылдамдығына концентарцияның әсері. Химмиялық реакцияның тез жүруі үшін әрекеттесуші заттардың молекулалары жиі түйісулері қажет екендігі анықталды. Түйісуді жиілендіру үшін алдымен әрекеттесуші молекулалардың санын, демек концентрациясын өсіру керек. Реакцияның жылдамдығына әрекеттесуші заттардың концентарциясының әсерін Норвегия ғалымдары Гульдберг және Вааге 1867 жылы мынадай қорытындыға келді: Химиялық реакцияның жылдамдығы реакцияласушы заттардың концентарцияларының көбейтіндісіне тура пропорционал. Мұны әрекеттесуші массалар заңы деп атайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz