Медицинадағы ферменттер: классификация, изоферменттер және тұқым қуалаушылық энзимопатия


Марат Оспанов атындағы Батыс Қазақстан Мемлекеттик Медицина Университеті.

Студенттің өзіндік жұмысы
Мамандығы : Жалпы медицина
Кафедра :Морфология және физиология
Дисциплина : Биохимия кафедрасы.
Тақырыбы: Медицинадағы ферменттер. Изоферменттер. Тұқым қуалаушылық энзимопатия
Орындаған: Базарбаева А. А
Тобы: 202 «А»
Тексерген: Бесімбаева. Ж. Б
Актобе 2018 ж
ЖОСПАРЫ:
I. КІРІСПЕ.
Ферменттердің атаулары және классификациясы.
II. НЕГІЗГІ БӨЛІМ.
а) Энзимопатия диагностикасы және емдеудің биохимиялық негіздері.
б) Изоферменттер және органоспецификалық ферменттер.
III. ҚОРЫТЫНДЫ.
Ауруларды емдеуде ферменттерді пайдалану .
IV. БАҒАЛАУ КРИТЕРИЙ
ФЕРМЕНТТЕР (ЭНЗИМДЕР)
Ферменттердің жалпы сипаттамасы
Ағза торшаларының тіршілік етуі, қызметі, оларда өтетін химиялық реакция өнімдерінің түзілуі жылдамдығына тәуелді процесс. Реакция жылдамдығы оларға әсер етуші заттар - катализаторларға тығыз байланысты. Катализатор реакцияға қатысып, оның жылдамдығын жоғарылатады және реакция соңында бастапқы қалпына келеді.
Ферменттер торшаларда синтезделіп, биохимиялық реакцияларға қатысатын белоктық табиғаттағы биокатализаторлар.
Энзимология - ферменттерді зерттейтін ғылым саласы. Ол басқа ғылымдар биология, генетика, фармакология, химиямен тығыз байланысты.
Фермент немесе энзим (лат. fermentum - ашу; en - ішінде, zim - ашытқы Ван Гельмонт, 19 ғ. ұсынған) алғашқыда ашыту процестерінде анықталған зат.
Ферменттердің қызметі туралы алғашқы ғылыми еңбекті Кирхгофф (1814) жариялады. Кейін ашу процесі ашытқы торшаларында ғана өтеді деген ұйғарым жасаған Л. Пастерге (1871), Либих ферменттер торшалардың өмір сүруіндегі пайда болған өнім ол торшада да, олардан бөлек те қызмет атқарады деген қарсы пікір білдірді. Либихтің ғылыми көзқарасы М. Манассейна (1871), Бухнер (1897) зерттеулерінде эксперимент жүзінде дәлелденді.
Торшаларда синтезделген ферменттер өзіне тән арнайы қызметте-
рін ағзаның барлық мүшелерінде атқарады. Олардың табиғаты белок екені Зеренсон (1909), И. П. Павлов - пепсинді зерттеуінде, А. М. Данилевский - ферментті (липазаны) талғамды бөліп алуы, Самер (1926) - уреазаны кристалл түрінде алғаш алуы, Нортроп (1930) - пепсин, трипсинді таза күйінде бөліп алуы еңбектері негізінде дәлелденді. Ферменттік қасиет, негізінен, глобулалық құрылымдағы белоктарға тән екені белгілі болды. Бірақ, қазіргі кезде, кейбір құрылымдық белоктар да (фибриллалық белоктар - актин, миозин) каталиттік активтілік көрсететіні байқалған.
Ферменттер белоктарға тән физика-химиялық қасиеттерді байқатады. Сондықтан олар коллоидтық ерітінділер түзеді, молекулалық массасы 1-нан, бірнеше млн далтон аралығында болады, ертінділері амфотерлік электролиттік қасиет көрсетеді. Кристаллдарының құрамында су молекуласы болады, ал толық сусызданған фермент кристаллы каталиттік активтілігін жоғалтатыны байқалған. Кеңістікте ұйымдасқан құрылымдық конформациясы бойынша белоктық глобулалық және фибриллалық формаларды қайталайды. Сонымен бірге, ферменттердің өзіне тән кейбір қасиеттеріне олардың термолабилділігі, әсер ету ерекшелігі, активтілігінің реттелуі жатқызылады.
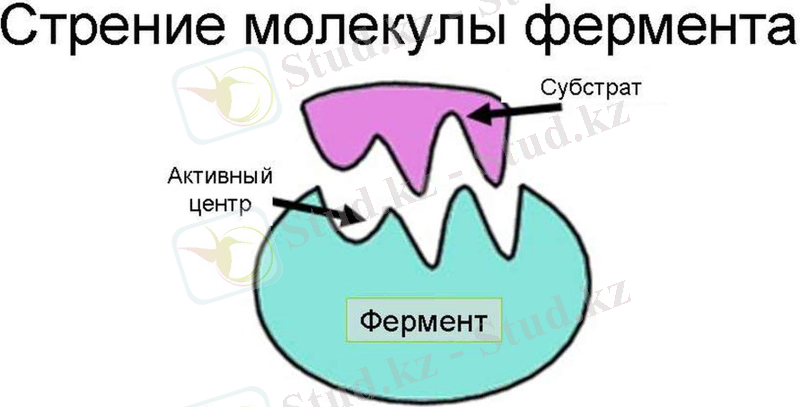
Ферментердің аталуы және жіктелуі.
Қазіргі кезеңде ферменттер атауының төрт түрі қалыптасқандығы айқын байқалады. Оларға тарихи атау, кейін XIX ғ. соңында Дюкло ұсынған - аза жалғауын қосып атау (гидролаза-гидролиз жүргізеді фермент, липаза-майлардың ыдырауын, протеиназа-белоктар ыдырауын жүргізетін ферменттер) негізінде кейінгі атаулары қалыптасты. Тарихи атау - ферменттердің табылған орындарын немесе қызмет атқаратын орындарын ғана байқатады және басқа ешқандай информация бермейді. Мысалы: пепсин, трипсин, химотрипсин, гастриксин және т. б.
Тривиалдық атау - фермент әсер ететін субстрат атына - аза жалғауын қосу арқылы қалыптасады (субстраттық ерекшілікке негізделген) . Мысалы: амилаза, липаза, протеиназа және т. б.
Рационалдық атау - фермент әсер ететін субстрат атына катализделетін реакция типін және - аза жалғауын қосу арқылы қалыптасады. (Субстраттық ерекшелікке, реакция типіне негізделген) . Мысалы: лактатдегидрогеназа, малатдегидрогеназа, және т. б.
Жүйелік атау - фермент әсер ететін субстрат атына акцептор болатын кофермент көрсетіліп катализделетін реакция типімен - аза жалғауы қосылып қалыптасады. Мысалы: L-лактат, НАД-редуктаза және т. б.
Ферменттерді жіктеу олардың катализдейтін реакцияларының типіне негізделіп қалыптасады және жүйелік атаудың негізінде шифрлар мен 6 класқа бөлінеді, ал олар кіші кластарға бөлінеді.
Жүйелік принципі бойынша барлық ферменттер алты классқа жіктеледі:
1) оксиредуктазалар - тотығу-тотықсыздану реакцияларын катализдейтін ферменттер классы;
2) трансферазалар - әртүрлі химиялық топтардың молекулалар арасында тасымалдануын катализдейтін ферменттер;
3) гидролазалар - гидролиттік ыдырау реакцияларын катализдейтін ферменттер классы;
4) лиазалар - субстраттардан қос байланыс түзілдіріп химиялық топтарды бөлінуін (гидролиттік ыдырау жолынан басқа) немесе керісінше қосбайланысты субстратқа белгілі бір топтардың қосылуын катализдейтін ферменттер классы;
5) изомеразалар - органикалық қосылыстардың изомерлеуін катализдейтін ферменттер классы;
6) лигазалар немесе синтетазалар - екі молекула арасындағы синтез реакциясын, АТФ-тағы макроэргиялық байланыстан немесе нуклеозидтрифосфаттан фосфаттық қалдықты бөлу арқылы өтетін, катализдейтін ферменттер классы.
Ферменттер класстарының жалпы сипаттамасы.
Оксиредуктазалар (1 класс)
Бұл классқа дегидрогеназалар, трансгидрогеназалар, гидроксилазалар - барлығы 14 топқа бөлінетін 86 фермент кіреді.
1. 1. 1. Анаэробтық дегидрогеназалар. Сутегі акцепторы ретінде оттегіден басқа кез келген қосылыс реакциясын катализдейді. Лактатдегидрогеназа, алкогольдегидрогеназа және т. б. жатқызылады, кофермент НАД + .
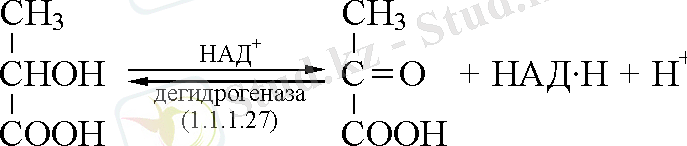
1. 1. 3. Аэробтық дегидрогеназалар. Сутегі акцепторы ретінде оттегі болатын реакцияны катализдейді
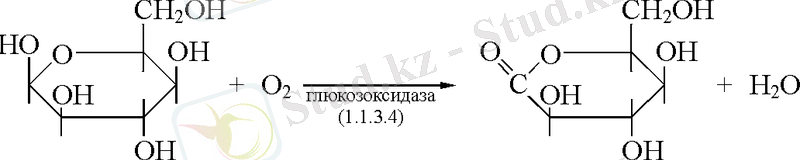
1. 9. 3. 1. Цитохромоксидазалар. Электрон тасымалдауын катализдейтін, простетикалық тобы металл иондарынан тұратын ферменттер.
Трансферазалар (2 класс)
Бұл классқа 8 топқа бөлінетін 200-дей фермент кіреді. Жеке топтар, радикалдар мен атомдардың молекулалар мен молекула ішілік тасымалдануын катализдейді.
2. 6. 1. Аминотрансферазалар. NH 2 -тобын α-кетоқышқылға тасымалдайтын фермент (АсАТ, АлАТ) .
2. 6. 2. Амидинотрасферазалар. Амидиндік топты аргининнен басқа аминоқышқылға тасымалдайды.

2. 7. 1. Фосфотрансферазалар. Фосфаттық қалдықты (АТФ, ГТФ және т. б. ) акцепторларға тасымалдау.
2. 7. 1. Метилтрансферазалар. Метил топтарын тасымалдаушы ферменттер.
Гидролазалар (3 класс)
Бұл классқа 9 топтан түратын 169 фермент кіреді. Эстераза, фосфатаза, карбоксиэстераза, сульфоэстераза, глюкозидаза, пептидаза, амидаза, полифосфатаза жатқызылады.
3. 1. 1. Эстеразалар. Спирттермен түзілген күрделі эфирлік байланыстарды ыдырататын ферменттер.
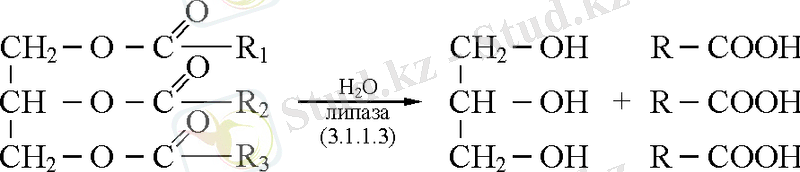
3. 1. 3. Фосфатазалар. Спирт пен фосфор қышқылы арасындағы күрделі эфирлік байланысты ыдырататын фермент (қышқылдық, сілтілік, спецификалық, бейспецификалық) түрлері болады
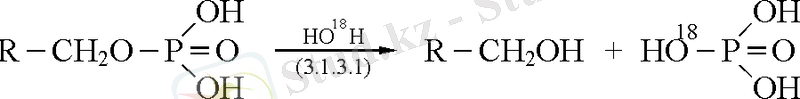
қышқылдық фосфатаза
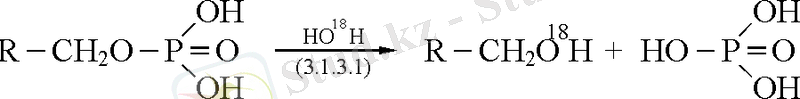
сілтілік фосфатаза
3. 1. 4. Фосфодиэстераза. Фосфор қышқылы мен екі түрлі спирттер арасындағы күрделі эфирлік байланысты ыдырататын ферменттер. Мысалы, ДНҚ, РНҚ, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилинозит.
3. 2. 1. Глюкозидазалар. Көмірсуларды (глюкозид) ыдыратушы фермент.
3. 4. 1. Пептидогидролазалар. Белоктағы пептидтік байланыстардың гидролизін катализдейді. Пепсин (3. 4. 4. 1), трипсин (3. 4. 4. 4) және т. б. жатқызылады.
Лиазалар (4 класс)
Бұл классқа органикалық қосылыстарға кіретін С-С, С-N, С-О т. б. байланыстарды гидролитсіз (су қоспай) ыдырататын, немесе синтездейтін, 9 топтан тұрады.
4. 1. 1. Карбоксилазалар. Кетоқышқылдарының декарбоксилазалары.
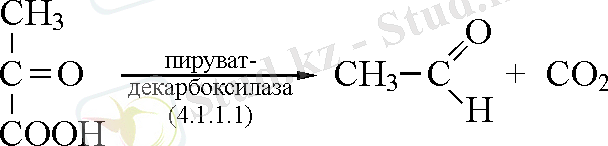
4. 1. 2. Алдегидлиазалар. Альдолаза реакциясын жүргізеді.
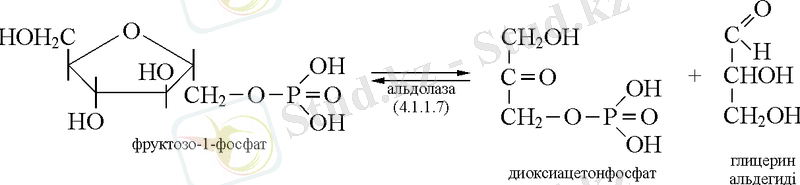
Изомеразалар (5 класс)
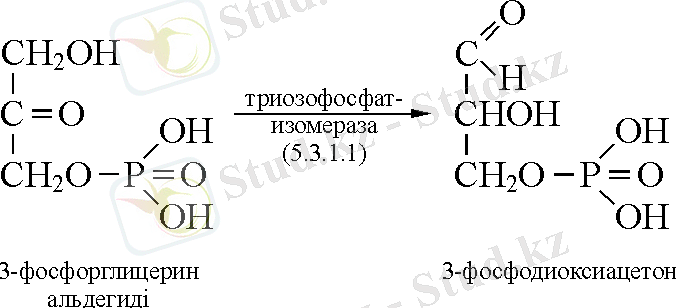
Бұл классқа молекула ішілік сутегі, фосфор, қосбайланыстар алмасуларын катализдейтін, 9 топтан тұратын, 30 фермент кіреді.
5. 3. 1. 1. Триозофосфатизомераза.
Лигазалар (6 класс)
Бұл классқа 7 топтан тұратын, 41 фермент кіреді, C-N, C-C, C-O, C-S байланыстары түзілуін катализдейтін синтетазалар.
6. 3. 2. 1. Пантотенатсинтетаза. С-N байланыстарды катализдейтін лигазалар.
6. 4. 1. Карбоксилигазалар. С-С байланыстарды катализдейтін лигазалар.
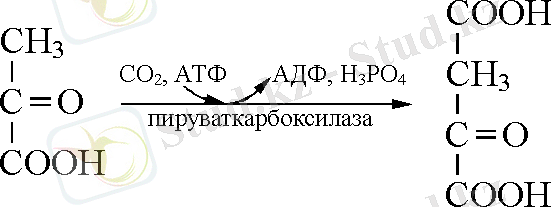
6. 2. 1. Қышқыл-тиолды лигазалар. Макроэргиялық ацил-КоА-ның биосинтезін катализдейді.

Энзимологияның медициналық аспектілері.
Ағзалардың оның торшаларының тіршілік етуі үшін ферменттер өте қажет. Мыңдаған биохимиялық реакциялардың қатаң түрде дұрыс жүруінің бұзылуы торша компоненттері мен қызметінің бұзылуына, ағзаның гомеостазының өзгеруіне әкеледі. Медицина үшін энзимологияның ғылыми жетістіктерін ағзаның сау және патологиялық қалпын анықтау, диагностикада, терапияда қолданудың маңызы зор. Сондықтан, қазіргі кезде, бұл медицинаның көптеген салаларында кең пайдаланылады және жақсы нәтижелер беруде.
Ферменттерді медицинада қолдану үш негізгі бағыттармен (энзимопатия, энзимодиагностика, энзимотерапия) айқындалады.
Энзимопатия
- деп ферменттердің мүлде болмауы немесе оның активтілігінің күрт төмендеуінің нәтижесінде ағзадағы өтетін метаболиттік процесстің бұзылуынан болған ағзадағы патологиялық қалыпты айтады.
 Энзимопатия туындау жолдарына байланысты екі үлкен топқа бөлінеді:
Энзимопатия туындау жолдарына байланысты екі үлкен топқа бөлінеді:
1. Тұқымқуалаушы энзимопатия, (бірінші ретті) ;
2. Жүре пайда болған, (екінші ретті) .
Себебіне қарай тұқымқуалаушы энзимопатияны үш топқа бөледі:
а) ферменттердің біреуінің немесе бірнеше түрлері жетіспеушілігі;
б) ферменттердің бір немесе бірнеше топтарының жетіспеушілігі;
в) ферменттердің бір немес бірнешеуінің құрылысының өзгеруі нәтижесінде.
Мысалы, лактаза жетіспеушілігі гемолиттік анемия, гемофилияға әкеледі.
Жүре пайда болған энзимопатия - бұл ағзадағы белгілі бір мүшенің патологиялық процессінің нәтижесінде пайда болған фермент жетіспеушілігі болып табылады. Олар үш топқа бөледі:
1. Токсикалық энзимопатия (уланудың нәтижесінде) ;
2. Алиментарлық энзимопатия;
3. Нейро-гуморальды энзимопатия.
Токсикалық энзимопатия себептеріне байланысты келесі топтарға бөлінеді:
а) фермент активтілігінің төмендеуіне байланысты;
б) белок биосинтезінің фермент әсерін спецификалық төмендетуіне байланысты;
в) белок биосинтезінің фермент әсерінің бейспецификалық төмендетуіне байланысты.
Алиментарлы - бұл белгілі бір уақытта берілетін тағамдық рационның құрамдық катынасының бұзылуынан пайда болады. Алиментарлы энзимопатия келесі себептерге тығыз байланысты:
а) тағамдағы витаминдердің тапшылығына (авитаминоз) ;
б) микроэлементтердің тапшылығына;
в) тағамдағы белоктың тапшылығына (белоктық аштық) .
Нейрогуморальдық реттелудің бұзылуынан болатын энзимопатия негізінен торшадағы процесстердің өзгеруіне тікелей жүйке қызметі мен гормональдық қызметтің сәйкестігінің бұзылуы және кейбір гормон бөлуші ұлпалардың қызметінің бұзылуына тіккелей байланысты болады.
Токсикалық энзимопатия экология әсерлерінен, кейбір дәрілік препараттардың әсерлерінен туындайды. Бұл улы заттардың әсерінен ферменттің белоктық бөлігінің конформациясын өзгертуі арқылы жүретін процесс. Мысалы, антихолинэстеразалық әсер көрсететін ингибитор мен субстратқа ұқсас құрылысты жатқызуға болады.
Сонымен бірге, кейбір антибиотиктер де (актиномицин Д, пуромицин, хлорамфеникол және т. б. ) белок синтезінің белгілі бір стадияларын тежейді. Афлотоксиндер де канцерогендік әсер беретін улы заттарға жатқызылады.
Энзимологияның қазіргі кезендегі ғылыми жетістіктері көптеген аурулардың дамуы механизмдерін түсінуге ықпал жасайды және практикалық медициналық энзимодиагностика, энзимо-, коэнзимотерапия бөлімдерінің кең қолданылуына жағдай жасады.
Энзимодиагностика. Қазіргі заманғы клиникалық биохимия ұлпалардың, торшалардың, биосұйықтықтардың ферменттерінің активтілігін анықтаудың әртүрлі тәсілдерін кең қолданады. Бұл ағзаның диагностикасы үшін аса маңызды және көптеген аурулардың дамуының механизмі мен дифференциалды диагностикасы үшін ыңғайлы әдістерді береді.
Энзимодиагностика тәсілдері екі түрлі аспектіге бөлінеді:
1. Лабораториялық диагностикада ферменттерді аналитикалық реагент ретінде пайдалану. Бұл жолдар арқылы глюкозаны, этанолды, зәр қышқылын және т. б. анықтауға болады. Анықтау кезінде иммобилденген ферменттерді (ферменттер ерітілген күйде болады) мембранамен байланысқан ферменттерді пайдаланады. Олар биохимиялық автоматтардың құрам бөліктеріне жатады.
2. Биологиялық материалдардағы ферменттердің активтілігін анықтау.
Энзимодиагностиканың теориялық негізіне ферменттердің ағзадан тысқары болғанда активтілігін тежеуі, субстраттық талғамдылық пен әсер ету талғамдылықтарының тежелуі жатқызылады. Торшалардың әртүрлі мүшелері, ұлпалары мен органеллалары ферменттік және изоферменттік спектрлерімен сипатталады. Сонымен бірге кейбір ауруларда фермент активтілігінің өзгерісінің патогенетикалық өзгеруі де байқалады.
Әртүрлі мүшелерге әртүрлі ферменттік құрамы тән болғандықтан, оларды, мүшеспецификалық ферменттер ретінде қарастыруға болады. Сондықтан, сол мүшелерге тән ферменттік өзгерісті анықтаған соң бір науқастың бауырының зақымдалғанын, ал келесі науқастың басқа бір мүшелерінің бұзылатынын анықтауға болады. Және бұл клиникалық белгілерінсіз ақ түсініксіз диагнозды анықтауға мүмкіндік береді.
Энзимодиагностика өте сезімтал және ауруды ерте анықтауға ықпал жасайтын ерекше әдіс. Биологиялық материал ретінде қан, зәр, слекей, асқорыту сөлдері, пунктаттар, биоптаттар пайдаланылады.
Әртүрлі ауруларда фермент активтілігінің өзгеруімен бірге, белгілі бір мүшеге жатпайтын ферменттің, зақымданған торшалардан шығып, басқа ұлпа мен мүшелерден табылуы байқалады. Қанның ферменттік спектрін зерттегенде келесі өзгерістер байқалған: 1) қанда қалыпты жағдайда тұрақты түрде кездесетін ферменттердің активтілігінің төмендеуі және мөлшерінің көбеюі; 2) гистогематикалық кедергі өткізгіштігі бұзылуы себебінен сау ағзаның қанында кездеспейтін ферменттің пайда болуы. Бауыр ауруларында қанда фруктозо-1-фосфатальдолазаның, глюкозо-6-фосфатазаның, гистидазаның, урокиназаның концентрациясының жоғарлауы байқалады.
Жүрек ауруларының диагностикасы үшін қан сарысуында лактатдегидрогеназаны, глутамат-АлАТ-ты, глутамат-АсАТ-ты анықтау өте маңызды. Миокард инфарктісінде торшалардың көп мөлшерінің өлуі себебінен және торша мембранасы бұзылуы себебінен жоғарыда аталған ферменттер қанға өтетіндігі белгілі болады.
Трансплантацияда, мүшелерді ауыстырып салғаннан кейін болатын ферменттік өзгерістер де белгілі. Егер, ағза өзіне салынған мүшені қабылдамаса γ-глутаминтрансфераза ферменті активтілігінің жоғарлауы байқалады.
Энзимотерапия және коэнзимотерапия - ферменттерді, оның құрамдық бөліктерін белгілі бір ауруларға қарсы емдеу құралы ретінде қолданудың әдістері мен тәсілдері, механизмінің негізін қалайды. Қазіргі кезеңде көптеген ферменттер ауруға қарсы дәрілік препарат ретінде кең қолданылады. Мысалы, асқорытуды жақсарту үшін асқазан сөлі құрамындағы пепсиннің мөлшерлерінің төмендеуінен болатын асқазан ауруларында, фистал, мезим препараттарын емдеу үшін қолданады (орынбасушы терапия әдісі) . Ұйқы безінің жұмысының жетіспеушілігінде оның протеолиттік ферменттері трипсин, химотрипсин ферменттері және ұйқы безінің құрғатылған сөлі панкреатин (липаза, амилаза, трипсин ферменттері қоспасы), химопсиндерді (химотрипсин, трипсин қоспасы) емдеуде қолданады. Трипсин жараның бетінен трофикалық жаралардан өлген ұлпалардан тазарту мақсатында және күйгенде емдеу үшін, қою секреттерді, экссудаттарды қан ұйымаларын сұйылту үшін және ісікке қарсы препарат ретінде қолданады. Мүйізді ірі қаралардың ұйқы безінен бөлінген коллагеназа, рибонуклеаза ферменттік препараттары да ісікке қарсы қолданылады. Буын ауруларын емдеуде гиалуронидазаны (лидаза немесе ринидаза, препараты түрінде), гиалурон қышқылының гидролизін үдететін, мүйізді ірі қараның ұрық безінен алынған ферментті қолданады.
Қан тамырларының тромбозасын (бітелуін) емдеуде тромбаны еріту арқылы тромболиттік ферменттерді фибринолизин, тромболитин (трипсин мен гепарин комплексі) қолданылады.
Дезоксирибонуклеаза (ДНҚ-аза) (мүйізді ірі қараның ұйқы безінен бөлінген) деполимерлендіруге және іріңді сұйылтуға қабілетті және көздің вирустық ауруларын, коньюнктивитті емдеуде вирустық нуклеин қышқылдарының ыдырауын тездету үшін қолданады.
Аспарагиназа лейкозаның (ақ қан қатерлі ісігі) кейбір формаларын емдеуге қолданады. Аспарагин лейкозалық торшада синтезделмейтіндіктен, оны қан плазмасынан алады. Сондықтан науқастың қанына аспарагиназаны қосқанда қан плазмасындағы аспарагин ыдырайды да лейкоз торшасына қажетті аспарагин құрамды белок синтезделмейді, тоқталады, торша өледі.
Емдеу препараты ретінде кейбір коферменттер де кең қолданылуда. Мысалы, пирожүзім қышқылын және α-кетоқышқылдардың тотығып декарбоксилденуі процессіне қатысатын коферменттер кокарбоксилаза (тиаминпирофосфат) және липой қышқылы көмірсулар алмасуын жақсартумен бірге бірнеше ауруларда (атеросклероз, бауыр зақымдалулары, ацидозда, қан айналысы жетіспеушілігінде) айқын эффект көрсетеді.
Қазіргі кезде витаминдер олардын коферменттік формалары да рибофлавин, , никотинамид, кальций пантотенаты, пиридоксин, цианкобаламин препараттары түрінде ауруды емдеу үшін кең қолданылуда.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz