Аналитикалық химия: электрохимиялық талдау әдістері


Қазақстан Республикасының білім және ғылым министрлігі
Қарағанды мемлекеттік техникалық университеті
Кафедра: Х және ХТ
КУРСТЫҚ
ЖҰМЫС (ЖОБА)
Пәні бойынша: Аналитикалық химия
Тақырыбы: Талдаудың электрохимиялық әдістері
Жетекшісі:
(Бағасы) (Күні, қолы)
Студент: тобы
(Күні, қолы)
Қарағанды 2017
Қазақстан Республикасының білім және ғылым министрлігі
Қарағанды мемлекеттік техникалық университет
Институт «Бекітемін»
Кафедра Каф. меңгерушісі:
«___» 20__ж
Курстық жұмыс бойынша тапсырма
пәні бойынша
Студент: тобы
Тақырыбы
Бастапқы деректер
МАЗМҰНЫ
Кіріспе . . . 4
1 Электрохимияның негізгі түсініктері . . . 5
1. 1 Электродтар және электрохимиялық жасуша . . . 5
1. 2 Электродтар классификациясы . . . 7
1. 3 Электродтық потенциалдың есебі және өлшемі . . . 8
2 Талдаудың электрохимиялық әдістері . . . 9
2. 1 Талдаудың электрохимиялық әдістеріне жалпы сипаттама . . . 9
2. 2 Электрохимиялық талдау әдістерінің классификциясы . . . 9
3 Потенциометриялық талдау әдістері . . . 11
3. 1 Потенциометриялық талдау әдісінің принципі . . . 11
3. 2 Потенциометриядағы индикаторлық электродтар . . . 11
3. 3 Потенциометриядағы электродтарды салыстыру . . . 11
3. 4 Тура потенциометрия . . . 12
4 Кулонометриялық талдау әдістері . . . 13
4. 1 Кулонометрияның негізгі принциптері. Фарадей заңы . . . 13
4. 2 Кулонометриялық талдаудың негізгі әдістері . . . 14
4. 3 Тура кулонометрия . . . 14
4. 4 Кулонометриялық титрлеу . . . 16
5 Кондуктометриялық талдау әдістері . . . 20
5. 1 Кондуктометрияның негізгі түсініктері . . . 20
5. 2 Электрөткізгіштіктің өлшеу принципі . . . 24
5. 3 Тура кондуктометрия . . . 25
5. 4 Кондуктометриялық және жоғары сапалы титрлеу . . . 26
Тәжірибелік бөлім . . . 28
Қорытынды . . . 30
Пайдаланылған әдебиеттер тізімі . . . 31
Кіріспе
Аналитикалық химия (грек. аnalysіs - талдау, жіктеу ) - заттардың химиялық құрамын анықтау әдістері туралы ғылым. Бұл ғылымның негізгі міндеттері - талдау әдістерінің қолдану шегін анықтау, түрлі заттардың құрамын анықтау әдістемелерін жетілдіру, жаңа әдістемелер ұсыну. Онда сапалық және сандық талдау жүзеге асырылады. Сапалық талдау зерттелетін заттың құрамын, ал сандық талдау сол құраушы заттардың массасын не массалық үлесін анықтайды.
Менің қарастырған тақырыбым сандық және сапалық талдау әдістеріне байланысты, яғни талдаудың электрохимиялық әдістері. Электрохимиялық әдістердің көмегімен кез-келген агрегаттық күйдегі анорганикалық және органикалык қосылыстарды сандық және сапалық тұрғыдан талдауға болады. Зерттелетін ортадағы электрохимиялық процестер өзара жанасатын фаза шекараларында немесе олардың көлемінде жүреді, олар құрылымның, валенттік күйдің, химиялық құрамның, концентрацияның және басқа да параметрлердің өзгерісімен байланысты.
Электрохимиялық талдау әдістерін әрқайсысын жіктеуге болатын топ-топтарға бөліп қарастыруға болады. Мысалы, потенциометрия, кондуктометрия
және жоғарғы жиіліктегі титрлеу, вольт-амперометрия және полярография, кулонометрия, диэлектрометрия.
Потенциометрия -кері гальваникалық жасушалардың электр қозғалтқыш күшін (ЭҚК) немесе қайтымды электролитті тізбектегі рН не рХ электродтарға тиісті потенциалдарды өлшеуге негізделген әртүрлі физикалық және химиялық шамаларды анықтау әдісі.
Вольтамперметрия- термині электрохимиялық өлшеу әдістеріне XX ғасырдың 40 жылдарында енді. Бұл әдіс зерттелетін электролитті ұяшыққа берілетін поляризация тоғының поляризациялану кернеуіне тәуелділігін анықтауға негізделген.
Кулонометрия әдісі электрохимиялық түрленуге түскен заттың мөлшері мен электролиттік ұяшық арқылы өтетін ток мөлшері арасындағы байланысты орнықтыратын Фарадей заңына (1834) негізделіп жүргізілетін талдау тәсілдерін қамтиды.
Кондуктометрия электрометрдің электр өткізгіштігін, яғни балқымалар, коллоидтар сулы және сусыз ортада нағыз ерітінді күйінде болатын иондық өткізгіштерді анықтауға негізделген.
Диэлектрометрия - диэлектрлік поляризацияның электрод аралық кеңістіктегі концентрациясының, құрылымының немесе құрамының өзгеруіне тәуелділігін көрсететін ортаның диэлектрлік өткізгіштігін өлшеуге негізделген әдістерді біріктіреді.
1. Электрохимияның негізгі түсініктері
1. 1 Электродтар және электрохимиялық жасуша
Электрохимия - электр тогының өткізгіштері, өткізгіштердегі процестер, электродтарда (металдардан немесе жартылай өткізгіштерден, графитпен қоса) және иондық өткізгіштерде (электролиттерде) жүйелер мен интерфейстер қарастырылатын химиялық ғылымның саласы болып табылады
Электрохимиялық әдістер электродтар реакциясында немесе электрохимиялық ұяшықта ағатын электродтар арасындағы процестерге негізделген.
Электрод - электродтық потенциал жоғарысында ұшырайтын токөткізгіш дене. Потенцалдың өзгеруінің себебі элетрохимиялық реакция немесе жақын электродтар кеңістігінде түзілетін иондар потенциалының концентрациясының өзгеруі болуы мүмкін.
Электрохимиялық реакция - реакцияға қатысатын заттың иондарының (атомдар мен молекулаларының) арасындағы қатынасты анықтайды. Мысалы, егер мыс пластинасы CuSO 4 мыс тұзының ерітіндісіне түсірілсе, онда Cu 2 + реакциясының төмендеуі нәтижесінде металл пластинасынан тұратын электронның қатысуымен, ерітіндінің мыс иондары кристалдық торға өтеді, себебі ерітіндіде (Uг) ионның ерітіндісінің энергиясы металл иондарының кристалдық тордан шығу энергиясынан аз(Uм) : Uг <Uм. Жүйеде ауыспалы тепе-теңдік орнатылды :
Cu 0 ⇔Cu 2+ + 2e.
Металдың шекара қабатындағы электрондардың болмауына байланысты пластина оң зарядталады, ал ерітіндіде мыс катиондарының құрамындағы қабат пайда болады. Шекарада потенциал секірісі немесе электрод потенциалымен сипатталатын екі қабатты электр қабаты пайда болады.
Мысқа қарағанда мырыш иондары Uм < Uг. Сондықтан, егер ерітіндіге мырыш пластинасын ZnSO 4 жіберсек, онда Zn 2 + иондары кристаллдық тордан ерітіндіге шығады және нәтижеде Zn 0 ↔︎ Zn 2+ + 2е металлдың жартылай тотығу реакциясы, ал электрондардың бетіне асып кетуіне байланысты пластина теріс зарядталады және ерітіндінің шекара қабатында Zn 2 + артықшылығы болады. Беткі қабатта оның потенциал мәнімен сипатталатын қос қабатты қабат пайда болады.
Электрохимиялық жасуша - бұл, кем дегенде екі электродтан тұратын электролит ерітіндісіне салынған (зерттелген ерітінді) жүйе. Электрохимия-
лық жасушалардың үш түрі бар: гальваникалық элемент; электролит жасушасы; кондуктометриялық жасуша.
1-суретте. галваникалық элемент режимінде істейтін электрохимиялық жасушаның схемасы көрсетілген. Ол екі жартылай элементтен тұрады: мыс және мырыш электродтары салынған CuSO 4 және ZnSO 4 ерітінділерімен толтырылған ыдыстардан. Жоғарыда сипатталған микропроцесстерге сәйкес электродтың сипатына және тиісті электролит концентрациясына байланысты электродтардың әрқайсысының бетінде электродты тепе-теңдік потенциалы пайда болады. Бұл потенциалдардың шамасы мен белгісі өзгеше болады (мырыш электрод теріс зарядталады, ал мыс электрод оң болады) .
Электрохимиялық жасушаның жарты жасушалары тұз көпірімен (электрод реакциясына қатыспайтын, бірақ ионды өткізгіш KCl электролитінің қаныққан ерітіндісі), ал электродтар металл өткізгіш арқылы қосылса, (1-сурет) онда электрод потенциалдарының айырмашылығына байланысты электрондар мырыш электродынан (анодтан) Cu 2 + иондары электродтың бетінде қалпына келтірілетін, электр тогы пайда болатын мыс электродына (катодқа) қарай қозғала бастайды. Реакция тепе-теңдік күйіне дейін жалғасады:
Zn 0 +Cu 2+ =Zn 2+ +Cu 0
электрондардың ағыны тоқтаған кезде.
Мұндай электрохимиялық жасушалар электр тізбегінің электр қозғаушы күшін өлшеу және индикаторлық электродтың потенциалын табу үшін потенциометриялық талдауда кеңінен қолданылады.
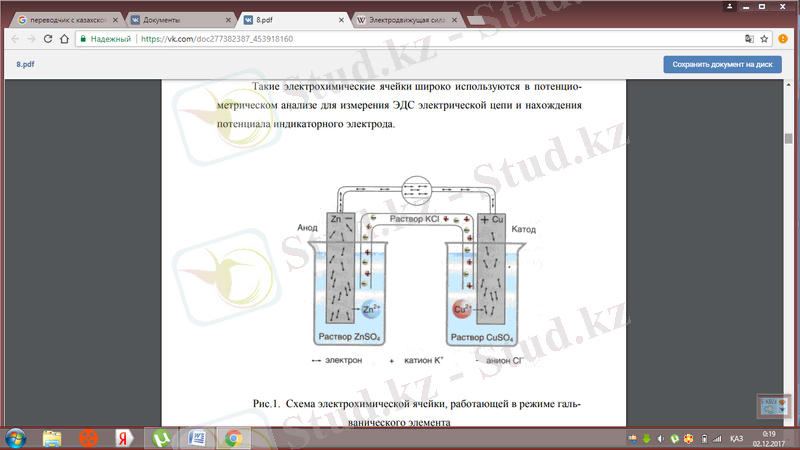
1-сурет. Галваникалық элемент режимінде істейтін электрохимиялық жасушаның схемасы.
Электрохимиялық жасуша әдетте электрод пен электролит арасындағы тік сызық арқылы шекараны, ал екі сызықпен тұзды көпірді белгілей отырып, схемалық түрде ұсынылады. Әдетте анод тұзды көпірдің сол жағына, катод-оң жағына бейнеленеді. Шартты белгілерді қолдана отырып, қаралып жатқан галваникалық элементтің схемасы төмендегідей болуы мүмкін:
Zn I ZnSO 4 II CuSO 4 I Cu
Электрохимиялық жасушаның маңызды қасиеті оның айырбасталуы болып табылады, әртүрлі бағытта электр тогынан өту кезінде электрод бетіндегі сол жартылай реакция, қарсы бағыттарда: не тотығу, не тотықсыздану орын алады. Зерттелетін жағдайларға байланысты кері электрохимиялық жасуша ток көзінің (гальваникалық элементтің) режимінде және электролиттік клетка режимінде (электролиттік жасуша) жұмыс істей алады. Мысалы, егер берілген мыс-мырыш жасушасының сыртқы тізбегіне ток көзін қоссақ, онда ол қарама-қарсы бағытта жұмыс жасайды, мыс электроды ери бастайды, ал мырыш электродының бетінде ерітіндіден Zn 2+ иондары ағады және мырыш металлы шығарылады. Бұл жағдайда ток көзінің электр энергиясы химиялық реакцияның энергиясына айналады. Мұндай жасушалар электролиз үрдісіне негізделген кулонометрия және басқа электрохимиялық талдау әдістерінде қолданылады (электрогравиметрия, вольтамперометрия) . Олар электролит деп аталады.
Электрохимиялық жасушаның электрлік сипаттамасы электр қозғаушы күш (ЭҚК) болып табылады. Жасушаның электр қозғаушы күші катод пен анодта жүретін екі жартылай реакцияның электродтық потенциалының айырмашылығымен анықталады:
ЭҚК = Eкат - Еан.
Егер ЭҚК>0 болса реакция өздігінен жүреді және электрохимиялық жасуша гальваникалық тізбек болып табылады, егер ЭҚК< 0 болса онда, реакция сыртқы ток көзінің энергия беруі арқылы ғана жүре алады және бұл электрохимиялық жасуша болып табылады.
- Электродтар классификациясы
Электродтар өз мақсаттарына сәйкес және әрекет принципі бойынша жіктеледі. Индикаторлық электродтар мақсаты бойынша салыстыру электроды және көмекші болып бөлінеді.
Индикаторлық электрод деп - потенциалы ерітіндіде анықталатын ионның активтілігіне (концентрациясына) тәуелді электродты айтады.
Салыстыру электроды деп - индикаторлық электрод потенциалының өлшемі байланысты электродты айтады. Ол зерттелетін ерітіндінің құрамына тәуелді емес белгілі, тұрақты потенциалға ие.
Көмекші электрод - электролиттік ұяшықта электролиз кезінде жабық тізбекті шығару үшін жұмыс электродымен бірге қолданылатын электрод.
Әрекет принципі бойынша электродтар металлдық (электронды алмасу) және мембраналық (иондық-селективті) болып бөлінеді. Металл электродтарының әлеуеті электрохимиялық реакцияға байланысты туындайды және мембрана электродтарының потенциалы интервалдағы ион алмасу реакциясынан және потенциалды құратын иондардың осы концентрациясынан туындайтын өзгерістерден туындайды.
Электродтардың бірінші тобы электрондық өткізгіштігі, екіншісі - иондық. Металдық электродтар активті және инертті болып бөлінеді. Белсенді электродтардың иондары электрохимиялық реакцияға тікелей қатысады (мысалы, мыс пен мырыш электродтары) . Инертті электродтар электрохимиялық реакцияға қатыспайды, бірақ ерітіндідегі ерітілген редокс жұбының тотыққан және тотықсызданған формалары арасындағы электрондардың тасымалдаушылары ретінде әрекет етеді. Сол себепті кейде оларды тотығу - тотықсыздану электроды ретінде қарастырады.
Белсенді электродтар бірінші және екінші түрдегі электродтарға бөлінеді. Бірінші түрдегі электродтардың потенциалы тек металл катионының (мысалы, күміс Ag / Ag + , мыс Cu / Cu 2+ және т. б. ) немесе тек анионның белсенділігіне байланысты. Олар металл және газ. Екінші түрдегі электродтардың потенциалы катионға да анионға да (мысалы, күміс хлоридті электродқа) қатысты кері әсер етеді.
Мембраналық электродтар бірнеше топқа бөлінеді:
1) шыны;
2) гомогенді және гетерогенді мембраналар тығыз;
3) сұйықтық;
4) газды;
5) биологиялық заттардың активтілігін өлшеуге арналған электрод.
- Электродтық потенциалдың есебі және өлшемі
Кез-келген электродтың әлеуеті Нернст теңдеуіне сәйкес электрод реакциясына қатысатын иондардың белсенділігіне (концентрациясына) тәуелді:
Е ox/red = Е 0 ox/red + RT/(nF) • ln а ox / а red ,
мұнда: n - электрод реакциясына қатысатын электрондардың саны;
R- универсаль газ тұрақтысы (R = 8, 314 Дж ·К -1 ·моль -1 ) ;
T - абсолютті температура, Кельвин град;
F - Фарадей саны (F = 96500 Кл/моль экв ) ;
E 0 - редокс жүйесінің стандартты электродтық потенциалы, B;
ln - натурал логарифм, 2, 303 lg 10 -тең
a ox , a red - редокс жүйесінің қалпына тотығу - тотықсыздану формаларының белсенділігі.
Қалыпты температурада (T = 298, 15 К) сандық мәндерді ескере отырып Нернст теңдеуінің тұрақты мәндері келесідей өзгеруі мүмкін:
Е ox/red = Е 0 ox/red + 0, 059/n• lg а ox / а red.
2. Талдаудың электрохимиялық әдістері
2. 1 Талдаудың электрохимиялық әдістеріне жалпы сипаттама
Талдаудың электрохимиялық әдістері (ТЭХӘ) химиялық жүйенің электрлік параметрлерінің концентрацияға тәуелділігін, оның табиғаты мен компоненттерінің құрылымын зерттеуге негізделген сапалық және сандық талдау әдістерінің жиынтығы. Талдау практикасында ең көп таралған әдістер -потенциометрия, кулонометрия, кондуктометрия, және вольтамперометрия.
Барлық әдістер сандық талдауды орындау кезінде өте тиімді. Сонымен қатар, сандық және сапалық құрамын анықтау вольтамперометрия әдісіне мүмкіндік береді. Қазіргі уақытта экоаналитикалық зертхана практикасында бір талдаудың нәтижесімен ішуге арналған, табиғи және 10-3 тен 1 мг/дм3 дейінгі концентрлі ағынды сулардағы бірнеше микрокомпоненттерді (сонымен қатар, ауыр металлдар иондарын) анықтауда инверсиялық вольтамперометрия әдісі қолданылады. Бұл әдістің жоғары таңдаулылығы кешенді бөлу схемасына жүгінбей және қызықты компонентті таңдап, оны кейіннен бөлек анықтау көпкомпонентті жүйелерді орындауға мүмкіндік береді.
Электрохимиялық әдістер жоғары сезімталдықпен, селективтілікпен, айқындылықпен және жеткілікті жоғары дәлдікпен өлшеуге мүмкіндік береді (0, 05% -дан 10% -ға дейін) және кең ауқымды концентрлі (10-9 дан 1 моль/дм3 дейін) өндірістікпен ерекшеленеді. Электрохимиялық талдау әдісінің химиялық әдістерден айырмашылығы, сұйылтылған ерітінділерді сонымен қатар, технологиялық ерітінділер мен сарқынды суларды зерттеуде электрохимиялық талдау әдісі жоғары нәтижелі болади. Электрохимиялық әдістердің сөзсіз артықшылығы - бұлыңғыр, боялған және агрессивті ерітінділерді талдауға мүмкіндік беруі. Бұл әдістер айтарлықтай мөлшердегі қоспалар мен боялған заттарды қамтитын технологиялық потоктардың аналитикалық бақылауын және ағынды суларды автоматтандыру үшін ең перспективті деп танылуы мүмкін.
1. 2 Электрохимиялық талдау әдістерінің классификациясы
Электрохимиялық әдістер анализ кезінде өлшенетін құбылыстардың түріне қарай екі топқа жіктеледі :
- Электрод пен зерттелетін ерітіндіден тұратын, электрохимиялық жасушадағы ықтимал айырмашылықты сыртқы потенциалдың қатысуынсыз өлшеуге негізделген әдістер. Бұл әдістер тобы потенциометриялық деп аталады. Потенциометриялық әдістер электродтың тепе - теңдік потенциалын электродтардағы электрохимиялық реакцияларға қатысатын иондардың концентрациясына тәуелділігін пайдаланады.
- Сыртқы потенциалдың қатысуымен өлшеуге негізделген әдіс:
а) ерітінділердің электрөткігіштігі - кондуктометрия ;
б) ерітінді арқылы өтетін электр қуаты - кулонометрия ;
в) ток шамасының қолданылатын потенциалға тәуелділігі - вольт-амперометрия ;
г) электрохимиялық реакциялардың өтуі үшін қажетті уақыт - хроно-электрохимиялық әдістер (, хронокондукто -метрия) .
Осы топтың әдісінде электрохимиялық жасуша электродына сыртқы потенциал қатысады.
Электрохимиялық талдау әдісінің екі түрі бар: жанама және тікелей. Тікелей әдістер ағымдағы компоненттің концентрациясына тәуелділігін (потенциал және т. б. ) пайдаланады . Жанама әдістерде ағымдық беріктік (потенциал және т. б. ) компоненттің титрлеудің соңғы нүктесін табу үшін жарамды титанмен анықталады, яғни, Е. өлшенген параметрдің титанның көлеміне тәуелділігін пайдаланады.
3. Потенциометриялық талдау әдістері
3. 1 Потенциометриялық талдау әдістерінің принципі
Талдаудың потенциометриялық әдістері ток болмаған кезде электрохимиялық жасушаның электр қозғалтқыш күшін (ЭҚК) өлшеуге негізделген.
Потенциометриядағы электрохимиялық жасушаның рөлін гальваникалық элемент атқарады. Бұл жағдайда потенциалы анықталатын ионның активтілігіне тәуелді, жасуша электродтарының бірі полярланбайтын индикаторлық электрод болуы керек. Екінші электрод электродтарды салыстыру қызметін атқарады. Оның потенциалы тұрақты, анық болуы керек, және ол зерттелетін ерітінді құрамында болмауы тиіс.
Жабық гальваникалық тізбектің ЭҚК-н өлшеу ток көзі жоқ кезде жүзеге асырылады. Бұл жағдайда тізбектің ЭҚК-ң шамасы электрохимиялық жасушаның электродтары мен потенциал арасындағы айырмашылыққа тең болады.
3. 2 Потенциометриядағы индикаторлық электродтар.
Потенциометриялық талдауда оның функциясын анықтайтын индикаторлық электродтың негізгі қасиеті -анықталатын ионның(концентрацияның) активтілігіне электродтық потенциалдың тікелей тәуелділігі. Сонымен қатар индикаторлық электродтар келесі талаптарға сай болуы керек:
а) электрод потенциалы өндірілген болуы керек;
б) ион концентрациясының(активтілігінің) өзгеруіне электродтың реакциясы жылдам болуы керек;
в) электродтың белгілі бір химиялық төзімділігі болуы керек;
Индикаторлық электродтар электрондық-алмасу(металлдық) және иондық-селективті(мембраналық) болады.
3. 3 Потенциометриядағы салыстыру электродтары
Индикаторлық электродтың потенциалын өлшеу электродты салыстыруға қатысты жүзеге асырылады. Салыстырудың классикалық электроды стандартты электрод болып табылады. Бірақ конструкцияның күрделілігі және жұмыс талаптарына жоғары сезімталдық оны сериялық өлшеуге пайдалануға мүмкіндік бермейді. Потенцометриялық талдаудағы салыстырмалық электрод практикалық тұрақты және өндірілетін потенциалды стационарлық және мобильді жағдайларда өлшеу кезінде дайындау және сақтау оңай болуы керек. Сонымен қатар, ол келесі талаптарға сай болуы керек:
а) электродтың потенциалы ерітіндідегі анықталатын ионның активтілігіне тәуелді болмауы керек;
б) потенциалды анықтаушы электрод реакциясы кері болуы керек;
в) кішкентай ток өткізген кезде оның тепе-теңдік потенциалын сәл өзгерту керек.
3. 4 Тура потенциометрия
Потенциометриялық әдістер тура және жанама болып екіге бөлінеді. Тура потенциометрия ерітіндідегі талданатын заттың концентрациясын немесе активтілігін анықтау үшін, ал жанама потенциометрия титрлеу процесінде эквивалент нүктесін анықтау кезінде қолданылады.
Тура потенциометрия әдісі бойынша ерітіндідегі талданатын заттың концентрациясын немесе активтілігін табу үшін тәжірибе кезінде өлшенген тізбектің ЭҚК-н немесе салыстыру электроды арқылы анықталған индикаторлық электрод потенциалының мәнін Нернст теңдеуіне қояды. Тура потенциометрияда рН-метрия және ионометрия деген екі түрлі тәсіл бар. Ионометрияны ионның құрамына енетін катион және анионға сәйкес катионометрия және анионометрия деп екі түрге жіктейді. Мұндағы рН-метрия әдісі өз алдына үлкен бір топ құрайды, өйткені бұл сутек иондарына өте сезімтал шыны (рН) электродының ертерек пайда болған, өзінің қарапайымдылығымен тез және кең таралған түрі. Ал ионометрия әдісі ионды таңдап, талғап, оларды бөле алатын электродтар мен сенсорлардың жасалуына байланысты дамиды. рН-метрия әдістері биологиялық, дәрі-дәрмектік, химиялық, ауылшаруашылық, түрлі технологиялық құбылыстар мен мұнай, тамақ, қағаз және т. б. салаларда тікелей қолданатын және үлкен мәні бар әр түрлі орталардағы сутек иондарының концентрациясын және активтілігін анықтайды. Ионометрия әдістері сулы және сусыз ерітінділерлегі газдар мен әр түрлі иондарды анықтауда аса маңызды рөл атқарады. Оны да медицина саласында дәрі-дәрмек үшін биологиялық, химиялық зерттеулерде айнала қоршаған ортаны, технологиялық процестерді талдау кезінде қолданады.
Тура потенциометрия әдісінің басты артықшылығы-оның қарапайымдылығы, өлшегіш прибор құнының арзандығы, жеңіл құрастырылатындығы, талдауды жүргізу жылдамдығы.
4. Кулонометриялық талдау әдістері
4. 1 Кулонометрияның негізгі принциптері. Фарадей заңы
Кулонометрия - жұмыс электродындағы электрохимиялық реакциялар кезінде электролиздер арқылы өтетін электрлік зарядты өлшеуге негізделген электрохимиялық талдау әдісі.
Кулометриялық талдау әдісі электролиз үрдісіне негізделген. Электролиз - электр тогының әсерімен электродтарда өтетін тотығу-тотықсыздану реакциясы. Әдетте, реакциялар термодинамика заңдарына сәйкес өздігінен ағып кетпейтін электролиз арқылы жүзеге асырылады. Сипатталған көрсетпелердің табиғатын есептей отырып, кулонометрияда электрохимиялық жасушаны электролитикалық деп атайды.
Ол кемінде екі электродты қамтиды:біріншісі жұмыс электроды, онда мақсатты электрохимиялық реакция (электролиз) орын алады, екінші қарсы электродтың функциясын орындайтын және сыртқы көзден ток өткізген кезде тұйық электр тізбегін алу үшін пайдаланылатын көмекші электрод.
Электрохимиялық реакциялардың жүруін қамтамасыз ету үшін электролиттік жасушаның жұмыс электроты электронды алмасу болуы керек.
Электродтардың осы тобына: металлдық инертті, газ және бірінші түрдегі металл белсенді электродтары жатады. Олардың ішінде ең әмбебап болып табылатыны металлдық инертті электродтар(тотығу-тотықсыздану) оның металлы электрохимиялық реакцияға қатыспайды(3, 3-суретті қараңыз), бірақ электронды тасымалдаушы ретінде қызмет етеді. Бұл әртүрлі табиғатта көптеген электроактивті заттар үшін бір электродты пайдалана отырып, кульометриялық өлшемдер жүргізуге мүмкіндік береді. Практикада жұмыс электродтары инертті материалдардан дайындалады: платина, графит, болат, платина, сынап, никель, титан және т. б. Қосалқы электродтың конструкциясы мен материалы әдетте жұмыс электродымен бірдей. Электродтарды талдағанда, электр тогы өтетін жасушалар электролит ерітіндісіне орналастырылады. Бұл кезде катиондар катодқа(-), аниондар анодқа(+) қарай жылжиды. Катодта тотықсызданудың жартылай реакциясы, ал анодта иондардың тотығуының жартылай реакциясы болады.
Кулометриядағы сандық есептеулер электролиз кезінде бөлінген заттың массасы мен электролиттік ұяшықтан өтетін электр энергиясының арасындағы байланысын анықтайтын Фарадей заңдарына негізделген.
Фарадейдің бірінші заңы: заттың электроөзгерісінің (электролиз процесінде қысқартылған немесе тотықтырылған) мөлшері бастапқы электрдің мөлшеріне тура пропорционал.
Фарадейдің екінші заңы: оқшауланған немесе ерітілген әр түрлі заттардың массасы бірдей электр энергиясының өтуі кезінде, олардың электрохимиялық эквиваленттеріне пропорционал
Фарадей заңының математикалық өрнегі, бұл электроөзгерісті заттың массасын есептеуге мүмкіндік береді m (r), келесі теңдеу арқылы анықталады:
m = Q ∙ M / n ∙ F,
мұнда: Q-электр мөлшері, кулон;
М-молярлық масса, г/моль;
n-электродтардағы тотығу - тотықсызданудың жартылай реакциясына қатысатын электрондардың саны;
F-Фарадей саны, 96500 Кл/моль экв ;
M/ n ∙ F - электрохимиялық эквивалент.
Егер Q электр энергиясының саны өлшенетін болса, онда Фарадей заңына сәйкес, талданатын заттың m массасын есептеуге болады. Дегенмен, егер белгілі бір шарттар орындалса, нәтиженің дұрыстығын қамтамасыз ету үшін:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz