Атом құрылысы: теориялық негіздер мен негізгі мектепте оқыту әдістемесі


Курстық жұмыс
Тақырыбы: «Атом құрылысы»
МАЗМҰНЫ
КІРІСПЕ . . . 3
І Атом құрылысының теориялық негіздері
1. 1 Атом құрылысы . . . 5
1. 2. Табиғи радиоактивтiлiк. α, β, γ - сәуле шығару . . . 18
1. 3. Атом ядросының құрылысы. Атом ядроларының байланыс энергиясы . . . 21
ІІ Атом құрылысын тарауын оқыту әдістемесі
2. 1. Атом құрылымы. Элементар бөлшектер бөлімінде өтілетін тақырыптардың сабақ жоспары . . . 29
2. 2. Атом құрылымы. Элементар бөлшектер бөлімі бойынша есептердің шығарылуы . . . 37
ҚОРЫТЫНДЫ . . . 43
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР . . . 44
КІРІСПЕ
Тақырыптың өзектілігі . Физика пәнін оқыту ғылыми дүниетанымды, тұлғаның дамуын қамтамасыз етеді. Мектеп реформасын жүзеге асыру барысында, физикалық білім беруді қоғамның соңғы он жылдықтағы уақыт талаптары мен ғылыми жетістіктеріне лайықты, барлық мүмкіндіктерді қолдануды қажет етеді.
Адам және қоғам жөнінде барынша мол білім берумен қатар, білім мазмұнын тұлғаға бағыттау, тұлға мүддесіне бейімдеу маңызды. Егер, оқушылардың білімі мен шеберлігін, дағдысын жеке өмірлік жоспарларын іске асыруға, өз денсаулықтары мен өмірін қорғауға мүмкіндік берсе, олардың пәнге қызығушылығын арттыратыны сөзсіз.
Қазіргі таңда әрбір азамат радиоактивтілік құбылысын ядролық энергетика, медицинадағы қолданысы бойынша тиімділік, ал қоршаған ортаға туғызатын экологиялық залалы тиімсіздігі тұрғысынан түсінеді.
Радиоактивтілік құбылысы атом ядросындағы процестерге тәуелді болғандықтан, орта мектептің физика курсының «Атомның құрылысы. Атомдық құбылыстар» тарауында оқытылады.
Қазақстан Республикасында 2000 жылдардан бастап «Физика» пәнінен алғашқы төл оқулықтарымыз қолданыла бастады. Негізгі мектепте «Физика және Астрономия» пәні ретінде қалыптасты, «Ядролық физика» тарауы негізгі мектептің 9-сыныбында бүгінгі күнге дейін оқытылуда. Алайда, мына төмендегі жағдайларды ескеру қажеттілігін атаймыз.
Қазақстан Республикасында радиациялық ахуалдың жағдайы әрбір азаматты ойландырары сөзсіз.
- Семей, Атырауда (Азғыр), Батыс Қазақстанда (Капустин Яр, Глиц), Шығыс Қазақстанда, Қызылордада (Байқоңыр), Ақтөбеде (Ембі) ядролық сынақтар жасалды. Алматы, Талдықорған қалалары Қытайдың ЛобНор сынақ айлағындағы жарылыстардан да зардап шегетіні анық.
- АЭС-ң қатты радиоактивті қалдықтарды жоспарлы бөлуін ескерген дұрыс деп ойлаймыз. Кеңестер Одағы кезінде алғашқы АЭС-ң бірі Қазақстанда (Маңғыстау облысында) жасалғандығын, АЭС-ң жұмыс істеу мерзімінің шектеулілігін ескерген жөн.
- Қазақстан Республикасы уран өндірісі жөнінде алдыңғы қатарға шығып отырғандығы, кейбір аймақтарда (Оңтүстік Қазақстан, Қызылорда, Жамбыл облыстары) радиациялық деңгейдің жоғарылығы байқалады.
- Әлем тәжірибесін ескерсек, Чернобыль АЭС-ғы, бүгінгі озық технологиялы Жапон еліндегі Фукусима АЭС-ғы реактордың істен шығуы әрбір азаматтың радиоактивтілік құбылысымен, оның тиімділігі мен залалы жөнінде жүйелі білімге ие болуды қажет етеді.
Аталған жағдайларды ескерсек, өскелең ұрпақтың радиоактивтілік құбылысы мен ядролық физика курсы бойынша берілген білім сапасы мен қоғамдық қажеттілік арасындағы қарама-қайшылықты көрсетеді. Бұл қарама-қайшылық, Қазақстан Республикасындағы 2009 жылы жүргізілген 15 жастағы оқушылар білімін анықтаудың PISA-2009 Халықаралық зерттеулерінен де байқалады. PISA-2009 Халықаралық зерттеулері 65 елді қамтыса, жаратылыстану білімі (оның ішінде физика пәні де бар) бойынша біздің еліміз 58-орында.
Мақсаты: негізгі мектеп «Физика және Астрономия» пәні «Атомның құрылысы. Атомдық құбылыстар», «Атом ядросы. Ядролық энергия. Элементар бөлшектер және Әлем дамуы туралы мағлұматтар» тарауының мазмұнын анықтау мен тиімді әдістемесін жасау болып табылады.
Курстық жұмыстың мақсатына жету үшін мына төмендегі міндеттерді шешуді қажет деп есептейміз:
- «Атомның құрылысы. Атомдық құбылыстар», «Атом ядросы. Ядролық энергия. Элементар бөлшектер және Әлем дамуы туралы мағлұматтар» тарауының орта мектепте оқытылу жағдайын зерттеу;
- зерттеу нысанын оқытуды жетілдіру мақсатында Ресей Федерациясында қолданылатын оқулықтарға ғылыми-әдістемелік талдау жасау;
І Атом құрылысының теориялық негіздері
1. 1 Атом құрылысы
Барлық заттар бөлiнбейтiн аса ұсақ бөлшектерден - атомдардан тұрады деген ұғым ерте қалыптасқан болатын. Егер атом шындығында заттың бөлiнбейтiн алғашқы кiрпiштерi болса табиғаттағы кездесетiн сан алуан заттарға сан алуан атомдар сәйкес қойылуы тиiс. Бұлай болуы бiр жағынан күмән туғызады.
Физика ғылымының дамуы барысында ХIХ ғасырдың аяғына қарата атомның қасиеттерiне байланысты жаңа тәжiрибелiк деректер жинала бастады. Мысалы М. Фарадей 1833 жылы электролиз құбылысын зерттеу барысында электролит ертiндiлерiндегi ток иондардың реттелген қозғалысы екенiн анықтады. Ал 1897 жылы Дж. Томсон сиретiлген газдардағы электр разрядын зерттеу барысында қыздырылған немесе ультракүлгiн жарықпен сәулелендiрiлген кез-келген химиялық элементтiң атомы өзiнен терiс зарядталған бөлшектердi шығатынын анықтады. Осылай алғашқы элементар бөлшек - электрон ашылды. Атом құрлысының күрделiлiгiне нұсқайтын тағы бiр бұлтартпас факт 1869 жылы орыс ғалымыД. И. Менделеев ашқан химиядық элементтердiң периодтылық заңы. Атомдық масса өскен кезде элементтердiң қасиеттерiнiң қайталануын атомның құрамына кiретiн бөлшектердiң саны өскен кезде оның iшкi құрылымының қандай да бiр ерекшелiгiнiң қайталануымен түсiндiруге болатындай.
7. 1 - сурет
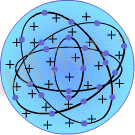
Атомды күрделi жүйе деп ұйғарып, оның алғашқы моделiн ұсынған ғалым Дж. Томсон. Томсон моделi бойынша атом дегенiмiз радиусы шамамен 10 -10 м болатын шар. Бұл шардың бүкiл көлемi оң зарядталған, ал терiсзарядталған электрондар оның iшiнде су тамшысының iшiнде жүзiп жүргентүйiршiктер тәрiздi қозғалып жүредi(7. 1 сурет) . Томсон моделi атомныңбiрқатар қарапайым қасиеттерiн сәттi түсiндiргенiмен көп жағдайдақиыншылыққа тiрелетiн.
7. 2 - сурет
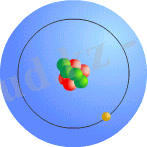
Осы тұрғыдан атом құпиясына тереңiрек үңiлiп, оның жаңа бiр моделiнұсынған ғалым ағылшын оқымыстысы Э. Резерфорд болатын. Ол өзтәжiрибелерiнде аса шапшаң αбөлшектер жұқа алтын фольгаданшашыраған кездегi бұрыштық таралуын зерттей келе атомныңпланетарлық моделi деп аталатын моделiн ұсынды. Резерфордтың бұлмоделi бойынша атомдағы оң зарядтар Томсон моделiндегiдей бүкiлкөлемде таралмай, керiсiнше, оның орталығында жинақталады. Оны атомядросы деп атайды. Ал электрондар болса Күн жүйесiндегi планеталартәрiздi ядроны айнала қозғалып жүредi (7. 2 - сурет) . Электрондардыңмассасы аса аз болғандықтан атомның бүкiлдей дерлiк массасы ядродашоғырланған. Ядроның өлшемi атомның өлшемiмен салыстырғандашамамен 10 5 еседей кiшi.
Атом бүтіндей алғанда зарядсыз, бейтарап бөлшек. Ол ортасында өзінен радиусы 10 4 -10 5 есе кіші көлемді алып жатқан оң зарядты ядродан және оны айнала қозғалып жүрген теріс зарядты электрондардан тұрады. Атом өзінің сыртқы бір немесе бірнеше электрондарын жоғалтқанда оң , ал сырттан электрон қосып алғанда теріс ионға айналады. Атомның сызықтық өлшемдері ~ 10 -8 см , көлденең қимасының ауданы ~10 -16 см 2 , көлемі ~10 -24 см 3 . Борлық атом теориясында ең қарапайым атом - сутегі атомы. Оның радиусының дәл белгілі бір мәні бар және ол мүмкін болатын ең кіші айналу орбитасының радиусы шамасына тең: a =0. 53 * 10 −8 см ( дәлірек, 0. 52917*10 -8 см ) . Атомның массасы, негізінен оның ядросының массасына тең және ол массалық санға ( А ), яғни протондар мен нейтрондардың жалпы санына ( нуклондардың жалпы санына ) пропорционал болып ұлғаяды. Өйткені атомдағы электронның массасы ( 0. 91*10 -20 г ) бір протонның немесе нейтронның массасынан ( 1. 67*10 -24 г ) 1. 840 есе аз. Сондықтан атомның ауырлық орталығы ядроға дәлдей келеді. Атом массасы ядро массасымен ондағы электрондар массаларының дәл қосындысына тең емес. Олардың арасындағы айырым атомның байланыс энергиясын анықтайды. Атомның ішкі энергиясының тек дискретті (үздікті) мәндері болады. Оның ең төменгі деңгейі атомның негізгі күйі E 1 ( ол ең тұрақты, шексіз ұзақ өмір сүретін күйі ), ал жоғарғы энергия деңгейлері қозған күйлер Е і ( і =2, 3, …) деп аталады, ( ол аз өмір сүреді ) . Қозған күйден ~ 10 -8 сек . ішінде атом негізгі күйге ауысып отырады. Осындай ауысу кезінде атомға осы екі деңгейінің айырымына тең ( hν = E ν - E 1 , мұндағы h - Планк тұрақтысы, ν - ұшып шыққан сәуле квантының жиілігі) сырттан энергия берілуі не шығарылуы шарт. Атом энергиясының дискретті квантталуы оның құрамындағы бөлшектердің толқындық қасиетінің болуынан. Атомның осындай қасиеттерін кванттық теория ғана толық түсіндіре алады. Бұл теория бойынша атомдағы электронның күйі 4 кванттық санмен анықталады. Олар: электрон энергиясын анықтайтын бас кванттық сан ( n ), атомның осындай импульс моментін анықтайтын орбиталық кванттық сан ( l ), ал ( l ) -дың берілген оське түсірілген проекциясын анықтайтын магниттік кванттық сан ( m ) және электронның ішкі спинін анықтайтын кванттық сан (m s ) .
Осы 4 кванттық сан мен Паули принципі атомдағы электрондардың барлық күйлерін сипаттайды. Сонымен бірге кванттық теорияда микробөлшектердің сол 4 кванттық сан анықтайтын күйлерін толқындық функциямен ( φ ) өрнектейді. Ол функцияның квадраты ( φ 2 ) бөлшектердің кеңістік нүктелерінде болу ықтималдығын білдіреді. Кеңістіктегі электрон бұлтының тығыздығы осы ықтималдыққа пропорционал. Кванттық сандардың мәндеріне сәйкес атомдардағы қабықшалар мен қабаттар рет-ретімен толтырылып отырады. Осылайша элементтердің Менделеев кестесіндегі орны анықталады. Алдымен ең кіші n=1 қабат толтырып, онда болғаны 2 электрон ғана орналасады. Онан кейін n =2 қабат толтырылғанда ядроның заряды өсуіне сәйкес қабаттар ядроға жақындай түседі. 1-қабат 1s қабықшадан, 2-қабат 2 s , 2 p қабықшалардан, 3-қабат 3 s , 3 p , 3 d қабықшалардан, т. с. с. тұрады. Әр қабат элементтің периодын анықтайды. Осы период элементтердің химиялық, оптикалық, электрлік, және магниттік қасиеттерінің қайталану периоды болып табылады. Осы периодтылық атомның ең сыртқы электрон қабықшаларының қасиетімен анықталады. Мұндай периодтылық иондар қасиетінде де сақталады.
Атомның орбиталарында 2 не одан да көп электрондар қозғалып жүрсе, онда мұндай күрделі атомдардағы электрондардың өзара әсерлесуін де еске алу керек. Ол әсерлесулер тек электр статикалық ғана емес, орбиталық магниттік моменттер мен бөлшектердің өзінің ішкі магниттік моменттері де өзара әсерлесуі мүмкін. Мысалы, гелий атомындағы 2 электронның негізгі күйдегі әсерлесу энергиясы 78. 98 эВ. Көп электронды атомдар құрылысын зерттегенде бұларды есепке алып отырады. Сонымен бірге әр электронның орбита бойымен қозғалысында туатын электр магниттік өрісі мен электронның ішкі магниттік моменттерінің әсерлесуі де қосымша байланыс энергиясын тудырады. Осының нәтижесінде атом спектрлерінде нәзік түзілісті, ал электрон мен ядроның магниттік моменттерінің өзара әсерлесуінен аса нәзік түзілісті көреміз. Қазіргі замандағы кванттық электр динамикасында атом электрондарының вакуум құрамындағы виртуалды бөлшектермен әсерлесуін де есептеп атом құрылысының мұнан да күрделі екеніне көз жеткізуге болады.
Атом құрылысын білу көптеген физикалық және химиялық үрдістердің мәнін түсінуге жол ашады. Атом құрылысының қарапайым моделін Резерфорд, Бор және т. б. ғалымдар жасады. Бұл модельдер бойынша әрбір атом протон, нейтрон және электрон бөлшектерінен тұрады. Протон мен нейтрон ядроны құрайды. Электрондарға қарағанда ядро ауырырақ болады. Атомның аз көлемін құрайтындығына қарамастан атомның негізгі массасы ядроға шоғырланған. Белгілі бір заңдықтылықтарға сәйкес электрондар ядроны айналып жүреді. Ядро екі санмен-атомның реттік нөмірімен (2) жеке массалық санмен (А) сипатталады. Паули ұстанымы деп аталатын заңға сәйкес электронды толық сипаттау үшін кез келген атомның электрондарын электрондық конфигурация түрінде көрсетуге мүмкіндік беретін 4 квант сандары пайдаланылады. Сонымен ядро заряды 2, массалық сан А және квант сандары арқылы периодтық жүйедегі кез келген атомды сипаттауға болады. Атомдардың түрін «
нуклидтер»
деп атайды. Реттік нөмірлерінің (2) мәндері бірдей, бірақ массалық сандары (А) және ядродағы нейтрон сандары әртүрлі нуклидтерді «
изотоптар»
деп атайды. Табиғаттағы көптеген элементтер негізінен изотоптар қоспасы түрінде кездеседі.
Кейбір элементтердің изотоптары тұрақсыз: өз-өзінен ядролары ыдырап жатады. Ондай изотоптарды «
радиоактивті»
деп атайды. Бұндай ядролардың ыдырау процесі нәтижесінде а-немесе Р-бөлшектер, кейде ү-сәулесі бөлінеді. Бұндай радиоактивтік ыдыраулар ешқандай сырт себепсіз өз-өзінен табиғи түрде жүріп жатады. Бастапқы санмен салыстырғанда ядроның жартысының ыдырауы - «
жартылай ыдырау»
деп аталады. Кейінірек радиоактивті ыдырау тек табиғи түрде ғана емес, атомды протон, нейтрон және а-бөлшектермен
«атқылау»
арқылы жасанды түрде де жүргізуге болатындығы анықталды.
Ядролық реакциялар кезінде (табиғи және жасанды өзгерістердің екеуінде де) заряд және масса сақталу заңы сақталады, сондықтан теңдеудің сол жағындағы заряд пен массаның жиынгығы оң жағындағы зарядпен пен массаның жиынтығына тең болуы тиіс.
Атомның электрондық және ядролық қүрылысын білу химиялық факторларды пайдалы жүйелеуге мүмкіндік беріп, химияны түсінуді және зерттеуді жеңілдетеді Химиялық реакциялар кезіңде негізінен атомның сыртқы бөліпндегі электрондар өзара әрекеттесетіндікген, химиктер үшін электрондар маңызды бөлшектер болып саналады. Атомдардың электрондық құрылысының салдарынан периодтық жүйедеп элементтер қатарлар мен бағаналарға орналасады. Периодтық жүйеде жеті период, сегіз топ бар.
Сыртқы қабаттағы электрондар саны топтың нөміріне, ал электрондық қабаттар саны периодтың номеріне сәйкес келеді. Әрбір период сілтіЛік металмен басталып асыл газдармен аяқталады. Элементтің ең жоғарғы тотығу дәрежесі топтың нөмірімен анықталады. Тек, фтор(-І), мыс, күміс, алтын (+1 және +2; +1 және +2; +1 және +3) тотығу дәрежелерін көрсетіп бұл ережеге сәйкес келмейді.
Үлкен периодтарда элементтердің белгілі бір санынан кейін: 4-ші және 5-ші периодтарда-10 элементтен кейін, 6-шы және 7-периодтарда-24 элементтен кейін қасиеттері қайталанып отырады. Осы құрылыс топтарды негізгі және қосымша топшаларға бөлуге негіз болады. Негізгі топша элементтерімен қосымша топша элементтерінің қасиеттерінде айқын айырмашылық бар. Мысалы 1 топ элементтері Li, Na К, Rb, Сs, Fr - нағыз металдар, тотығу дәрежелері+1, ал осы топтың қосымша топшасында орналасқан Сu, Аg, Аu элементтері электрохимиялық кернеу қатарының соңында орналасады. IV топтан бастап негізгі топша элементтерЗ ЭН4, ЭН3, ЭН2, ЭН құрамды үшқыш сутекті қосылыстар түзеді. Үлкен периодтардағы химиялық элементтердің қасиеттерінің металдықтан бейметалдыққа ауысуы өте баяу жүретіндіктерден период аяғындағы бейметалл элемештер аз болады. Мысалы, 4-периодта -мышьяк, селен, бром, ал 5-периодта теллур, йод. 6-шы периодтағы лантаннан кейінп (2=57) 58-71 арасындағы 14 элемент қасиеттері жағынан лантанға үқсас болғандықтан лантаноидтар деп аталады. Бұлар химиялық қосылыстарында +3 тотығу дәрежесін көрсететін күміс тәріздес ақ түсті металдар, сумен 2Э+6Н20=2Э(ОН) з +ЗН2 сызбанұсқасы бойынша әрекеттеседі 7-ші периодта актинийден кейін (2=89) орналасқан 90-103-ші реттік нөмірлі 14 элемент - «
актиноидтар»
деп аталады.
Ядро зарядының өсуіне қарай химиялық элементтердің қасиеттерінің периодты түрде өзгеруі олардың электровдық қабаттарының құрылысына тікелей байланысты болады, себебі соңғы қабаттағы элетрондардың энергия запасы жоғары болғандықтан химиялық байланыс түзуге қатысады.
Бұдан шығатын қорытынды: элементтердің қасиеттерінің периоды қайталануының себебі: атомдардың электрондық конфигурацияларының периодты түрде қайталануында екен. Бірақ, элементтердің қасиеттерінің периодты қайталануы сыртқы энергетикалық деңгейдің құрылысымен де байланысты (сі-және Г-элементтерде сыртқы қабаттың астындағы 2-ші және 3-ші деңгейлерінде болады. )
Период бойынша сілтілік металдан галогенге қарай атом радиусы кішірейсе, топ бойынша жоғарыдан төмен қарай атом радиусы ұлғаяды. Мысалы, литий атомының радиусы 0, 158 нм болса, натрийдікі-0, 171 нм. Әрбір топ ішінде жоғарыдан төмен қарай элементтің иондану потенциалы кішірейсе, период бойынша солдан оңға қарай үлкейеді. Мысалы, литийдің иондану потенциалы 632, цезийдікі-376, ал неондікі - 2064кДж/моль.
№1. Фотоэффектінің ұзын толқынды (қызыл) шекарасы калий үшін 0, 6 мкм-ге тең. Электронның шығу жұмысын джоульмен анықтаңдар.
№2. Егер электронның шығу жұмысы 2 эВ-қа тең болса, калий үшін фотоэффектінің қызыл шекарасы қандай болады?
№3 . Металды толқын ұзындығы λ жарықпен сәулелендірген кездегі фотоэлектронның υ жылдамдығын және кинетикалық Е энергиясын табыңдар.
№4 . Сәулелердің толқын ұзындығы 500 нм болса, фотон энергиясы
(h=6. 63*10 -34 Дж*с)
№5.
Көздің талмай қабылдайтын қуаты 2*10
-9
Вт. Толқын ұзындығы 0, 5 мкм жарықты қабылдайды. 1с ішінде көз торына түсетін фотон саны
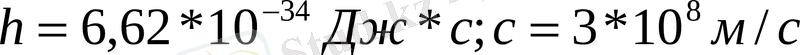
№6.
Қызыл жарықтың ауадағы толқын ұзындығы 775 нм. Толқын жиілігін анықтаңыз (с=
 м/с)
м/с)
№7.
Вакуумдық диодтағы кернеу 45, 5 В. Диодтың катодынан ұшып шыққан электронның анодқа соғылу жылдамдығы (
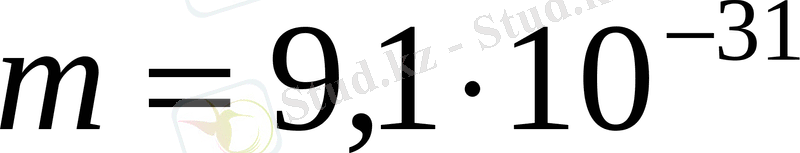 кг,
кг,
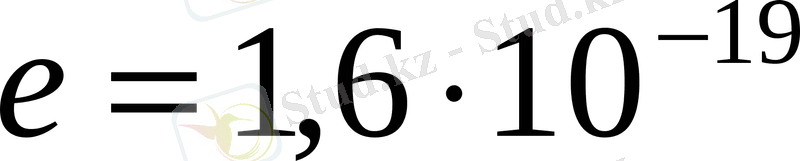 Кл)
Кл)
№8
. Фотоэффектіні түсіндіру үшін толқын ұзындығы
 сәуле порциясына берілетін энергия:
сәуле порциясына берілетін энергия:
№9 . Электронның цезий бетінен шығу жұмысы 1, 6*10 -19 Дж. Цезий бетіне толқын ұзындығы 450 нм болатын сәуле түссе, фотоэффект байқала ма?
№10.
Рентген түтікшесі 50 кВ кернеумен жұмыс істейді. Сәуле шығарудың минимал толқын ұзындығы (
 Дж
Дж
 ; e=
; e=
 Кл) :
Кл) :
№11.
Электрон үдетуші өрісте потенциалы 200 В нүктеден потенциалы 300 В нүктеге орын ауыстырады. Бастапқы жылдамдығы нөлге тең болса, электронның соңғы алған жылдамдығын анықтаңыз (
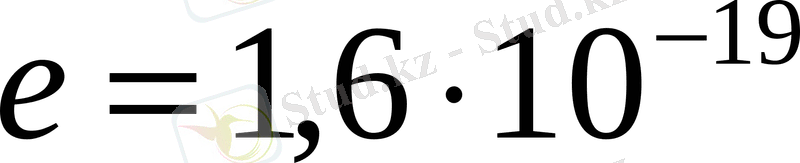 Кл;
Кл;
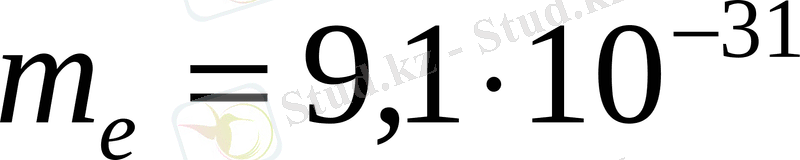 кг) :
кг) :
№12. Өзіне келген әр түрлі жиіліктегі сәулелердің энергиясын толық жұтып алатын денені қалай атаймыз?
№13.
Квант энергиясы электронның тыныштық энергиясына тең электромагниттік сәуле шығарудың толқын ұзындығы (h=6. 62*10
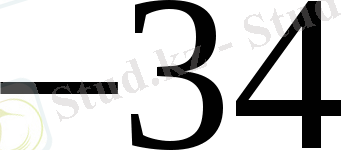 Дж*с,
Дж*с,
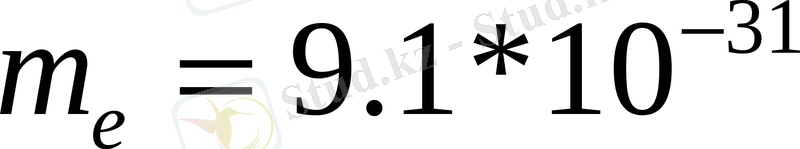 кг)
кг)
№14. Радиостанция 2 МГц жиілікпен жұмыс жасайды. Станция шығара алатын толқын ұзындығы (с = 3·10 8 м/с)
№15.
Ұзындығы
 ,
,
 жылдамдығымен таралатын толқын жиілігін анықтайтын формула
жылдамдығымен таралатын толқын жиілігін анықтайтын формула
№16
. Егер рентген сәулелерінің максимал жиілігі
 болса, рентген түтігінің катоды мен аноды арасындағы потенциалдар айырмасы.
болса, рентген түтігінің катоды мен аноды арасындағы потенциалдар айырмасы.
№17 . Фотон энергиясы 2эВ сәуленің толқын ұзындығын табыңыз.
№18.
Толқын ұзындығы 400 нм-ге сәйкес квант энергиясы неге тең? (h=6. 63*10
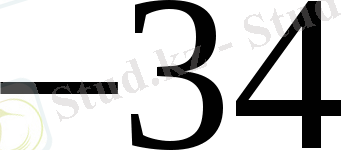 Дж*с, с=3*10
Дж*с, с=3*10
 м/с)
м/с)
№19. Жарықтың ауадағы толқын ұзындығы 650 нм. Толқын жиілігін анықтаңыз.
№20.
Вакуумдық диодтағы кернеу 5, 5 В. Диодтың катодынан ұшып шыққан электронның анодқа соғылу жылдамдығы (
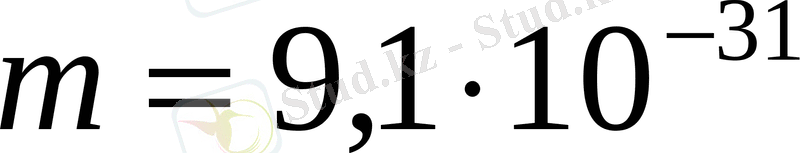 кг,
кг,
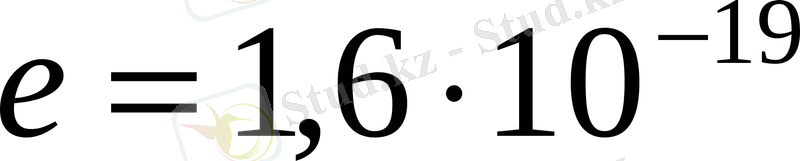 Кл)
Кл)
№21. Қуаты 100 Вт жарық көзі 1 секунтта 5*10 20 фотон шығарады. Сәуле шығарудың орташа толқын ұзындығын табыңдар.
№22. Егер А спектрлік класына жататын жұлдыз атмосферасының температурасы Т 20 000 К болса, оның энергетикалық жарқырауын (сәуле шығару қабілетін ) анықтау керек.
№23. Фотоэффектінің ұзын толқынды (қызыл) шекарасы калий үшін 0, 6 мкм-ге тең. Электронның шығу жұмысын джоульмен анықтаңдар.
№24.
Эвдиометрде 24 мл сутек пен 15 мл оттектен тұратын қоспа қопарылыс бергенде су түзілген. Қопарылыстан кейін қоспада қандай газ қалған, оның көлемі мен массасы қандай?
№25.
26Fe, 14Sі, 31Ga Атомдарының электрондық және графиктік формулаларын жазыңдар.
№26.
32 г мыс оттекпен әректтескенде 155 кДж жылу бөлінеген.
Осы реакцияның термохимиялық теңдеуін құрыңдар.
№27.
29 Cu, 46 Pd, 15 P Атомдарының электрондық және графиктік формулаларын жазыңдар.
№28.
Зат мөлшері 0, 3 моль, 3моль, 30 моль болатын хлорсутекте қанша молекула бар?
№29.
21 Sc, 33 As, 11 Na Атомдарының электрондық және графиктік формулаларын жазыңдар.
№30.
Ядросында 7 протон мен 8 нейтрон бар бейтарап атомның электрондық қабықшасында қанша электрон бар. (7 электрон)
№31 . Протонның, нейтронның, электронның массалық саны мен заряд саны
№32. Жарықтың екіжақтылығы (толқындық-корпускулалық)
№33 . Планк тұрақтысы (Дж*с) және (Эв*с) шамасы бойынша (Һ=6, 62*10 -34 Дж*с), (Һ=4, 136*10 -15 эВ*с)
№34. Ультракүлгін гамма, рентген, инфрақызыл сәулелерінің қайсысының жиілігі жоғары (гамма сәуле) Толқын ұзындығы үлкені (инфрақызыл, ультракүлгін, рентген, гамма)
№35 . Электрон массасы қаншаға тең (m е =9, 1*10 31 кг)
№36. Ваккумдағы электромагниттік сәулелердің тарлау жылдамдығы (с=3*10 8 м/с)
№37 . Электрон сутегі атомының бірінші энергетикалық деңгейінен екіншісіне ауысқанда жиілігі 4, 57*10 14 Гц сәуле шығады. Сонда атомның энергиясы қаншаға өзгереді?
№38.
Сутегі атомы энергиясы Е
1
=1, 7 эВ тұрақты күйден энергиясы Е
2
=6, 8 эВ күйге өткенде оның атомы шығаратын жарықтың толқын ұзындығын анықтаңдар.
№39.
Толқын ұзындығы 5*
10-
7 м-ге тең жарық квантының энергиясын есептеңдер?
№40.
Цезийдің бетінен ақ жарық түсіп тұр. Егер түскен жарықтың жиілігі 5*10
14
Гц болса, фотоэффект байқала ма? Цезийдің электронының шығу жұмысы 3, 04*10
19
Дж.
№41. Мынадай элемент атомдарының ядро зарядын анықтаңдар:Ca, Fe, Si, Mn
№42.
Реттік нөмірлері берілген элементтердің пеиодын, қатарын, тобын анықтаңдар.
І топ: 7, 12 ІІ топ: 17, 23 ІІІ топ: 30, 35. 41
№43.
Мына элементтерді металдық қасиетінің өсуі бойынша орналастырыңдар:
бор, бериллий, көміртек, литий С В Ве Lі
№44.
Берілген элементтердің қайсысында айқын бейметалдық қасиет басым: фосфор, алюминий, кремний, күкірт, фтор, хлор
Бор постулаттары. Бор жасаған сутегi атомының моделi
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz