Электрохимия: негізгі түсініктер, гальваникалық элементтер және электролиз үдерістері


Сәрсен Аманжолов атындағы Шығыс Қазақстан мемлекеттік университеті
Реферат
Тақырыбы:Электрохимия жайлы түсінік
Орындаған:Каденова Гүлжазира, Сапарова Камила, Тоқтасынова Жұлдыз
Мамандығы:Қайта өңдеу өндірісінің технологиясы, 2- курс, С-тобы
Қабылдаған: Қабдысалым Кулайгүл
Өскемен-2018
Мазмұны
- КіріспеТеориялық жəне қолданбалы электрохимияның негізгі түсініктері.
Электрохимия пəні. Электрохимияның дамуына қысқаша тарихи шолу
- Негізгі бөлімТерминдер, түсініктер мен олардың анықтамалары
2. 2. Гальваникалық элемент пен электролиз ваннасы жұмыстарының мəні. Гальваникалық элемент.
2. 3. Тотығу-тотықсыздану реакциялырының теориясы.
2. 4 Фарадей заңдары. Электролиз процесіне əсер ететін негізгі факторлар
Қорытынды
Əдебиеттердің тізімі
Кіріспе
Теориялық жəне қолданбалы электрохимияның негізгі түсініктері . Электрохимия пəні. Электрохимияның дамуына қысқаша тарихи шолу Əдетте, электрохимия химиялық реакция энергиясының электр энергиясына (гальваникалық элемент) немесе, керісінше, электр энергиясының химиялық энергиясына (электролиз) айналу процесін зерттейтін ғылым ретінде қарастырылады. Бұл анықтама айтарлықтай анық жəне электрохимияның теориясы мен тəжірибесінің үлкен аймақтарын қамтиды. М. В. Ломоносов өз заманында-ақ электрлік жəне химиялық құбылыстардың арасында терең байланыс бар екенін байқаған.
1752 ж. ол өзінің «химиясыз электрліктің ақиқат екенін мойындату мүмкін емес» деген пікірін айтты. Бірақ бұл байланысты зерттеу электр энергиясының қажетті көзінсіз мүмкін болмады, ол шет елде тек XIX ғасырда ғана пайда болған еді. 1791 ж. биолог Л. Гальвани өзінің «Бұлшық ет қозғалысы кезіндегі электрліктің күші туралы трактат» жариялады. Атмосфералық электрліктің препарирленген бақалардың бұлшық еттерінің жиырылуына əсерін зерттеу мақсатымен Л. Гальвани оларды темір сымдарға арқы миына енгізілген мысты біліктің көмегімен іліп, күннің күркіреуін күтті. Бұл кезде ол егер жел ілінген бақаларды шайқаса жəне олар аяқтарымен мысты ілгектерге бекітілген темір сымға жанасса, онда олардың бұлшық еттерінің қатты жиырылуы байқалатын аңғарды. Осылайша, алғаш рет кездейсоқ əртүрлі екі металдардан (темір, мыс) тұратын жəне ерітіндімен (жануар тканьдеріндегі сұйықтық) жанасқан гальваникалық элемент жүзеге асырылды. Л. Гальванидің бұл жаңалығы зерттеушілерді жаңа құбылыстарды зерттеуге итерді. Л. Гальвани тəжірибелері негізінде физик А. Вольта мынадай тұжырымға келді: бақалардың бұлшық еттерінің жиырылуына əсер ететін электр энергиясы əртүрлі екі металдың жанасуымен бірге пайда болады.
Осы гипотезаға сүйене отырып, А. Вольта 1799 ж. бірінші рет электр энергиясының химиялық көзін тұрғызды. Ол бір-бірімен қосарлана жанастырылған жəне қышқылмен ылғалдандырылған суконды төсемелермен бөлінген мысты жəне мырышты орамалардан тұрды:
мыс қышқыл мырыш мыс қышқыл мырыш мыс…
Мұндай тізбектей жалғанған гальваникалық элементтер қатарынан тұратын құрылғы вольт бағанасы деген атқа ие болды.
Вольт бағаналарының ашылуына байланысты ізінше бірнеше негізгі сұрақтар пайда болды, оларды біртіндеп шешу бірінші ретті тапсырмадан туған жаңа ғылым - электрохимияны құрады. А. Вольттың гальваникалық элементтің электрлік энергиясы екі түрлі металдардың жанасуымен бірге туындайтыны туралы болжамдары (жанасу теориясы) ғылымда ұзақ уақыт бойы сақталып қалды. Сонымен қатар бірқатар зерттеушілер энергияның көзі ретінде элементтің жұмысы кезіндегі жүретін химиялық процестерді қарастыруды жөн көрді.
XIX ғ. екінші жартысындағы термодинамиканың дамуы гальваникалық элементтің энергиясы жөніндегі сұрақтарды термодинамиканың бірінші жəне екінші бастамасына сүйене отырып қарастыруға мүмкіндік берді. Бұл тұрғыда В. Гиббстің (1878 ж. ) жəне Г. Гельмгольцтың (1882 ж. ) зерттеулері үлкен мағынаға ие болды. 1889 ж. В. Нернст гальваникалық элементтің ЭҚК-нің «осмостық» теориясын ашты жəне ЭҚК-ті ерітіндінің осмостық қысымымен байланыстыратын теңдеу ұсынды. Бұл жасанды, металдардың ерітіндіден иондарын тебетін «еру қысымы» туралы көзқарас тұрғысынан физикалық мəні жоқ теория қазіргі кезде қолданыстан шығып қалды. Нернстің теңдеуі басқа, нағыз термодинамикалық негізге ие болды.
1890 ж. В. А. Тюрин элементтің ЭҚК-не Нернсттің теңдеуіндегі сияқты термодинамикалық теңдеу шығарды, бұл элементтің электродтары əртүрлі концентрациядағы амальгамалардан жасалған еді.
XX ғасырдың өзінде-ақ Н. А. Изаргышев (1926 ж. ) элементте ЭҚК-нің пайда болу туралы сұрақтарды қарастыра отырып метал иондары мен еріткіштің молекулалары арасында əрекеттесу жүретінін ескере отырып (сольватация энергиясы) ЭҚК-нің туындау себептерін дұрыс түсінуге біршама жақындатты. Энергетикалық зерттеу элементтегі электр энергиясының көзі онда жүретін химиялық процестің энергиясы екенін жəне соңғының ауысуы термодинамиканың жалпы заңына бағынатынын дəлелдеуге мүмкіндік берді. Сонымен Вольттің жанасу теориясы қате сияқты болғанмен, металдар физикасының дамуында екі металдың жанасуы кезінде шынымен де потенциалдардың айырымы туындайтыны дəлелденді. Себебі жұмыс істеп тұрған гальваникалық элементте екі текті əртүрлі металдардың жанасуы болатындықтан, ЭҚК-і ұғымына потенциалдардың айырымы да кіреді. Бұл сұрақ электродтағы потенциал шамасының «абсолютті» нөл мəніне қатысты зерттеулер жүргізген бірнеше Кеңес Одағының электрохимиктерімен (А. Н. Фрумкин, Б. В. Эршлер, М. И. Темкин, В. А. Плесков) де зерттелген. Электролиздің ашылуы химиялық тəсілдермен орындау айтарлықтай қиын болатын тотығу-тотықсыздану процесі сиықты процестерді жүргізуді жеңілдетті. 1807-1808 жылдары Г. Дэви, суға аздап батырылған улы сілтінің бөлшегі арқылы электр тоғын өткізе отырып теріс электрод айналасынан бұрын белгісіз қасиеттерге ие метал шариктерін байқады. Осылайша алдымен сілтілі, артынша сілтілі жер металдары ашылды.
Бұл ашылу C. П. Власовпен бір уақытта жасалды. Г. Дэви зерттеулері жай жəне күрделі денелердіңхимиялық көрінісінің дамуы үшін үлкен мағынаға ие болды (себебі бос күйінде сілтілі металдарды алуға дейін улы сілтілер жай заттар болып саналған) . Электролизді зерттеу негізінде И. Берцелиус соңынан теріске шығарылған химиялық бейімділіктің электростатикалық теориясын ашты. XIX ғ. 30-шы жылдарына қарай ашылған негізгі заңдарға М. Фарадейдің электродтарда бөлінген зат массасын электролиттен өткен электрліктің мөлшеріне қатынасы туралы классикалық зерттеулері жатады. М. Фарадейдің жаңалығы бұрындары М. В. Ломоносов байқаған химиялық жəне электрлік құбылыстары арасындағы байланысты түсіну үшін мағынасы зор болды. Электролиз кезінде химиялық реакцияларды жүзеге асыру мүмкіндігі, оның ішінде тотықсыздану реакциялары, зерттеушілерді электролиз процесін тəжірибелік қолдануға итерді. Осы тұрғыда алғашқылардың бірі Б. С. Якоби болып саналады.
Ол 1838 ж. металды өзінің тұзынан катодтық тотықсыздандыру нəтижесінде əртүрлі фигуралы металдық бұйымдар алу əдісін ашты (гальванопластика) . Осы зерттеулерді ары қарай дамыту барысында катодта металдың тығыз əрі қатты қабатын алу мүмкіндігі туындап, гальваностегияның - металдық бұйымдардың бетіне басқа металдың жұқа қабатын отырғызу (қаптау) технологиясының пайда болуына əкеліп соқты. Мұндай қаптаулардың тəжірибелік мəні өте зор болып саналады, себебі металдарды коррозиядан қорғау (мысалы, темірден жасалған бұйымдарды мырыштау немесе кадмийлеу), метал бетіне ерекше физикалық қасиет беру (мыфсалы, қаттылық) жəне сыртқы түріне əдемілік беру (мысалы, əшекей бұйымдар жасауда) жұмыстарына қолайлы əдіс табылды. Электролиздің ары қарай дамуы металдарды қоспалардан тазарту кезінде де (мысты электрорафинирлеу, 1867 ж., Ф. Г. Федоров) үлкен жетістіктерге жеткізді. Балқытылған тұздарды электролиздеу химиялық тотықсыздандыруда біраз қиындықтар туғызатын металдарды катодтық тотықсыздандырып алуға мүмкіндік берді.
Соның нəтижесінде техника алюминий мен магний сияқты бағалы жеңіл металдармен байытылды (XIX ғ. 80-ші жылдарында, П. Эру жəне Ч. Холл) . Электролиттік тотығу жəне тотықсыздандыру тек металлургияда ғана қолданылмайды. Химия өнеркəсібіндегі көптеген өнімдерді анодтық тотығу нəтижесінде алады (хлор, фтор, гипохлориттер, хлораттар жəне перхлораттар, перманганат, персульфат жəне т. б. ) . халық шаруашылығында суды электролиздеп, ары қарай аммиак пен азот қышқылын өндіруге қолданылатын сутегін алудың маңызы зор. Вольта бағанасын ашқаннан кейінгі гальваникалық элементтерді зерттеудің нəтижесінде Дж. Даниэль жəне Б. С. Якобиден кейін қорғасынды аккумуляторларға өзгертулер енгізген ағайынды Тюдорлар, олардан кейінгі сілтілі аккумуляторларды ұсынған Т. Эдиссон жəне құрғақ батареяларды (құрғақ элементтер) ойлап тапқан П. Р. Багратион (1844 ж. ) еңбектері ғылыми-техникалық дамуға аса зор үлестерін қосты. Жоғарыда келтірілген мысалдарға қарап, электрохимия ұғымының анықтамасы алғашқы айтып кеткеннен де ауқымдырақ аймақтарды қамтитынын көреміз. Толығырақ анықтама беретін болсақ, электрохимиялық құбылыстар деп жанасатын фазалардың шекарасындағы қос электрлік қабаттың қатысумен жəне бөліну бетіндегі заттардың химиялық құрамын өзгерте аяқталатын құбылыстарды айтады. Электрохимиялық құбылыстардың мұндай анықтамасы жоғарыда келтірілгенге қарағанда дұрысырақ, ол шынында да физикалық химияның электрохимия деп аталатын аймағын анық көрсетеді.
- Терминдер, түсініктер мен олардың анықтамалары.
Қазіргі кезде электрохимиялық əдістер қолданбалы электрохимияның негізін қалай отырып жаңаша технологияның əртүрлі салаларында кеңінен қолданылады. Электрохимиялық құбылыстарға міндетті түрде екі фаза қатысады. Көбінесе бұл - метал жəне сұйықтық. Соңғысы иондардан тұратын немесе сулы немесе сусыз электролиттің ерітіндісі немесе иондарға дисссоциацияланатын қандай да бір балқытылған қосылыс. Мұндай фазалардың қасиеттері де электрохимия курсында зерттеледі. Электрохимиялық құбылыстардың өзі де сұйық жəне қатты фазалардың (кейде екі сұйықтық арасында) арасындағы бөліну беттерінде жүреді. Жоғарыда айтылған мəліметтерге сəйкес теориялық электрохимия курсын 3 бөлімге бөлуге болады:
I бөлімі - электролиттер, яғни электролиттердің (негізнен ауыр түсті металдарды алуда жиі кездесетін жəне толық зерттелген сулы ерітінділердің) қасиеттерін зерттеу;
II бөлімі - гальваникалық элементтің термодинамикасы, яғни фазалардың бөліну бетіндегі электрохимиялық тепе-теңдікті зерттеу;
III бөлімі - электродтық процестердің кинетикасы, яғни бөліну беттерінде қос электрлік қабаттың қатысуымен жүретін процестердің жылдамдығын зерттеу.
Электрохимия - бұл электролит-металл немесе жартылай өткізгіш (электродика) шекарасында жүретін процестер мен құбылыстарды, иондық жүйелерді (ионика) зерттейтін ғылым. Электролит ерітіндісі мен балқымасының құрылысын, олардың электр өткізгіштігін, иондық байланысы мен иондардың өзара əрекеттесуін, басқа да қасиеттерін ионика пəні қарастырады.
Электродика пəні - фазалардың (электролит-метал) бөліну шекарасында туындайтын қос электрлік қабаттың құрылысын; бөліну беттері арасындағы тепе-теңдікті зерттейтін электрохимиялық термодинамиканы;
бөліну беттері арасында жүретін процестердің жылдамдықтары бағынатын заңдылықтарды қарастыратын электрохимиялық кинетиканы (электродтық процестердің кинетикасы) ;
тотығу-тотықсыздану реакцияларының жүру механизмдерін қамтиды. Кез келген электрохимиялық түрлендіргіштің негізгі элементі - электрохимиялық ұяшық болып табылады.
Қарапайым зертханалық жағдайда ол екі электрод жүктелген жəне электролит ерітіндісі толтырылған ыдыс түрінде болады.
Электролит - сулы ерітінділерде немесе балқымада иондарға диссоциацияланатын зат.
Электролит ерітіндісі - еркін қозғалатын катиондар мен аниондардан тұратын, бойынан тоқ өткізетін ерітінді. Электрохимиялық жүйелерде бірінші жəне екінші текті өткізгіштер деп бөледі.
- Бірінші текті өткізгіштергебарлық металдармен олардың құймалары, көмір, сондай-ақ кейбір металдардың қатты тотықтары, карбидтері, сульфидтері жатады. Бірінші текті өткізгіштерге тоқтың келуі əр түрлі физикалық құбылыстармен ( қызу, магниттелу) жəне химиялық өзгерістермен түсіндіріледі. Бұл өткізгіштерде тоқ тасушы электрон болып табылады.
- Екінші текті . Онда электр тоғын иондар тасымалдайды. Екінші текті өткізгіштерді нағыз (истинные), қатты, күшті жəне əлсіз электролиттер деп бөледі.
Қатты жағдайда кристалл түзетін, ерітіп жəне балқытқан жағдайда кристалдарының құрылымы иондар түзе бұзылатын заттарды (тұздар, металдардың гидроксидтері) - нағыз электролиттер деп атайды. Күшті электролиттер - сұйытылған ерітіндіде толығымен диссоцияланған күйде болады; əлсіз электролиттер иондарға жартылай (аз) диссоцияланады.
Күшті электролиттер : NaCl, Ca(NO3) 2, HCl, H NO3, NaOH, Ca(OH) 2.
Əлсіз электролиттер: HF, H3PO4, NH3·H2O, C6H5OH, CH3COOH.
Иондармен зарядтардың тасымалдануы кристаллдық торларының дефектілері арқылы жүретін кристалдық заттар қатты электролиттерге жатады. Мысалы, кальций тотығы немесе иттербий (ІІ) тотығы қосылған цирконий (ІV) тотығы. Қатты электролиттер сенсорларда немесе отындық элементтерде қолданылады. Қатты агрегаттық күйінде молекулярлық тор түзетін, сулы ерітінділері иондардан тұрмайтын, өздері де сулы ерітінділері де немесе балқымалары да электр тоғын өткізбейтін заттар электролит еместер деп аталады.
Əрекеттесетін заттардың құрамына кіретін атомдардың тотығу дəрежесін өзгерте жүретін реакциялар тотығу-тотықсыздану реакциясы деп аталады. Тотығу-тотықсыздану реакциясы теориясының негізгі ережелерін төмендегідей тұжырымдауға болады:
- тотығу деп - атомдар, молекулалар немесе иондардың көмегімен электрондарды беру процесін айтамыз, мысалы
Тотығу процесі тотығу дəрежесінің жоғарылауымен жүреді.
- тотықсыздану деп - атомдар, молекулалар немесе иондардың көмегімен электрондарды қосып алу процесін айтамыз, мысалы:
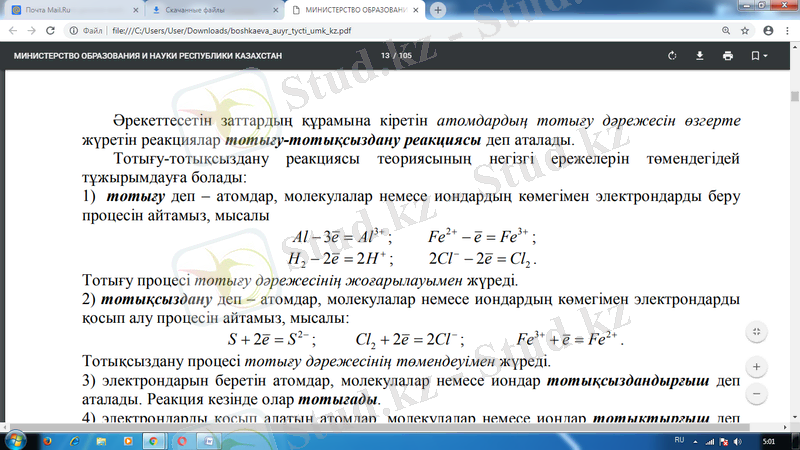
Тотықсыздану процесі тотығу дəрежесінің төмендеуімен жүреді.
3) электрондарын беретін атомдар, молекулалар немесе иондар тотықсыздандырғыш деп аталады. Реакция кезінде олар тотығады.
4) электрондарды қосып алатын атомдар, молекулалар немесе иондар тотықтырғыш деп аталады. Реакция кезінде олар тотықсызданады.
5) тотығу əрқашанда тотықсыздандырумен жəне, керісінше, тотықсыздану əрқашанда тотығумен қатар жүреді, оны келесі теңдеуден көреміз:
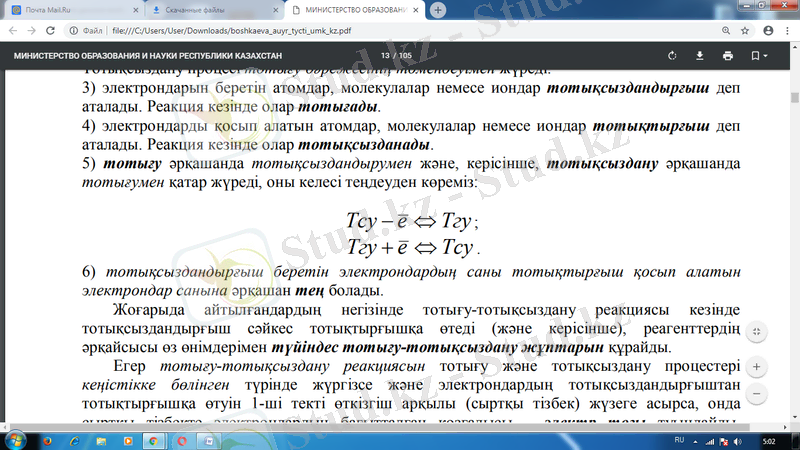
6) тотықсыздандырғыш беретін электрондардың саны тотықтырғыш қосып алатын электрондар санына əрқашан тең болады. Жоғарыда айтылғандардың негізінде тотығу-тотықсыздану реакциясы кезінде тотықсыздандырғыш сəйкес тотықтырғышқа өтеді (жəне керісінше), реагенттердің əрқайсысы өз өнімдерімен түйіндес тотығу-тотықсыздану жұптарын құрайды.
Егер тотығу-тотықсыздану реакциясын тотығу жəне тотықсыздану процестері кеңістікке бөлінген түрінде жүргізсе жəне электрондардың тотықсыздандырғыштан тотықтырғышқа өтуін 1-ші текті өткізгіш арқылы (сыртқы тізбек) жүзеге асырса, онда сыртқы тізбекте электрондардың бағытталған қозғалысы - электр тоғы туындайды. Мұндағы химиялық тотығу-тотықсыздану ревкциясының энергиясы электрлік энергияға айналады. Осындай айналу жүретін құрылғы электр энергиясының химиялық көзі немесе гальваникалық элемент деп аталады.
Гальваникалық элементке кері жүретін процесс - электролиз деп аталады жəне тəжірибеде кеңінен қолданылады. Бұл электрохимиялық ұяшықтардың сыртқы тізбектеріне тұрақты тоқ көздерін қосып (түзеткіш, аккумулятор батареялары, гальваникалық элементтер) жəне оның полюсін электродтарға қосу арқылы іске асырылады.
Мұнда электрохимиялық жүйе гальваникалық элемент сияқты жұмыс істеумен салыстырғанда кері бағытпен қозғалатындай етіп қосылады. Электролиз процесін іске асыру үшін электродтарға (катод, анод) берілетін кернеулердің минималды мəні (Umin) гальваникалық элемент ретінде жұмыс істейтін жүйенің ЭҚК-нен жоғарырақ болуы тиіс.
Нег. əдеб. : 3 [19-33] ; 4 [189-193] ; Қос. əдеб. : 1 [127-128, 266, 305]
2. 2. Гальваникалық элемент пен электролиз ваннасы жұмыстарының мəні. Гальваникалық элемент.
Тəжірибеде қарапайым құрылғының көмегімен тотығу-тотықсыздану реакциясы кезінде электрондардың тотықсызданудан тотығуға ауысуын көрсетуге болады. Қолданылатын құрылғыда электрондар тотықсыздану мен тотығу кезінде металдық сымдар арқылы өтетін кеңістіктерге бөлінген. Алғашқы тəжірибені осы элементтермен Гальвани (1780ж) жəне Вольт (1800ж) өткізген.
Мысалы, тотығу-тотықсыздану реакциясы өтетін өте қарапайым Даниэл элементін қарастырайық:

Даниэл элементінің схемасы 1- суретте көрсетілген. Мырыштың тұзды ерітіндісі бар бір ыдысқа (мысалы, мырыш сульфаты) мырыш қаңылтыры батырылған. Келесі ыдыста мыстың тұзды ерітіндісіне (мысалы, мыс сульфаты) мыс қаңылтыры батырылған. Ыдыстар электролиттің (хлор натрий немесе аммоний нитраты) қоюланған ерітіндісімен толтырылған шиша түтікпен қосылған. Бұл көпір мырыш сульфаты мен мыс сульфаты ерітінділерінің араласып кетпеуі үшін қажет, екі ыдыстың арасында қаңылтырлар сыммен қосылады. Егер мырыш жəне мыс қаңылтырларын метал сымдармен қосатын болса, онда металдардың қаңылтырлары арасындағы потенциалдар айырмасын тізбекке қосылған вольтметр көмегімен өлшеуге болады. Процес барысында мыс мысты қаңылтырға отырады, ал мырыш қаңылтыры біртіндеп ериді. Байқалып отырған потенциалдар айырмасы мырыш жəне мыс иондары арасында жүретін тотығу-тотықсыздану реакциясы нəтижесінде туындайды; оны элементтердің электр қозғаушы күші деп атайды

Электрондар мырышты тотықтыру барысында түзіледі:
Zn → Zn 2+ +2ē (2. 2)
Олар металдық сым бойымен мыс электродтарына тасымалданады жəне мыс электродының жанында түзілген мыс иондарына енеді; олар тотықсызданады:
Сu 2+ + 2ē → Сu (2. 3)
Сонымен, электрондар мырыш электродынан мысқа өтеді. Шарт бойынша тоқ электрондар қозғалысына кері бағыттала жүреді деп қабылданады; яғни элементте пайда болған тоқ мыстан мырышқа қарай бағытталады (2. 1- сурет) .
Тоқ потенциалы жоғары электродтан потенциалы төмен электродқа жүреді. “+” белгісі мыс электродына, ал “-” белгісі мырышқа беріледі. Онда өлшенген потенциалдардың айырмашылығы E Cu -E Zn оң болып саналады. Элементте туындаған тоқ мырыштан мысқа қарай электрондардың тасымалдануынан пайда болады: бұл элементтің «сыртқы» тоғы. Электр тоғының соғылуы (замыкание) ионды ток өтетін хлорлы натрий көпіршесімен қамтамасыз етіледі: бұл “ішкі” тоқ. Теріс (SO2- 4) иондары шын мəнінде Zn2+ иондарына қаныққан мырыш сульфаты ерітіндісіне қарай жылжиды, ал оң (Zn2+) иондары Сu 2+ иондарына кедейлетілген мыс сульфаты ерітінділеріне жылжиды. Тоқ бағытын анықтау барысында сəйкесінше оң зарядтарының қозғалыс , ішкі тоқ мырыштан мысқа қарай жүреді.
2. 3. Тотығу-тотықсыздану реакциялырының теориясы.
Химиялық реакцияларды екі түрге бөлуге болады. Біріншісіне əсер ететін заттардың құрамына кіретін атомдардың тотығу дəрежесі өзгеріссіз болатын реакцияларды жатқызуға болады

Көріп тұрғанымыздай атомдардың əрбір тотығу дəрежесі реакцияға дейін де кейін де еш өзгеріссіз қалып отыр.
Екіншісіне əсер ететін заттардың құрамына кіретін
атомдардың тотығу
дəрежесі өзгеретін реакция түрі жатады, мысалы
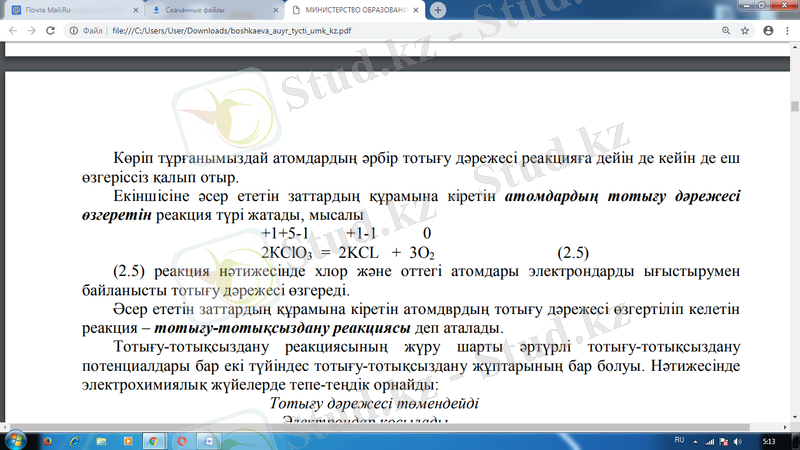
реакция нəтижесінде хлор жəне оттегі атомдары электрондарды ығыстырумен байланысты тотығу дəрежесі өзгереді.
Əсер ететін заттардың құрамына кіретін атомдврдың тотығу дəрежесі өзгертіліп келетін реакция - тотығу-тотықсыздану реакциясы деп аталады. Тотығу-тотықсыздану реакциясының жүру шарты əртүрлі тотығу-тотықсыздану потенциалдары бар екі түйіндес тотығу-тотықсыздану жұптарының бар болуы. Нəтижесінде электрохимиялық жүйелерде тепе-теңдік орнайды:
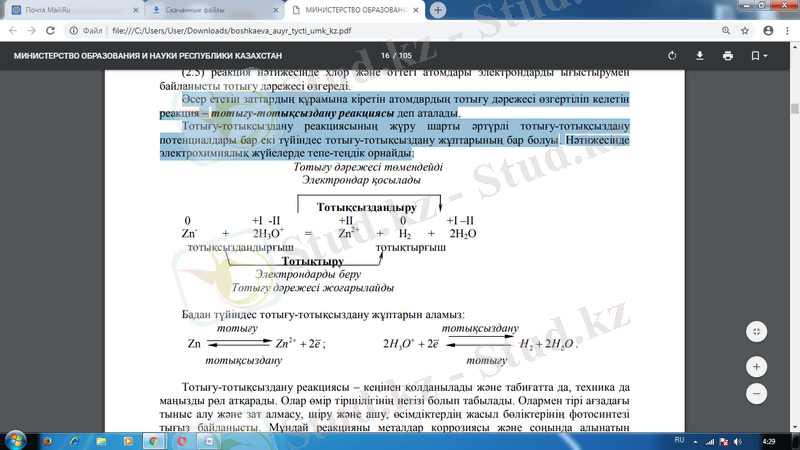
Тотығу-тотықсыздану реакциясы - кеңінен қолданылады жəне табиғатта да, техника да маңызды рөл атқарады. Олар өмір тіршілігінің негізі болып табылады. Олармен тірі ағзадағы тыныс алу жəне зат алмасу, шіру жəне ашу, өсімдіктердің жасыл бөліктерінің фотосинтезі тығыз байланысты. Мұндай реакцияны металдар коррозиясы жəне соңында алынатын электролидтік əдістер процес інде, əр түрлі отындардың жану барысында байқауға болады. Олар табиғаттағы элементтер айналымының гидро- жəне пирометаллургия процесінің негізгі қатарларына жатады. Олардың көмегі арқылы аммиак, сілті, азот, тұз жəне күкірт қышқылдарын жəне басқа да көптеген өнімдер алынады. Гальваникалық элементте тотығу-тотықсыздану химиялық реакциясын жүргізе отырып электр тоғын алуға болады. Жəне керісінше электр энергиясын қолдана отырып химиялық реакцияларды іске асыруға болады.
Мұндай процестер - электролиз процесі деп аталады. Электролиз бойынша алғашқы жұмысты Фарадей жасаған (1834 ж) . Электролизді тереңінен зерттемей-ақ, Даниэл элементі бойынша электролиз жəне тотығу-тотықсыздану реакциясы арасында байланыс жүргізуге болады. Бұл байланыс тотығу-тотықсыздану реакциясының қайтымдылық сипатын анықтайды. Егер 2- суретте көрсетілген қондырғыда қалғандарының барлығын сақтай отырып вольтметрді электрлік генератормен ауыстыратын болса, онда электролизді іске асыруға болады (2-сурет) . Шындығында да генератор тарататын электр энергиясын өздігінен қайтымдылық тотығу-тотықсыздану реакцияларына керісінше жүретін реакцияларды іске асыру үшін қолданыла алады. Мұндайда ұсынылып отырған потенциалдар айырымы элементтердің электр қозғаушы күшінен жоғары болады, яғни 1, 1В.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz