Электрохимиялық анализ әдістері: теориясы мен тәжірибелік қолданылуы


Қазақстан Республикасының Білім және Ғылым министрлігі Ш. Ш. Уалиханов атындағы Көкшетау Мемлекеттік Университеті
Жаратылыстану- педогогикалық факултеті
Аналитикалық химия пәні бойынша
Курстық жұмыс
Тақырыбы: Электрохимиялық анализ әдістері
Орындаған: ХК - 12 тобының студенті
Төлеген Г. А.
Тексерген: Химия және биотехнология
кафедрасының аға оқытушысы
Әбілмәжінова Т. Т.
Мерзімі: 22. 04. 11
Бағасы: , балы
% - дық құрады
Көкшетау 2011 жыл
Жоспар
Кіріспе
Негізгі бөлім
1 Электрохимиялық анализ әдістері
- Электроөлшеу әдісі . . . 9
- Кулонометрия . . . 14
- Кондуктометрия . . . 18
- Полярография. Амперметрлік өлшеу . . . 21
Эксперементтік бөлім
Қорытынды
Қолданылынған әдебиеттер
Кіріспе
Талдаудың физика-химиялық әдістерінің негізі
Қазіргі уақытта ғылыми-зерттеу және өндіріс лабораторияларында көптеген физика-химиялық анализ әдістері қолданылады.
Жалпы анализ әдісі: химиялық, физикалық және физика-химиялық болып бөлінеді. Оның қандай әдіске жататындығы заттың құрамын анықтаудағы химиялық реакция немесе физика-химиялық және физикалық процестің қолданылуына негізделуімен анықталады.
Барлық әдістермен химиялық кұрамды анықтаудың принциптері бірдей ол заттың құрамы оның касиеттерімен аныкталатындығьнда. Басқа бір заттан өзінің кұрамы мен кұрылысы жағынан ерекшеленетін заттың өзіндік жеке өзіне ғана тән қасиеттері болады.
Физика-химиялық анализ әдістері көбінесе өлшегіш приборлар мен құралдардың көмегімен жүргізілетіндіктен, көптеген шетелдік ғылыми әдебиеттерде инстументальді әдістер деп те аталады. Ерігіштік, жұтылу спектрі немесе электрохимиялық сипаттамасы, кристал формасы т. б. аналитикалык қасиеттері заттың құрамына байланысты өзгеріп отырады. Сондьқтан да белгісіз бір заттың қасиетін анықтап оны басқа бір белгілі заттың қасиетімен салыстырып анықтауға болады. Мұндай сапалық анализ үшін берілген затгың немесе оның реакциясының өнімінің бірнеше аналитикалық өзіне сай қасиеттерін зерттеу жеткілікті.
Ерітінді қасиетін сипаттайтын шаманың еріген заттың концентрациясына тәуелділігін анықтау арқылы сандық анализ жасауға болады. Мысалы, ерітіндінің оптикалық тығыздық шамасына байланысты еріген заттың концентрациясын анықтауға болады.
Бір немесе бірнеше заттан тұратын жүйенің құрамы мен қасиетінің өзара қатынасын зерттеу химияның жеке бір саласы болып саналатын физка-химиялық анализ пәнінің негізі.
Физика-химиялық анализ әдістерінің нәтижелерін құрам-қасиет диаграммасымен көрсетеді.
Барлық физика-химиялық анализ әдістері мынандай негізгі топтарға бөлінеді:
- Электрохимиялық.
- Спектрлік (оптикалық) .
- Хроматографиялық.
- Радиометриялық.
- Масс-спектрометриялық.
1. Спектрлік (оптикальқ) анализ әдістері. Спектрлік (оптикалық) анализ әдістеріне: жарықтың жұтылуына байланысты (фотоколориметрия және спектрофотометрия немесе адсорбциялық спектроскопия), спектрлерін пайдалануға негізделген спектрлік анализ, поляриметрия, рефрактометрия және т. б. жатады.
Осылардың ішіндегі қарапайым, аса күрделі приборларды қажет етпейтін әдіс - колориметрия әдісі. Бұл сезімталдығы жоғары әдіспен қоспа түрінде кездесетін көптеген элементтерді анықтауға болады. Сонымен қатар адсорбциялық спектрлік анализ әдісі тек қоспаларды ғана емес, зерттелетін заттың негізгі компоненттерін анализдеуге де қолданылады. Осындай мақсатта көбінесе дифференциалдьқ спектрофотометрия әдісі қолданылады.
Спектрлік (оптикалык) әдістерді пайдаланып жылдам және жоғары сезімталдықпен мүмкін болатын барлық заттарды анализдеуге болады. Анықтау нәтижелері көп жағдайларда фотографиялык немесе механикалық жолмен тіркелінеді.
2. Электрохимияльқ анализ әдістері. Электрохимиялық анализ әдістеріне: кондуктометрия, потенциометрия, полярография, кулоно-метрия, жоғары жиілікті титрлеу және т. б. сезімталдығы жоғары әдістер жатады. Бұл әдістер анализдің орындалуының жылдам жүзеге асуына мүмкіндік туғызады. Мысалы: кулонометриялық әдіспен 0, 01- 0, 1 мкг/мл марганец, темір, күмісті, полярографиялық әдіспен мыс, қорғасын, мырыш, кадмий т. б. элементтердің микрограмды мөлшерін анықтауға болады.
3. Хроматографияльқ анализ әдістері. Хроматографиялық әдіс физика-химиялық анализ әдістерінін ішіндегі ерекше орын алатын заттарды бөлудегі универсалды (жан-жақты) әдіс. Хроматографиялық әдіс негізінен сорбциялы, тұнбалы және таралмалы хроматографиялық әдістер болып бөлінеді.
Сорбциялы хроматография молекулярлы және ионалмастырғьш, тұнбалы хроматография тасымалдаушы-тұндырушы және тұндырушының зарядталған ионы бар ионалмастырғышты болып бөлінеді. Таралмалы және тұнбалы хроматографияның негізгі түрі қағазды хроматография. Сондай-ақ газ қоспаларын бөлуде газ-сұйықтық хроматографиялық анализ әдісі де көп қолданылады. Бұл әдісті көбінесе құрамында қоспасы өте көп мұнай өндеу мен газ өндірісінің өнімдеріне жылдам анализ жасауда қолданады.
Сапалық анализді хроматографиялык жолмен бөлгенде жеке компоненттер бірінен соң бірі анализатор приборға тіркеліп сандық анықтаулар жасалады.
Сирек жер элементтері мен оның аналогтары актинидтерді анықтауда қолданылатын ионалмастырғыш хроматография әдісінің маңызы зор. Бұл әдіс комплекс құрамына кіретін аса ауыр элементтің колонкадан бірінші болып, қалғандары рет-ретімен салмағына байланысты шығуына негізделген.
- Масс-спектрометрлік анализ әдісі. Масс-спектрометрия изотопты анализдеуде химиялық реакция өнімдерінің құрамын анықтауда, газдар, сұйық және қатты заттардағы микроқоспаларды анықтау үшін қолданылады. Бұл әдіс синтетикалық химия мен мұнай-химия өнімдерінің күрделі қоспаларының молекулалық құрамын анықтауда колданылады. Масс спектрометрлік анализ толық автоматталған болуы да мүмкін. Біздің бұрынғы одақ қазіргі ТМД елдерінде алыс қашықтықтағы бақылауға арналғанмасс-спектрометр, сонымен қатар химия өндірісіндегі технологиялық процестерді автоматты түрде реттейтін де масс-спектрометрлер бар.
- Радиометрияльқ анализ әдістері. Радиометриялық анализ әдістерінің ішіндегі анализ, радиометрлік титрлеу және изотопты сұйылтуәдістері.
Активациялық әдіс атомдық реакторларда {10 14 нейтрон/см 2 . сек) нейтрондардың тығыз ағынын пайдаланғанда өте сезімтал болады. Активациялық анализ әдісін пайдаланып, мысалы, германий тотығындағы қоспадан 10 -6 % мышьяктың, қорғасындағы сирек-жер элементтерінің 10 -7 %, темірдегі кобальт пен мыстың 10 -6 % анықтауға болады. Бұл әдісті өндірісте, металлургияда қолдану маңызды.
Үлкен қызығушылық тудыратын жоғары жиілікті электромагнитті өрістегі резонансты жұгылу энергиясын өлшеуге арналған әдіс- радиослектрометриялы анализ әдісі. Бұл әдіс өзінің мәні жағынан оптикальқ әдіске ұксас. Бірақ сәулеленудің қабылдағышы мен генераторы радиотехникалық құрал.
Сонымен қорыта айтсақ физика-химиялық анализ әдістері өндірісті бақылауда өндіріс процестерін басқаруда, ғылыми-зерттеу жұмыстарында кеңінен қолданылады. Физика-химиялық анализ әдістері аналитикалық анықтауды автоматтандырады. Физика-химиялық анализ әдістерін сондай-ақ жоғары тазалықтағы заттарды анализдеуде де қолданады.
Жоғарыда аталып өткен физика-химиялық анализ әдістерінің физикалық әдістерден басты ерекшелігі оның анализ жасаудағы жылдамдығы мен приборлардың жоғары сезімталдығында. Ал көптеген физика-химиялық анализ әдістерінің негізгі кемшілігі аньқтаудағы дәлдіктен сәл ауытқулар.
Анализ жұмыстарын жасаудағы маңызды шаралар
1. Үлгіні таңдау. Анализ нәтижелері анализденетін үлгіні дұрыс тандауға байланысты. Әсіресе анализденетін зат біртекті емес, тау жыныстары, техникалық материалдар сияқты қоспа күйінде болса маңызды. Өте аз мөлшердегі массамен (2- 4 мг) жұмыс істелетіндіктен, анализденетін заттың бөлшектері алдын- ала мөлшері 0, 02 мм аспайтындай етіп жұқаланып ұсақталуы қажет.
- Анализ әдісін таңдау. Анализ жасау әдісін таңдаған кезде әдістің сезімталдық, дәлдік және анықтау жолына байланыстылығын ескеру қажет.
- Анализ нәтижелерінің нақтылығы. Жалпы қальптасқан әдіспен бірнеше нақты аналитикалық анықтаулар жасаған кезде анализ нәтижелерінің шығымдылығы байқалуы қажет. Көп жағдайда бірнеше бірдей анықтаулар жасағанда бір-біріне жақын нәтижелер шыға бермейді, бұл аналитикалық анықтаулар кезінде жіберілген жүйелі қателіктерді көрсетеді.
- Ерітінділер дайындау. Ерітінділерді дайындаған кезде қауіпсіздік ережесін сақтау керек. Эталонды және стандартты ерітінділерді дайындағанда шыны ыдыс қабырғасында алмасу процестері жүріп, нәтижесінде заттың аз мөлшері ерітіндіден жоғальп, орнынанатрий, кремнийқышқылдарының тұздары т. б. шыныдан шығатын қоспалар түзілуі мүмкін. Мұндай құбылыстар сұйытылған нейтралды ерітінділерді кептіргенде байқалады. Сондықтан ұзақ сақталатын ерітінділерді қышқылдап концентрленген күйінде сақтайды.
Өлшеу қателері
Физика-химиялық анализ әдістерімен жұмыс жасаған кезде кез-келген өлшенген шамадан қателер кетуі мүмкін. Оған себепші бірнеше факторлар бар.
- Прибордың дұрыс көрсетпеуі.
- Сырткы жағдайдың әсері.
3. Анализ кезінде заттың жоғалуы немесе керісінше реактивтің басқа компоненттермен ластануы.
4. Есептеулердің дұрыс жүргізілмеуі.
Анализ кезінде себепсіз белгісіз қателер де кетуі мүмкін. Қателер сипатына қарай систематикалық, кездейсоқ және дөрекі қателер деп бөлінеді.
Систематикалық қателер - тұрақты шамаға байланысты анализдің барлық түрінде қайталанып отырады. Оны мүлдем есептемейді немесе оған түзетулер енгізіледі. Мұндай қателерге жеке және инструментальді, сондай-ақ әдіс қателігі жатады.
Кездейсоқ қателер - кездейсоқ жағдайларға прибордың ескілігіне және бақылаушының сезім органына байланысты. Мұндай қателерді анализ кезінде жөндеу мүмкін емес, бірақ қателер теориясы әдісімен оларды азайтуға болады.
Дөрекі қателер - есептеудің дұрыс жүргізілмеуінен жұмысқа тиянақсыз қараудың салдарынан болады, Анализ нәтижелерін өңдеген кезде мұндай қателер есепке алынбайды.
Концентрацияны анықтау әдістері
Зерттелетін компонент концентрациясын анықтау үшін аналитикалық шамаларды тура және жанама өлшеу әдістері қолданылады.
Тура өлшеу әдістері. Тура өлшеу әдістері аналитикалық шамалардың концентрацияға тура тәуелділігіне негізделген. Жалпы түрде бұл тәуелділікті төмендегіше көрсетуге болады :
І=кс
I- аналитикалық шаманың интенсивтілігі,
с - анықталатын компоненттің концентрациясы,
К- анализді жүргізетін жағдайға байланысты тұрақты шама.
Физика-химиялық анализ әдістерінің практикасында белгісіз компоненттің құрамын анықтаудың бірнеше жолдары бар.
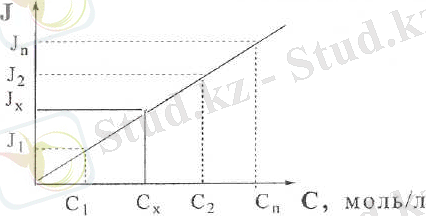
1. Градуирленген график әдісі. Бұл әдіс бойынша аналитикалық шаманың (жұтылу, сыну коэффиценттері, электрқозғаушы күші т. б. ) интенсивтілігі стандардты ерітінділер (5-7) үшін өлшенеді де нәтижелері бойынша градуирленген график І=f(с) тұрғызылады. Ол үшін аналитикалық шама (у) ордината ; ал концентрациясы (х) абсцисса осіне салынады. Содан кейін осы жағдайда анализденетін заттың аналитикалық шамасы өлшенеді және градуирленген график бойынша төмендегіше белгісіз заттың концентрациясын табады.
2. Молярлық қасиет әдісі. Бұл әдісті қолданған кезде аналитикалық шаманың интенсивтілігін бірнеше стандартгы ерітінділер (3) үшін өлшейді де, аналитикалық шаманың интенсивтілігі 1 моль затқа пропорционалды болғанда константалардың орташа мәнін есептейді. Содан кейін анализденетін ерітіндінің аналитикалык шамасын өлшеп,
 пайдаланьп концентрациясын есептейді.
пайдаланьп концентрациясын есептейді.
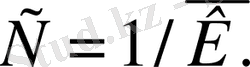
3. Қосу әдісі. Қосу әдісінде анализденетін ерітіндінің аналитикалық шамасыньң интенсивтілігі өлшенеді. Осыдан кейін анализденетін ерітіндіге құрамы белгілі стандартты ерітндіні қосып тағы да интенсивтілігін өлшейді. Алынған нәтижелер бойынша зерттелетін компоненттің концентрациясын төмендегі формула бойынша есептейді:
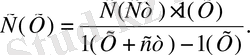
4. Титрлеу әдісі. Титрлеу әдісінде титранттың кезекті мөлшерін қосьш отырып аншаликалық шаманың интенсивтілігін өлшейді. Алынған нәтижелердің тәуелділігі бойынша график І=f(V) тұрғызылады. Графиктегі қисықтардың қиылысқан жерінен абсцисса осіне перпендикуляр сызықтар түсіріп эквивалент нүктесін табады. Соңынан анализденетін ерітіндінің концентрациясын есептейді.
1. Электрохимиялық анализ әдістері
Электрохимиялық анализ әдістері физика-химиялық анализ әдістерінің ішіндегі ең қарапайым және көп тараған түрі. Электрохимиялық анализ әдістері электродтар мен электрод аралық кеңістіктегі процестерге негізделген. Анализдеген кезде кез-келген потенциал, анықталатын заттың концентрациясына байланысты электр өткізгіштік немесе сәйкес титрантпен қажетті компоненттін титрлеу нүктесін анықтау үшін осындай параметрлердің токқа тәуелділігін пайдаланады. Оның көмегімен электр тоғының қатысымен ерітіндіден металдарды немесе олардың тотықтарын тұнба түрінде бөліп, өлшеуге болады.
Электрохимиялық анализ әдістері негізінен 5 топқа бөлінеді:
- Электроөлшеу.
- Кондуктометрия.
- Потенциометрия.
- Полярография.
- Кулонометрия әдістері.
1. 1. Электроөлшеу әдісі
Электроөлшеу анализ әдісі анықтайтын заттьң немесе оны құрайтын бөлшектің салмағын химиялық таза және тұнба түріндегі ерітіндісіне салынған электродтан тұрақты электр тоғын өткізу арқылы анықтауға негізделген. Электродта мыс сияқты металдың бөлінуі немесе қорғасынның тотығы (РЬО 2 ) түзілуі мүмкін. Электролиз кезінде түзілген металл тотықтарын өлшеп және бөлінген тұнба салмағы бойынша анализденетін ерітіндідегі заттың салмағын анықтайды.
Электролиз кезіндегі химиялық процестер. Электрохимиялық анализ әдістеріндегі химиялық процесс Фарадей заңдарына негізделген.
Заттың электролиз кезіндегі бөлінген мөлшерімен электр ерітіндісінен өткен ток мөлшерінің байланысы Фарадейдің 1-заңымен анықталады.
1-заңы. Электродта бөлінген заттың массасы зерттелетін ерітіндіден өткен электр тоғының мөлшеріне пропорционал.
2-заңы. Әртүрлі ерітінділерден бірдей электр тоғы өткен кезде бөлінетін зат мөлшері олардың эквивалентіне тура пропорционал:
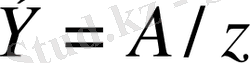
А - атомдық салмақ; z -валенттік.
Сонымен тұрақты ток күші I кезінде электролиз процесіндегі электродта бөлінген заттың мөлшерін уақытқа байланысты төмендегі формуламен есептеуге болады:
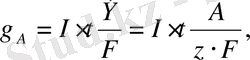
мұндағы
 - электродта бөлінген зат массасы
(r) ;
- электродта бөлінген зат массасы
(r) ;
I- ток күші (а) ;
Ғ- Фарадей саны - 96500 кулон;
Э- анықталатын заттың грамм-эквиваленті (г) ;
Э/Ғ - электрохимиялық эквивалент-электролиттен электр тоғы өткенде электродта бөлінген зат мөлшері.
Мысалы:
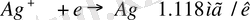
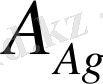 = 107, 8682 z= 1,
107, 8682/1=107, 8682мг/к
= 107, 8682 z= 1,
107, 8682/1=107, 8682мг/к
Э/Ғ = 107, 8682/965000=1, 1178-1, 118мг/к
Электродта 1
 зат бөлінгенде
зат бөлінгенде
 =Э
және
=Э
және

Ғ
- кез-келген заряд тасымалдаушы заттың 1
 .
.
Басқа сөзбен айтқанда электролиттен
1Ғ
электр тоғы өткенде электродта 1
 зат бөлінеді.
зат бөлінеді.
Ерітіндіден тұрақты электр тоғын өткізгенде электролит катиондары тоқ көзінің электрондарының әсерінен катодта валенттігі төмен иондарға тотықсызданады. Тотықсыздаңу өнімдері катодта жиналады да еріген заттың молекуласымен, ерітіндімен немесе соңынан электрод материалымен әрекеттеседі. Бұл кезде аниондар анодта тотығады. Сондықтан да электролиз кезіндегі химиялық процесс - тотығу- тотьқсыздану реакциясы деп қарастырылады.
Катодта өтетін тотықсыздану процесі - катодты тотықсыздану, анодтағы тотығу процесі - анодты тотығу дец аталады.
Мысалы: СuSО 4 сулы ерітіндісін қарастырайық.
КатодтаСu бөлінеді:
Сu
2+
+2е
 Сu.
Сu.
Анодта О 2 бөлінеді:
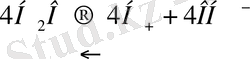
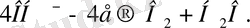
Бұл кезде ерітіндіде Н 2 S0 4 жиналады:
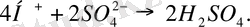
Анодтағы газ күйіндегі О 2 тузілуі OH - ионының SО 4 2- ионымен салыстырғанда оңай тотығатындығымен түсіндіріледі.
Электроөлшеу әдісінің екі түрі кездеседі.
1. Электродтағы заттың бөлінуі сыртқы ток кезінен келетін тұрақты ток әсерінен іске асады (аккумуллятор, токты тежегіш т. б. ) . I
2. Тұрақты ток анализденетін ерітіндіге гальваникалық жұпты енгізгенде (сыртқы токтың қажетінсіз) пайда болады.
Электроөлшеудің бұл түрі - ішкі электроөлшеу деп аталады.
Гальваникальқ жұп - бір-бірімен жалғасып қосылған 2 металды өткізгіш электродтан тұрады.
Электроөлшеу анализ әдісін құрамында көп анықталатын заты бар ерітінді құрамын анықтауда пайдалануға болады. Ішкі электролиз әдісімен анализ жасағанда күрделі приборлар мен құралдардың қажеті жоқ, бұл тек металдардың аз мөлшерін анықтауға қолданылады.
Электроөлшеу әдісі аналитикалық химия практикасында, әсіресе түсті металдар мен олардың қоспаларын зерттеуде кеңінен қолданылады. Бұл өте қарапайым, ыңғайлы және дұрыс нәтиже беретін әдіс. Электроөлшеу әдісімен анықтау жұмыстары жылдам орындалады. Ал оның кемшілігі көп жағдайларда анықталатын заттың толық тұнбаға түспеуінде.
Электролиз кезінде бөлінетін зат мөлшері тұрақты ток көзіне, температура, ток тығыздығына және электрод түріне байланысты болады. Электролиз процесінде көбінесе платиналы электродтар қолданылады. Олардың формалары әртүрлі торлы цилиндр, оралмалы анод спираль және т. б. болады. Әр түрлі формалы электродтар анализдің орындалуын жылдамдатады (24-сурет) .
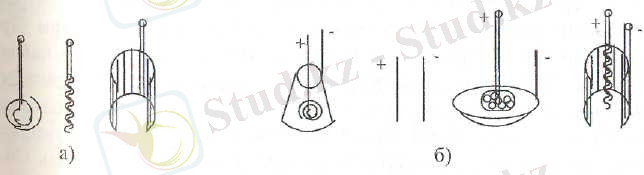
24 - сурет. Электрод түрлері (а), электрод жұптары (б) .
Платиналы электродтар қымбат болғандықтан платииалы емес тантал, вольфрам, никель т. б. металдардан жасалған электродтар қолданылады.
Әртүрлі элементтерді бөлу үшін температура, ортаның рН-ы, электролит құрамы т. б. түрлі жағдайлар қажет. Мысалы металды мыс катодта бөлу және РbО 2 түрінде анодта бөду азоттықышқыл (HNO 3 ) ортада жақсы жүреді, ал Ni бұл ортада бөлінбейді. Бұл әр түрлі иондардың электродтарға ионды беруі немесе алуының әртүрлі жүретіндігімен түсіндіріледі.
Электроөлшеу әдісінде бөлінген тұнбаның сипаты үлкен рөл атқарады. Анализде дүрыс нәтиже алу үшін төмендегі талаптар орындалу қажет:
- Тұнба таза және онда басқа бөтен қоспалар болмауы керек.
- Тұнба электрод бетіне жақсы жабысу керек. Егер тұнба нашар жабысса, онда өңдеу кезінде (жуу, кептіру, өлшеу), тұнбаның бір бөлігі жоғалып анализ нәтижесі дұрыс болмайды.
- Электродта жиналған зат құрамы ауадағы оттегі әсерінен өзгермеуі қажет. Кей жағдайда (ток тығыздығы жоғары болса) ұсақ кристалды, бірақ ұсақ тесікті тұнбалар алынады. Мұндай тұнбалар оңай тотығады. Мысалы, аммиак ерітіндісінде мысты тұндырғанда катод бетінде, кептіргенде ауада оңай тотығатын тұнба түзеді. Нәтижесінде алынған анықтаулар біршама жоғары болып шығады.
Ішкі электроөлшеу әдісі. Егер анализденетін металды түзды ерітіндісіне бірі платина, екіншісі кез-келген теріс электрлі металдан тұратын екі пластинканы салып, тізбекті үшінші бір бөлек металл өткізгішпен тұйықтаса, тізбекте электр тоғы пайда болады. Ерітіндідегі металл иондары катодта
(Рt)
зарядсызданады да, металл тұнбасын түзеді. Процесс ерітіндідегі металдың көбірек оң электрлікті күйде болуынан басталады. Ерітіндіде бірнеше металл катиондары болса сәйкес анодтарды
(А1, Zп, Сd Ғе, РЬ)
таңдау кейбір элементтерді бір-бірінен нақты бөлугe мүмкіндік береді. Мысалы, мысты
(Сu)
мырышпен
(Zn)
бөлуді нейтралды ортада анод ретінде никелді
(Ni)
пайдаланып жүргізуге болады, бұл ортада
 немесе аммиакты ортада аммоний тартраты қатысында анод ретінде алюминийді
(Аl)
пайдаланғанда
немесе аммиакты ортада аммоний тартраты қатысында анод ретінде алюминийді
(Аl)
пайдаланғанда
 болады. Ішкі электролиз әдісінe арналған приборлар әртүрлі болады. Бір типті приборларда екі электродта анализденетін ерітіндіге батырылады (25 - сурет) .
болады. Ішкі электролиз әдісінe арналған приборлар әртүрлі болады. Бір типті приборларда екі электродта анализденетін ерітіндіге батырылады (25 - сурет) .
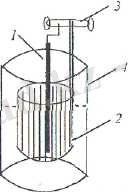
25 - сурет. 1- анод; 2- катод; 3- ұстатқыш; 4- стакан.
Прибордьң басқа түрінде тесікті диафрагма болады, ол анодты кеңістікті катодты кеңістіктен бөліп тұрады. Катодты кеңістік зерттелетін ерітіндімен толтырылады, ал анодты басқа сәйкес электролитпен толтырылады.
Ішкі электролиз әдісін түсті металдардың анализінде, бөгде қоспалардың аз мөлшерлерін анықтауда қолданады.
Есептер:
- Егер 2 валентті кобальттің атомдық салмағы 58, 94 болса оның электрохимиялық эквивалентін есептеңіз.
- Ток шамасьның 5, 3акезінде электролиз кезінде 2, 456гкалий хлориді ыдырау үшін қанша уақыт керек ?
Жауабы: 10, 93 мин.
3. 2 валентті металл тұзының электролизі кезінде 5 мии 32 сек уақытта, ток күшінің 2, 8 а шамасында 0, 2839 г металл бөлінді. Бөлінген металдың электрохимиялық эквивалентін анықтаңыз.
Жауабы:
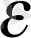 =0, 3054 мг/кулон.
=0, 3054 мг/кулон.
4. Ток күшінің 2, 3 а шамасында, 5 мин уақытта күкірт қышқылының электролизі кезінде қанша көлем сутегі бөлінеді ?
Жауабы: 80, 1 л.
5. Электрохимиялық эквиваленті 0, 3054 мг/к Му 2+ ионы бар тұздың ток күші 1, 8 а, 1, 42 мин уақыттағы электролизінде қанша металл бөлінді. Ол кандай металл ?
Жауабы: (Ni) 0, 056г.
6. Ток күшінің шамасы 1, 7 а болса, 20 мин 10 сек уақыттағы тұз қышқылының электролизі нәтижесінде қанша сутегі мен хлордың мөлшері бөлінеді ?
Жауабы: 0, 23лН 2 және 0, 75гСІ 2 .
7. Ме 2 SО 4 тұзының электролизі кезінде катодта электрохимиялық эквиваленті 1, 36мг/а сек болатын Ме бөліңді. Бұл қандай металл?
8. ZnSO 4 тұзының электролизі кезінде анод пен катодта ңе бөлінеді? Бөлінген металдың электрохимиялық эквивалентін есептеңіз ( мг/а-сек және г/с. сағ ) .
Жауабы: 0, 3387мг/а. сек және 1, 2 г/с. сағ.
9. Құрамында электрохимиялық эквиваленті 0, 093 мг/к Ме 3+ ионы бар тұздың электролизіне 15а ток күші жұмсалса О, 78 г металл бөлінуі үшін қанша уақыт қажет ?
Жауабы: 2712 сек.
10. Тұрақты ток шамасы 0, 19 а болса, 1, 543 г коспаның электролизі кезінде 30 мин уакытта катодта Zn және анодта қорғасын РbО 2 түрінде бөлінеді. Қоспадағы мырыш пен қорғасынның құрамын анықтаңыз.
Жауабы: 75, 8 % Zn және 23, 88 % Рb.
Өздігінен дайындалуға арналған бақылау сұрақтары
- Электрохимиялық анализ әдістері.
- Электролиз кезіндегі химиялық процестер.
- Фарадей заңдары. Электрохимиялық эквивалент.
- Электродтар. Түрлері. Гальваникалық жүп.
- Электролиз кезіндегі ерітіндіге қойылатын талаптар.
- Электроөлшеу әдісі.
- Ішкі электроөлшеу әдісі.
1. 2. Кулонометрия
Фарадей заңына сәйкес злектролиз кезінде бөлінген зат мөлшері ток күші мен оньң өту уақытына тура пропорционал. Ерітіндіден бөлінген зат мөлшері электролиз уакытьна байланысты аныкталады. Электролиз тұрақты потенциалда да жүргізілуі мүмкін. Сондықтан электролиз кезінде жұмсалған ток мөлшерін өлшеу электролизге ұшыраған заттың, өзгеру шамасы болады және аналитикалық мақсаттарға пайдаланылады.
Мұндай аналитикалық әдісті
кулонометриялық анализ әдісі
деп атайды. Егер электролиз кезінде ерітіндіден
Q
кулон өтсе, Фарадей заңы бойынша әрекеттескен зат мөлшері (
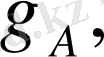 гр
) мынандай формуламен анықталады:
гр
) мынандай формуламен анықталады:
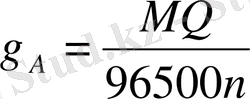 ,
,
мұндағы:
М - тотығушы немесе тотықсызданушы заттың молекулалық салмағы;
n - заттың өзіне қосып алған немесе берген электрон саны.
Кулонометриялық анализ әдісінің ерекшелігі бұл әдіс электроөлшеу әдістеріндегі электролиз нәтижесіңде тек ерімейтін ғана емес еритін де қосылыстар түзілгенде қолданылады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz