Унитиолмен ауыспалы металдардың комплекстері: термодинамика, тұрақтылық және мырыш пен кадмий сульфидтерін синтездеу


КІРІСПЕ
Жұмыстың өзектілігі. Ауыспалы металдардың тиолды комплекстерінің қасиеттері координациялық химияда өте танымал. Бірақ унитиолмен орын басу реакциялары бұрын зерттелмеген. Қазіргі кездегі өзекті болып келетін наноқұрылымды технологиялар саласында жартылай өткізгіштік қасиетері бар бейорганикалық заттардың қасиеттері зерттелген. Металлдардың тиолды комплексті қосылыстары медицинада биологиялық белсенді дәрі - дәрмек түрінде қолданылуы мүмкін болғандықтан, олардың комплекстүзу процесстерін және олардың термиялық ыдырауы теориялық және практикалық жағынан да өте бағалы.
Жұмыстың мақсаты. Ауыспалы металдар - унитиол жүйелеріндегі әрекеттесу сызба-нұсқаларын, түзілген қосылыстардың тұрақтылығын, әр түрлі лигандтардың координациялық сферада болуын және жеке комплекстік қосылыстардың кейбір физика-химиялық сипаттамаларын анықтау және комплекс түзуі мен ыдырауының термодинамика заңдылығын зерттеу. Зерттеудің мақсаты - тиолдардың металдармен ерітіндіде жүретін комплекс түзу процестердің физика-химиялық қасиеттерін зерттеу.
Осы мақсаттарға сәйкес келесі міндеттер қойылды:
- мырыш және кадмий сульфидтерінің жартылай өткізгіштік қасиеттеріне шолу жасау;
- мырыш және кадмий сульфидтерінің қазіргі кездегі синтездеу жолдарына шолу жасау;
- жартылай өткізгіштік сульфидтерді унитиолатты комплекстерден синтездеу;
- синтезделген мырыш және кадмий сульфидтерінің кейбір жартылай өткізгіштік қасиеттерін зерттеу.
Зерттеу әдістері . Комплекстерді сипаттау үшін бірнеше физико-химиялық әдістер қолданылды: элементтiк және функционалдық талдау, дериватография, ИҚ спектроскопия, ЭПР әдістері қолданылды.
Зерттеу объектілері. Ауыспалы металдардың лигандты тиолдармен әрекеттесу процесі. Металдардың комплекстік қосылыстары ғылым мен техниканың әр түрлі салаларында кеңінен қолданылады, организмдердің тіршілігінде маңызды роль атқарады. Металдардың биологиялық белсенді қосылыстарына анемия ауыруын емдеуге қолданылатын және кобальттің физиологиялық белсенді косылысының классикалық мысалы болатын витамин В 12 жатады. Құрамында күкірт бар лигандтар, олардың ішінде унитиол, комплекстік қосылыстарының химиясын зерттеу ете маңызды.
Тақырыптың актуалдығы: Металдардың унитиолатты комплекстерінің сулы ерітінділерін физика-химиялық әдістермен зерттеу арқылы олардың түзілуінің термодинамикалық заңдылықтарын анықтау өте маңызды. Компелексті қосылыстардың құрылымы, реакцияға қабілеттілігі туралы мәліметтер комплекс түзу процестерінің лиганд орынбасу реакцияларының кинетикасын, алуан түрлі каталитикалық және аналитикалық процестерін зерттеуге актуалды.
Жаңашылдығы: Жұмыста металдар мен унитиол комплекс түзу процестерінің сулы ерітінділерінде термодинамикалық заңдылықтары, олардың тұрақтылық, сопропорционирлеу константалары анықталды. Комплесті қосылыстардың электрондық конфигурацияларының табиғаты түсіндірілді. Әртүрлі лигандты комплекстер құрылысы туралы мәліметтер, координациялық қосылыстардағы лигандтардың орын басу реакцияларының кинетикасын, термодинамикасын, олардың қатысуымен өтетін көптеген каталитикалық және биологиялық жүйелерде өтетін процестерді зерттеу үшін аса қажет. Сондықтан, металдардың комплекстік қосылыстарының унитиолмен әрекеттесуін зерттеу өзекті.
Әдебиеттік шолу
- Ауыспалы металдардың күкірттіқосылыстың лигантармен қосылыстарының координациялық химиясы
Ауыспалы металдар тұздарының меркаптосірке қышқылымен комплекс түзудің потенциометриялық зерттеу нәтижелері NiL 2 2 -, NiL 3 4 -, Ni 2 L 3 2 -, Ni 3 L 4 2- және Ni 4 L 6 4 - құрамдағы өте берік полиядерлі комплекстер түзілетінін көрсетті. Комплекстердің тұрақтылық константалары есептелді: log ß 21 =13, 01, logβ 31 =14, 98, logβ 32 =22, 68, logβ 43 =33, 27 и logβ б4 =49, 85. Ұқсас комплекстер тек монотиолдармен ғана емес, дитиолдармен де түзіледі /15/.
В. М. Шульман арқылы /16/ комплекс түзуші және лиганд арасындағы тотығу-тотықсыздану реакциясы тұрғысынан комплекс түзу процестерін сипаттады.
Электрондық тығыздықтың лигандтан орталық ионға қарай ығысуы толық емес деп санауға болады, себебі соңғысы жартылай тотықсызданады. Осы тұрғыдан орталық ионның өрісіндегі лиганд, күмәнсіз, бос лигандпен салыстырғанда тотығудың жоғарғы күйінде болады. В. М. Шульман тиол реагенттерінің ауыспалы металдардың иондарымен әрекеттесуін зерттегенде дисульфидтердің сулы ертінділерде координациялық қосылыстарды түзуге қабілетсіздігін анықталған факт деп есептейді, бұл HS - салыстырғанда -S-S- топтамасының донорлық қасиеттерінің төмендеуімен түсіндіріледі. /16/ жұмысында сулы ертінділердегі ксантогенаттардың әрекеті туралы деректер келтірілген және олардың тұрақтылық ауданы анықталады. Тотырғыштың алғашқы өлшемін SCSOC 2 H 5 ертіндісіне енгізген кезде тотығу-тотықсыздану потенциалы төмендейді. Бұл көптеген сульфгидрилді реагенттерге тән құбылыс күкіртсутектің түзілуімен түсіндіріледі.
Ксантогенат-ионның кобальтпен әрекеттесуі комплекстің жоғарғы беріктігі туралы дәлелдейтін түзілу қисықтарын құруға мүмкіндік береді, бірақ бұл қисықтардың суреттеуін қанағаттанарлық деп мойындауға болмайды. Таза тотықтырылған форманың ертіндісіндегі редокс-потенциалдың өлшеуі егер өзінен қалпына келу константасы белгілі болса комплексті ионның тұрақсыздық сатылы константасының шамасын бағалауға мүмкіндік береді. Со(П) -ң Со(Ш) дейін тотығу процесін В. М. Шульман препаративті жолмен зерттеді. Осы мақсатпен қызғылт-сары кристалды зат болып келетін лутео-катион Со(Ш) ксантогенаты алынды. Бұл зат топохимиялық реакцияның нәтижесінде [CoXanUn 3 ] ° құрамдағы жасыл өнімге айналады: ксантогенат-ион комлекстің ішкі сферасына көшеді. Реакция ертіндіде де қатты күйінде де жүреді, және сірә, жарықпен иницирленеді. Ксантогенат-ион Со(П) «қарапайым» тұздарынан немесе Со(Ш) лутео-тұзынан алынғанына қарамастан өнім Со(Ш) болуына жауап береді.
Сонымен, В. М. Шульман «лигандтың лиганд-тотыққан формасы» (ЛЛТФ) жүйесінің потенциалдарының өлшеуіне негізделген комплексті қосылыстардың тұрақтылық константасын анықтау әдісін ұсынды. Бұл әдіс зерттелетін жүйе компоненттерінің тепе-тендік концентрацияларын анықтау үшін қажетті электродты таңдау кезінде қиындық туғанда әсіресе қолайлы болып табылады, және тиолды лигандтар класына қатысты жеткілікті жоғары жан-жақтылықпен сипатталады.
Лигандтар мен комплекстүзуші-металдар қатары үшін тиолды комплекстер тұрақтылығының кейбір салыстырмалары жасалды. Өзара байланысты тізбектіліктер орнатылды:
а) Cu < Со < Ni
б) тиомочевина < диэтилдитиофосфор қышқылы < меркапто-2этанол< β-меркаптопропион қышқылы < тиогликоль қышқылы <меркаптоянтар қышқылы< глутатион < о-тиосалицил қышқылы < 2-меркаптоэтиламин < цистеин < 2, 3-димеркаптопропанол - олардың мүшелері комплекс түзуге олардың тенденциясының артуы бойынша орналасқан (log k 1тұр сипатталатын көрсетті/15/.
Ю. Н. Кукушкин /16/ауыспалы металдардың комплекстеріндегі ішкісфералық сульфидтік және тиолды лигандтардың реакциялық қабілеттілігін қарастырды. Ауыспалы металдардың комплекстеріндегі S 2- , SH - , S 2 2- және RS - лигандтары алкилдеу, тотығу реакцияларына ұшырайды, этиленді және ацетиленді көмірсутектермен әрекеттеседі.
Кобальттың 8-меркаптохинолинмен (тиоксин) және оның туындыларымен комплекс түзуін зерттеу қызықты болып саналады.
Ішкі комплексті қосылыстардың түзілу процесінің спектрофотометриялық зерттеуі/17/ жүргізілді. Бірақ тиооксинаттардағы металдың валенттік күйі туралы мәселе аяғына дейін шешілмей қалды тиооксинаттардың үлкен тұрақтылығы (рК CoRn = 28, 3) Ме-S дативті π-байланысының түзілуімен түсіндіріледі. Дативті π-байланысы түзілген кезде орталық атомдағы оң заряд артады, бұл оның d-электрондары жылжуының төмендеуіне әкеледі. Сондықтан орталық атоммен байланысқан тиооксин топтары металдардың төмен валентті күйлерін тұрақтандырады. Тиооксиннің Со(П) әрекеттесу кезінде СoR 2 , (рК CoR2 = 26, 7+0, 2) өте тұрақты октаэдрлі комплекстері түзіледі.
Кобальттың тиоционатты комплекстері спектрофотометриялық және потенциометриялық әдістер арқылы сулы ертінділерде де зерттелді. /18/ жұмысында рН=3 және 25° кезінде спектрофотометриялық әдіспен CoSCN + түзілу константасын анықтау нәтижелері келтірілген. Константа көрсеткішінің мәні алынды рК= I0, 3I+0, II (кесте 1. 2. 2. ) . Кейін осы жүйелер 800-ден 700 нм дейін аса ұзын толқынды ауданда зерттелді. 515, 590 және 615 нм кезіндегі жарық сіңіру өлшенді. Тұрақтылық константаларының есептелген мәндері (β 1 = 6, 9 М -1 , β 2 = 28, 9 М -2 , β 3 =I2, I М -3 , β 4 =1, 3М -4 ) негізінде тиоционатты комплекстердің бөлу диаграммасы ұсынылған. 590 және 6I5 нм кезіндегі сіңіру жолдары өтеудің жоғары молярлы коэффициенттеріне ие болады. CoSCN + , Co(SCN) 2 , Co(SCN) 3 - , Co(SCN) 4 2- топтамаларын енгізетін барлық төрт типтердің комплекстері үшін тетраэдрлі конфигурация тән.
Әртүрлі тотықтырғыштар унитиолды әртүрлі өнімдерге дейін тотықтыруға қабілетті болады. Тотырғыш табиғатына байланысты унитиолдың тотығу процесі қандай болсын сатысында тоқталады. Сутегі перекисі, әсіресе екі валентті мыс иондарының қатысуында унитиолды тетрасульфидке дейін тотықтырады. Сулы ертіндіде унитиол сульфотоп бойынша толық және сульфгидрилді топтар бойынша әлсіз диссоциацияланған. /19/ авторымен рН-метриялық титрлеу әдісі арқылы унитиолдың сульфгидрилді топтарының иондану константалары анықталды. /20/ жұмысында унитиол диссоциациясы процестерінің термодинамикалық сипаттамалары және иондық күштің әртүрлі мәндері кезінде сулы ертінділердегі унитиолдың қышқылды диссоциациясының барлық үш константалары анықталды. Унитиолдың сулы ертінділерде рН-ортасына байланысты болу формаларын білуі түзілетін комплекстердің болу мүмкін құрамдарын талқылағанда, сондай-ақ унитиолдың қышқылды диссоциация процестерінің және комплекс түзу процестерінің термодинамикалық сипаттамаларын анықтаған кезде қажет. Унитиолдың берік хелатты комплекстерді түзе отыра металл иондарымен әрекеттесу қабілеттілігі оны ауыр металдардың тұздарымен улануына байланысты ауруларды алдын ала емдеу және емдеу кезінде, сондай-ақ радиоактивті изотоптармен зақымдану кезінде у қайтарғыш (противоядие) ретінде қолдануға мүмкіндік береді . Унитиолдың боялған комплекстерді түзу қасиеті сапалық талдауда оның қолдануына мүмкіндік береді. Унитиолдың комплексті қосылыстарды түзу қабілеттілігіне және оның тотығу-тотықсыздану қасиеттеріне кендердің және олардың қайта өңдеу өнімдерінің фазалық талдаудағы, сондай-ақ элементтерді селективті шығарып алу кезіндегі колдануы негізделген /21/.
Унитиолдың медицинада, химиялық және фазалық талдауда қолдануы оның әртүрлі металдардың иондарымен комплексті қосылыстарды түзу қабілеттігіне негізделген /22-24/.
Со(П) комплекстүзуінің зерттеуі тотықтырғыштар мен лигандтардың қатысуында жылдам жүретін Со(П) →Со(III) ауысуымен қиындайды. Комплекс түзу тепе-тендігінің Со(III) комплекстерін түзу жағына ығысуы Со(II) комплекстерімен салыстырғанда Со(Ш) комплекстерінің жоғары термодинамикалық тұрақтылығына байланысты /25/. Тұрақтылықтағы осындай арақатынасы химиялық байланысқа электростатикалық құраушының (басқа бірдей жағдайда) үлкен үлесімен ғана емес, сонымен бірге d 7 -электрондық конфигурациядағы ионға қарағанда көбінесе комплекстің коваленттік тұрақтылығын қамтамасыз ететін Со 3+ -ң d 6 -электрондық конфигурациясымен түсіндіріледі.
Орынбасушылар өзінің трансәсерінің күші бойынша келесі қатарға орналасады:
Thio, NO
2
, I, SCN > Br, Cl >
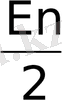 > NH
3
, Py > H
2
O
> NH
3
, Py > H
2
O
Бұл қатар біратомды лигандтар үшін бір комплекстүзуші металдан басқасына ауысқан кезде сондай болып қалады да, бірақ топтар трансәсерінің «абсолюттік шамасының» өзі ауысады.
Лигандтар табиғатының комплекстердің қышқылдық-негіздік қасиеттеріне әсерін қарастыра отырып, қышқылдық қасиеттердің аквадан аминкомплекстеріне ауысқан кезде өзгерудің қарастырылған заңдылығы әрдайым ақталмайтынын ескерткен жөн. Мысалы, этилендиамин комплекстері аммиакаттарға қарағанда аса күшті қышқылдар, ал аммиак NH 2 - CH 2 - CH 2 - NH 2 қарағанда әлсіз негіз болып келеді.
Көлемі үлкен СН
2
- топтары еріткіштер молекулаларының координацияланған NH
2
- топқа жолын қиындатады, бұл комплекстің қышқылдық сипатын жоғарлатуға ықпал етеді. Амин молекуласының координациясындағы индукциялық эффекттің нәтижесінде орталық атоммен азоттың электрондық жұбы орталық атомға тартылады. Сонымен бірге электрондық тығыздық сутегі атомдарынан азотқа қарай ығысады, Бұл сутегі иондарын бөлуге тенденцияның күшеюіне әкеледі. Этилендиамин жағдайында электрондық бұлттың азоттан орталық атомға қарай ығысуы тек азот-сутегі байланысы электрондары есебінен ғана емес, сонымен бірге көміртегі - азот байланыстары есебінен өтелу мүмкін. Сондықтан протонды бөлуге тенденциясының өте күшті байқалуы қажет емес. Сонымен, индукциялық әсер қышқылдық қасиеттердің әлсізденуіне бағытталған. Индукциялық эффекттің әсерімен
 -ден
-ден
 -ға ауысқан кезде ауыр сумен дейтерийдің алмасу жылдамдығының төмендеуін түсіндіреді. Осы факторлардың бірмезгіл және қарама қарсы әсері аммиакты комплекстермен салыстырғанда этилендиамин комплекстері қышқылдық қасиеттерінің күшеюіне әкеледі /26/.
-ға ауысқан кезде ауыр сумен дейтерийдің алмасу жылдамдығының төмендеуін түсіндіреді. Осы факторлардың бірмезгіл және қарама қарсы әсері аммиакты комплекстермен салыстырғанда этилендиамин комплекстері қышқылдық қасиеттерінің күшеюіне әкеледі /26/.
Кәдімгі коваленттік комплекс [Co(NH 3 ) ] 6 Cl 3 қыздырған кезде қайтымсыз бұзылады:
[Co(NH
3
]
6
] Cl
3
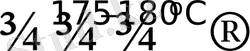 [Co(NH
3
)
5
Cl] Cl
2
+NH
3
[Co(NH
3
)
5
Cl] Cl
2
+NH
3
6[Co(NH
3
)
5
Cl] Cl
2
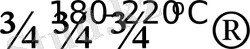 6CoCl
2 +
6NH
4
Cl+22NH
3
+N
2
.
6CoCl
2 +
6NH
4
Cl+22NH
3
+N
2
.
Ерітіндіде қайтымсыз реакция баяу жүреді
[Co(NH
3
)
6
]
3+
+H
2
O
 [Co(NH
3
)
5
H
2
O]
3+
+ NH
3
.
[Co(NH
3
)
5
H
2
O]
3+
+ NH
3
.
Я. Бьеррумның анықтамаларына /22/ сәйкес [Co(NH 3 ) 6 ] 3+ ионы термодинамикалық тұрғыдан тек қана NH 3 концентрациясы 10 -5 моль/л жоғары ерітінділерде тұрақты болып келеді. [Co(NH 3 ) 6 ] 3+ комплексі тек қана сулы ерітіндіде емес, сондай-ақ оны суықта сілтімен өңдеу кезінде де ыдырамайды. Осыған байланысты коваленттік комплекстік қосылыстардың метатұрақтылығы, немесе тепе-тендіксіздігі туралы айтуға болады, бірақта осы метатұрақты күйлердің тұрақтылығы тәжірибе жүзінде жоғары болып қалады.
Сонымен, [Co(NH 3 ) 6 ] Cl 3 -ң жұптаспаған электрондары жоқ және диамагнитті болып келеді, олай болса Со 3+ төрт жұптаспаған электрондардың болуымен сипатталады және парамагниттік қасиеттер көрсету мүмкін. Валенттік байланыстар теориясы комплекстердің оптикалық қасиеттерін, байланыс беріктігінің сандық сипаттамасын, магниттік қасиеттер бөлшектерінің интерпретациясын және комплекстердің стереохимиясын түсіндіру үшін жеткіліксіз болып табылады.
Екі байланыс электрондары алғашқы кезде екі әртүрлі атомдарда болатын тек қана кәдімгі коваленттік байланыстар ғана емес, сонымен бірге донорлы-акцепторлы байланыстар болады, ондағы байланыстыру электрондары әрекеттесуден бұрын бір атомға - электрон жұбының донорына жатады. Осындай типтегі байланыстар NH 4 + ионында пайда болады. Азот атомының сыртқы қауызында (оболочка) 5 электрон бар. NH 3 молекуласында олардың ішінен үшеуі қолданылады және бір электрон жұбы бос болып қалады. Ионда бос орбита болады, онда екі электорон болу мүмкін. Н + ионы қосылу нәтижесінде NH 3 NH 4 + ионына ауысады. Осындай донорлы-акцепторлы байланыс кәдімгі коваленттік байланыстан тек қана байланыс электрондарының шығуымен ерекшелінеді. Байланыстардың саны орталық ионның координациялық санына сәйкес келеді /28/.
Координацияланған аминде алкил тобының болуы қышқылдық дисссоциацияның анықтаушы ролін алкилқұрайтын лиганд атқармаған жағдайдағы қышқылдық-негіздік қасиеттерге байланысты. Мысалы, қосылыстардың мына қатарында: транс- [Co(NH 3 ) 4 (H 2 O) 2 ] +3 , транс- [CoEn 2 (H 2 O) 2 ] 3+ және транс- [(NH 2 - CH 2 -CH 2 -NH-CH 3 ) 2 (H 2 O) Co] 3+ қышқылдық қасиеттер аминнің емес, судың координацияланған молекулаларына тән болсада қышқыл күшінің жоғарлауы байқалады.
Комплексті қосылыстың құрылысы қышқылдық-негіздік қасиеттеріне елеулі әсер етеді. Ережеге сай, әлсіз транс әсер ететін лигандтарға транс- жағдайда болатын координацияланған күйдегі протонқұрайтын топ қышқылдық тип бойынша көп диссоциацияланады, және керісінше, күшті транс әсер ететін лигандтарға транс- жағдайда болатын комплексті байланысқан апротонды топ (протонын «жоғалтқан») аса білдірілген негізгі қасиеттермен сипатталады/29/.
Комплекс түзу кезінде, ережеге сай, валенттік күйдің тұрақтылығы байқалады, яғни, комплекстердің тотықсыздануы сәйкес келетін жай иондарға қарағанда қиындау жүреді. Неғұрлым түзілген комплекс берік болса, соғұрлым жартылай толқын потенциалының шамасы теріс мәндер жағына көп жылжиді. Сонымен, комплекс түзілу нәтижесінде жартылай толқын потенциалының жылжу шамасы бойынша комплекс тұрақсыздығының константасы туралы айтуға болады. Сонымен бірге тотықсыздану және комплекс түзу процестері моменталды жылдамдықпен жүру қажет, яғни қайтымды болу керек/29/.
Тиол лигандтарында бөліспеген электрон жұптары болады, соған байланысты олар көбінесе көпірше ретінде қатысады. Көпіршік комплекстерінің түзілуі металл-ионда толтырылған немесе біраз толтырылған d-электрондық қауыздары болған жағдайда қолайлы болады. Барлық ауыспалы элементтерде қажетті электрондары бар, ал күкірт осы d-электрондарын қабылдау үшін бос d-орбитальдеріне ие болады/30/.
Кесте 1. 3. 1 - Комплекстерді сіңірудің электрондық спектрлеріндегі электрондардың ауысу жолақтары
/29-32/ жұмыстарының авторларымен меркаптоэтиламин, меркаптоацетат және дитиоцианоэтан-иондарын құрайтын сулы ерітінділердегі полимерлі комплексті қосылыстардың тұрақтылығы зерттелді. [Co(SCH 2 CO 2 H) 3 ] және [Co(SCH 2 CO 2 Et) 3 ] полимерлер болып табылады. Сіңірудің электрондық спектрлерінде байқалатын ~500 нм кезіндегі жолақ зарядтың ауысуына жатады.
/33/ жұмысында (П) кобальт хлоридінің полиядролық комплекстерін [CoX 2 L] зерттеу нәтижелері ұсынылған, мұндағы L - 1, 2-дитиоцианоэтан. Қатты комплекстердің бейнелеу спектрлері 506 нм кезіндегі жолақпен сипатталады, ол 4 T 1 → 4 A 2 ауысуына және октаэдрлы координацияланған Со(П) сәйкес келеді. Магниттік моменттің мәні 4, 94-5, 04 М. В. ауданында жатыр, бұл жоғарыспинді октаэдрлы кобальтты (П) сипаттайды.
Димердің сіңіру жолағы 395 нм кезінде байқалады. I димерінде Сo(II) Со(Ш) дейін тез автототығуға әкелетін қайтымсыз редокс-қайтатоптасуы болады:
LCo ++ O-OCO ++ L → LCo 3+ O- O-Co 3+ L
Қышқылдау супероксоформаларды түзіп, жартылай бірэлектрондық тотығуға әкеледі.
[LCo 3+ O 2 -- Co 3+ L] 4+ + Н 3 О + → [LCo 3+ O 2 -Co 3+ L] 5+ + H 2 O
μ-пероксо- μ-гидрокодикобальта(Ш) комплексінің спектралды сипаттамалары 1. 2. 2 кестесінде келтірілген.
Кесте 1. 3. 2 - μ-пероксо- μ-гидрокодикобальта(Ш) комплексінің TPGA-мен спектралды қасиеттері:
фталоцианиннің үштік тиолат- оттекті комплексі түзіледі. кобальттың валенттік күйі осы комплекстегі лигандтардың тотығу дәрежесі туралы авторлар спектралды деректер бойынша сапалы сынайды. 675 нм кезіндегі сіңіру жолағы бастапқы TBSP Co(II) жолағымен салыстырғанда ұзынтолқынды аумаққа жылжыған. Үштік комплексте кобальттан оттегіге электронның жартылай ауысуы болуы мүмкін, яғни Со тотығу дәрежесі +2 және +3 арасында аралық мәнге ие болады.
[RS*TBSPсCo 2+ . О 2 ] Na ↔︎ [RS -. TBSPcCo 3+ O 2 ] Na.
Авторлар катализатордың зерттелген ауысулары негізінде цистеин тотығуының келесі сызбасын ұсынады:
RSH → RS - + Н +
Co IJ Pc(SО 3 Na) 4 + RS - → Co I Pc(SО 3 Na) 4 + RS*
4Co I Pc(SО 3 Na) 4 + O 2 + 4H + → 4Co II Pc(SО 3 Na) 4 + 2Н 2 О
RS* + RS* → RSSR.
Қышқылдық ортада реакция жүрмейді, жылдамдық әлсіз сілтілік ортада максималды болды. Бұл тиолдардың реакцияға RS - диссоциацияланған формасында түсетінімен түсіндіріледі. Қалыпты қан айналымына қажетті B 12 витаминін тотықсыздануы Со III Рс(SO 3 Na) 4 тотықсыздануымен бірдей /35/. Бұндай ұқсастық кобальттың комплексті қосылыстарын металлферменттердің әртүрлі қасиеттерін зерттеу және олардың тотығу-тотықсыздану процестеріне қатысуын зерттеу үшін үлгілі жүйелер ретінде қарастыруға мүмкіндік береді. Химиялық және биологиялық жүйелерде металдардың қосылыстарымен катализденетін молекулалық оттегімен тотығу реакциялары туралы деректер кобальтттың (П) комплексті қосылыстарын оттегінің қайтымды тасушылары ретінде қарастыруға мүмкіндік береді /36/.
Әдебиет мәліметтері қарағанда, кейбір металдардың күкірт қосылысты комплексті қосылыстарының термиялық ыдырау процесі кезінде металдардың унитиолдармен координациялық қосылыстарының металл оксидті және сульфидті негізге ала отырып комплексті қосылыстардың деструкция процесін зерттеуде жаңа ғылыми бағытқа құруға негіз болады/37/.
Соңғы жылдары кобальттың (П) тиолдармен комплекс түзу процестерін зерттеуге арналған авторының жұмысты болды /38/. Бұл жұмыстар негізінен кобальттың (П) комплекстерінің синтезіне арналған, электрондық спектрлердің талдауынан және магниттік моменттің температуралық тәуелділігінен алынған комплекстердің геометриясы туралы ақпаратты құрайды . Барлық синтезделген қосылыстарда координация тиолды лигандтың күкірт атомдары арқылы жүзеге асады. Кобальттың (П) CoL 2 құрамдағы дитиокарбанатарымен келесі құрылымдағы мономерлі комплекстері синтезделді:
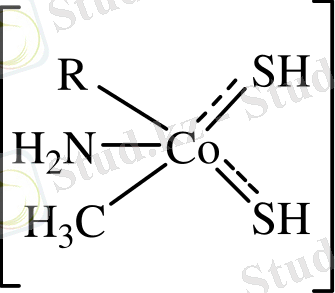
Қосылыстардың ИК спектрлерінде ν (MS) байланыс тербелістеріне жатқызылған 360 см -1 кезінде жолақ байқалады. 16000 және 25000 см -1 кезіндегі электрондық спектрде екі жолақтың болуы кобальттың (П) комплексіндегі зарядтың ауысу жолағына сәйкес келеді 2 А 1g → 2 B 1g. 2, 10 М. В. -ға тең магниттік эффектінің мәні кобальттың (II) дитиокарбаматты комплекстерінің жазық квадратты геометриясын дәлелдейді /39/.
/40-42/ жұмыстарда бидентатты болып келетін кобальттың (II) дитиолдармен қосылыстары сипатталған :
S -δ
- N +δ =C
S -δ
Координация күкірт атомдары арқылы жүзеге асады. 390 см -1 кезіндегі сіңіру жолағы ν (м-s) байланыс тербелістеріне сәйкес келеді. Комплекстердің құрамына координацияланған судың молекулалары кіреді, оның болуын 920, 770 және 340 см -1 кезіндегі жолақтар көрсетеді.
Со(П) қосылыстарының этанолды ерітінділерде тиомочевинамен әрекеттесуі кезінде қызғылт-қызыл түсті комплекстер түзіледі. Спектрофотометриялық және магниттік өлшемдердің деректері ұсынылған. Октаэдрлы комплекстегі тиомочевина молекулалары цис- жағдайда болады:
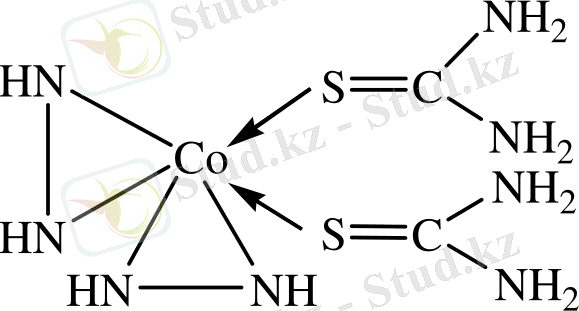
Бұл қосылыстар потенциалды биологиялық активтілікті көрсетеді және олар технология мен ауыл шаруашылығында қолданылу мүмкін.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz