Комплексті қосылыстар: теориясы, құрылымы, түрлері және тұрақсыздық константалары


Комплексті қосылыстар.
Комплексті қосылыстар дегеніміз құрамында бір немесе бірнеше донорлы- акцепторлы байланыс болатын жоғары ретті қосылыстарды айтамыз.
K 4 [ Fe(CN) 6 ] ↔︎4K + + [ Fe(CN) 6 ] 4-
[Ni(NH 3 ) 6 ] S↔︎ [Ni(NH 3 ) 6 ] 2+ +S 2-
Алғаш комплекс қосылыстар түзілу механизімін жасаған А. Вернер болды. Ол негізгі және қосымша валенттілік ұғымын және кординациялық теорияны енгізді.
1. Комплекс қосылыстардағы басты орын комплекс тзушінің орнына тиеді. Комплекс түзуші көбінесе оң зарядталған металл иондары болады. (Fe 2+ және Ni 2+ ) .
2. Комплекс түзушінің маңайында теріс зарядталған аниондар немесе электробейтарап молекулалар - Лигандалар орналасады (CN - және NH 3 ион мен молекуласы) .
3. комплекс түзушінің маңайына орналасқан немесе кординацияланған лигандалардың жалпы саны комплекс түзушінің кординациялық саны деп талады. ( екі қосылыста да 6 - ға тең) .
4. Комплекс түзуші мен лигандалар комплекс қосылысының ішкі сферасын түзеді ([ Fe(CN) 6 ] 4- және [Ni(NH 3 ) 6 ] 2+ иондары) .
5. Ішкі сфераға симай қалған иондар комплекс қосылысының сыртқы сферасын түзеді(K + және S 2- иондары) .
6. Егер қосылыстағы компекс ионының заряды оң болса ([Ni(NH 3 ) 6 ] 2+ ), сыртқы сферада аниондар орналасады (S 2- ), ал комплекс ионының зряды теріс болса ([ Fe(CN) 6 ] 4- ), сыртқы сферада катиондар орналасады (K + ) .
Комплекс қосылыстаодың формуласын жазғанда ішкі сфера жақшаға алынып, сыртқы сферадан бөлінеді.
1. Комплекс қосылыстардың аталуы: комплекс ион катион болғанда: [Ag(NH 3 ) 2 ] Cl - диамин күміс (І) хлориді; комплекс ион анион болғанда: K 4 [ Fe(CN) 6 ] - калийдің гексацианоферраты ( ІІ ) ; комплекс қосылыс бейтарап болғада, [Co(NO 2 ) 3 (NH 3 ) 3 ] - триаминтринитро кобальт (ІІІ ) .
2. Комплекс қосылыстардың типтері:
Олардың типке бөлінуі құрамындағы лигандалар түріне негізделген .
а) Лигандлары су болса аквакомплекстер деп аталады [Al(H 2 O) 6 ] Cl - ;
ә) Лигандалары көміртегі (ІІ) болса карбонилдер деп аталады, [Fe(CO) 5 ]
б) лигандалары аммиак молекуласы және амин (NH 2 - ) иондары болатын болса, сәйкесінше аммиакаттар және амминаттар деп аталады ([ Ag(NH 3 ) 2 ] Cl) ;
в) Лигандалары тек аниондардан (NO 3 -, Cl - , CN - , F - , SO 2- , OH - ) тұратын болса ацидо комплекстер деп аталады ;
г) көп ядролы комплексті қосылыстар құрамында 2 немесе одан да көп элемент, не әртүрлі элемент комплекс түзуші болып кіреді [(NH 3 ) 5 Cr - OH -Cr(NH 3 ) 5 ] Cl 5 М - гидроксо дипентаамин хром (ІІІ) хлориді ;
д) циклді немесе хлеатты комплекс қосылыстарда - ішкі сферад цикл түзіледі, комплекс түзуші лигандамен әрі ковалентті, әрі донорлы- акцепторлы байланыс арқылы қосылады. Мұндай қосылыстарға мыс (ІІ) гидроксиді мен аминсірке қышқылының әрекеттесуі нәтижесінде түзілген мысаминоацетатын елтіруге болады:
CH 2 - H 2 N NH 2 - CH 2
Cu
O = C - O O - C = O
Түзілген комплексті қосылыста лиганда - аминсірке қышқылының қалдығы комплекс түзуші мыспен оттегі арқылы ковалентті байланыс, азот арқылы донорлы - акцепторлы байланыс байланыс түзіп тұр.
е) аутокомплекстер - бірдей заттардың молекулаларын қосқанда түзіледі : 2CuCL 2 = Cu [CuCl 4 ] ;
3. Комплексті қосылыстарды алу жолдары.
Комплексті қосылыстарды алудың бірнеше әдістері бар. Тұздармен негіздерді, амфотерлі гидроксидтермен негіздерді немесе тұздарды тұздармен әрекеттестіріп алуға болады.
4. Комплексті қосылыстардың күйреуі - ерітіндіні күшті сұйылту, қыздыру, диссоциациаланбағанда түзілген иондармен аз еритін қосылыстар түзәлетін реагенттер қосу арқылы жүреді.
[ Ni(NH 3 ) 6 ] 2+ + S 2- ↔︎ ↓ NiS + 6 NH 3
( натрий немесе калий сульфидін, қышқыл қосқанда)
[ Ni(NH 3 ) 6 ] 2+ + 6H + ↔︎ Ni 2+ + 6NH 4 + тепе - теңдік оңға ығысады.
5. Комплекс қосылыстардың изомериясы:
- геометриялық: [Pt(NH 3 ) 2 Cl 4 ] (лигандалар бір жақта немесе жақын орналсса - цис, қызғылт, ал қарама - қарсы жақта орнлсса - транс, сары ) .
- гидраттық ( лиганда - nH 2 O - ішкі, сыртқы сфералард орнласады) : [Cr(H 2 O) 6 ] Cl 3 - қызыл - көк ; [CrCl 2 (H 2 O) ] •Cl 2H 2 O- жасыл.
- ионизациялық: ( лигандалар - қышқыл қалдықтары - ішкі, сыртқы сфераларда орналасады), диссоциациялануы әртүрлі болады, [CoBr(NH 3 ) 5 ] SO 4 - қызыл - көк; [ CoSO 4 (NH 3 ) 5 ] Br - қызыл.
Комплекс қосылыстарының ішкі және сыртқы сфераларының расында байланыс иондық болады. Сондықтан оларды суда еріткенде комплекс ионы мен сыртқы сфера иондарына ыдырайды.
[Ag(NH 3 ) 2 ] Cl↔︎ [Ag(NH 3 ) 2 ] + +Cl -
Түзілген комплекс ионлдары әлсіз электролиттер сияқты аз мөлшерде болса да иондарға ыдырауы мүмкін. Олардың иондарға ыдырауын сандық жағынан тұрақсыздық константасы (К т. з. ) анықтайды. [Ag(NH 3 ) 2 ] + ↔︎Ag + + 2NH 3 Комплекс иондарының диссоциациялануы аз мөлшерде және қайтымды процесс болғандықтан оларға әрекеттесуші мссалар заңын қолданып диссоциациялану константасын (тұрақсыздық константасын ) жазуға болады.
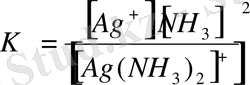
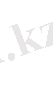 Тұрақсыздық константларының сандық мәндері комплекс иондарының беріктілік немесе тұрақтылығын көрсетеді.
Тұрақсыздық константларының сандық мәндері комплекс иондарының беріктілік немесе тұрақтылығын көрсетеді.
Комплексті қосылыстарға есептер шешу .
1 - мысал. [Ag(NH 3 ) 2 ] + мен [Ag(CN) 2 ] - комплекс иондарының қайсысы тұрақтылау.
Шешуі: Олардың тұрақсыздық константаларының теңдеуін жазып, мәндерін анықтамалық кітаптан жазып алып салыстырамыз.
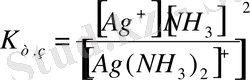
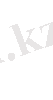
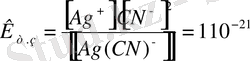
Бірінші комплекс ионына қарағанда екінші комплекс ионы тұрақтылау. Себебі бірінші комплекс ион көбірек ыдырайтындықтан оның тұрақсыздық мәні екіншіге қарағанда үлкен. Тұрақсыздық константа мәндері аздары тұрақтылау болады.
2 - мысал. Мыс (ІІ) сульфаты мен натрий гидроксидінің әрекеттесуінен алынған комплекс қосылыстың алыну жолын, түзілген комплекстің диссоциациясын және оның тұрақсыздық константасының математикалық өрнегін жазып көрсетіңдер. Комплекс қосылыстың атын жазыңдар.
Шешуі:
Натрий тетрагидроксокупраты.
Комплекс қосылыстардың сыртқы және ішкі сфералардың арасында иондық байланыс болғандықтан суда ерігенде бірінші диссоциациялануы толық жүреді:
Ерітіндіде комплекс ионымен оны құраушы бөлшектердің арасында тепе - теңдік болады. Оны сан жағынан комплекс иондардың тұрақсыз константасы арқылы анықтайды. Тұрақсыз константасы неғұрлым аз болса, комплекс қосылыс соғұрлым берік болады.
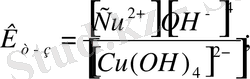
Молекулалық орбитальдар теориясы бойынша комплекс түзуші мен лигандандаларды біртұтас деп қарастырады. Ядро сыртында электрондар байланыстырғыш және босаңдатқыш орбитальдар бойымен атомдық орбитальдардың сызықты комбинацмясы (АОСК - ЛКАО ) негізінде орналасады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz