Кристалдық күйлер: құрылымы, симметриясы, ақаулары және жылу сыйымдылығы


КРИСТАЛДЫҚ КҮЙЛЕР.
Кристалдық күйлердің айрықша белгілері
Табиғаттағы денелердің көпшілігінің құрылымы кристалдық болып саналады. Мысалы, барлық минералдар және барлық металдар қатты күйінде кристалл болып табылады.
Сұйық және газ күйіндегі заттармен салыстырғанда, кристалл күйінің айырықша сипаты оның анизотроптығында, яғни бір қатар физикалық қасиеттерінің (механикалық, жылулық, электрлік, оптикалық) белгілі бағыттан тәуелділігі.
Барлық бағыттар бойынша қасиеттері бірдей болатын денелерді изотропты деп атайды. Кейбір газдар мен сұйықтардан басқа, барлық сұйықтар және аморфты қатты денелер (шыны, пластмасса, канифоль, смола, воск және т. б) изотропты болып саналады.
Кристалдың анизотроптылығының себебін оны құрайтын бөлшектердің (атомдарының немесе молекулаларының) белгілі тәртіппен орналасуымен түсіндіруге болады. Кристалдың сыртқы бедерлерінің дұрыс болуы, оның бөлшектерінің тәртіппен орналасуымен түсіндіріледі. Кристалдар жазық қырлармен шектелген. Ол қырлар қиылысып әрбір кристалға тән бұрыштарды береді. Кристалдарды жарып бұзғанда (сындырғанда), ол дәнекер жазықтығы деп аталатын белгілі бір жазықтықпен жүреді.
Егер дене бір кристалдан түрса, оны монокристалл (монос - бір) деп атайды. Кейбір минералдардың монокристалдары табиғатта табиғи
күйінде кездеседі.
Қалай болса солай орналасқан көптеген ұсақ кристалдардан тұратын және осы ұсақ кристалдардан бір-біріне жабысып өскен денені поликристалдық (поли-көп) дене деп атайды. Ұсақ кристалдары бір-біріне жабысып орналасқандықтан поликристалдық денелердің физикалық қасиеттері барлық бағытта бірдей болады.
Кристал атомдарының тәртіппен орналасуы атомдардың дұрыс геометриялық кеңістіктік тордың түйіндерінде орналасуынан болады. Кристалдың өзі құрылымдық элементтің үш әр түрлі бағыт бойынша, көп ретті қайталануынан алынады. Ол құрылымдық элементті элементарлық кристалұя деп атаймыз. Кристалдық ұяның а, в және с қабырғаларының ұзындықтарын кристалдың ұқсастық периоды деп атайды.
Кристалл затының химиялық құрамын сипаттайтын аз санды атомдардан тұратын кристалл ұяларын (мысалы мұз кристалы үшін сутегінің екі атомы, оттегінің бір атомы) жабайы ұя деп атайды. Алайда, көбінесе жабайының орнына, барлық бүтін симметриялы кристалл секілді, көп санды атомдардан тұратын элементар ұяларды тандап алады.
Кристалдарды классификациялау
Кристалдық тордың симметрияларының түрлері әр түрлі болады. Көбіне кристалдық тордың симметриясы деп оның кеңістікте орын ауыстырғанда, өзіне-өзі сәйкес келуін түсінеді.
Қай тор болмаса да, трансляциялық симметриялы болады, яғни орын ауыстырғанда (трансляцияланғанда) өзіне-өзі сәйкес келеді. Симметрияның басқа түрлеріне жататындар, белгілі бір өстің айналасында бұрылу симметриясы, сол сияқты белгілі бір жазықтықта айналық шағылулар болып табылады.
Егер тор белгілі бір өс айналасында
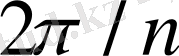 бұрышқа бұрылғанда өзіне-өзі сәйкес келсе, онда бұл өсті
п
-ші ретті симметрияның
өсі деп атайды.
Кристалдық
тордың ерекшелігі, оның 1-ші ретті тривиальдық өстен басқа, 2-ші, 3-ші, 4-ші және 6-шы ретті симметриялық өстерінің болуында.
бұрышқа бұрылғанда өзіне-өзі сәйкес келсе, онда бұл өсті
п
-ші ретті симметрияның
өсі деп атайды.
Кристалдық
тордың ерекшелігі, оның 1-ші ретті тривиальдық өстен басқа, 2-ші, 3-ші, 4-ші және 6-шы ретті симметриялық өстерінің болуында.
Айналык шағылуға байланысты тордың озіне-өзінің сәйкес келуі жазықтығын симметрия жазықтығы деп атайды. Симметрияның әр түрлі түрлері кристалдық тордың симметрия элементтері деп аталады.
Өстік және жазықтық симметрияның түрлерінен басқа да, симметриялардың элементтері болуы мүмкін. Бірақ, біз оларды бұл кітаптың шеңберінде қарастырмаймыз.
Кристалдық тор тәртіп бойынша, бір уақытта бірнеше түрлі симметрияға ие бола алады. Алайда, симметрия элементтерінің сай келуі барлық уақытта бола бермейді. Атақты орыс ғалымы Е. С. Федоровтың көрсетуіне қарағанда, кеңістіктік топ деп аталатын симметрия элементтерінің 230-дан астам комбинациялары болуы мүмкін. Бұл 230 кеңістіктіктік топтар симметриялық белгілеріне қарай 32 класқа бөлінеді. Ең соңында, элементар ұяларының түрлеріне қарай барлық кристалдар әрқайсысы бірнеше симметрия кластарынан тұратын жеті кристалло-графикалық жүйеге (немесе сингонийлерге) бөлінеді (63. 1-кесте) .
Кристаллографикалық жүйелер симметрияның өсу тәртібіне қарай мынадай түрде орналасады.
І. Триклиндық жүйе.
Ол мынадай
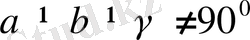 түрінде сипатталады. Элементарлық ұялары қиғаш параллелепипед түрінде болады.
түрінде сипатталады. Элементарлық ұялары қиғаш параллелепипед түрінде болады.
Текшелік (кубтік)
Тетрагонольдық
Гексагональдық
Тригонольдық
(ромбоэдрлік)
Ромбылық
Моноклиндық
Триклиндық
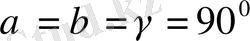
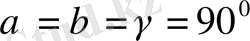
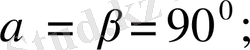
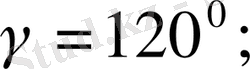
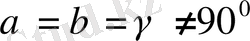
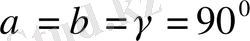
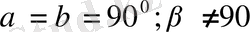
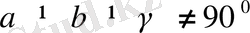
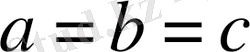
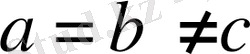
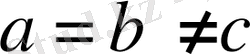
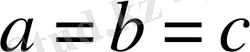
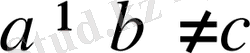
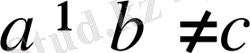
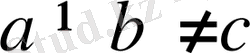
2. Моноклиндык жүйе.
Екі бұрышы тік, үшіншісі (үшінші ретінде
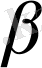 бұрышы алынған) тік емес. Демек,
бұрышы алынған) тік емес. Демек,
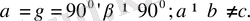 Элементарлық ұя негізгі параллелограмм болатын тік призма (яғни тік параллелепипед) түрінде болады.
Элементарлық ұя негізгі параллелограмм болатын тік призма (яғни тік параллелепипед) түрінде болады.
3. Ромб жүйесі.
Барлық бұрыштары тік, қабырғалары әр түрлі:
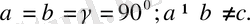 Элементарлық ұясы тік бұрышты параллелепипед түрінде болады.
Элементарлық ұясы тік бұрышты параллелепипед түрінде болады.
4. Тетрагонольдық жүйе.
Барлық бұрыштары тік, екі қабырғасы бірдей:
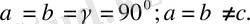 Элементарлық ұясының негізгі квадрат болатын тік призма түрінде болады.
Элементарлық ұясының негізгі квадрат болатын тік призма түрінде болады.
5. Ромбоэдрлік (немесе тригональдық) жүйе.
Барлық қабырғалары бірдей және барлық бұрыштары да бірдей, бірақ 90° -ка тең емес:Элементарлық
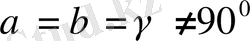
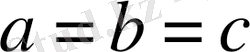 ұясы диагональ бойымен деформацияланып сығылған, немесе созылған текше (куб) түріңде болады.
ұясы диагональ бойымен деформацияланып сығылған, немесе созылған текше (куб) түріңде болады.
6. Гексагональдық жүйе.
Бұрыштары мен қабырғалары
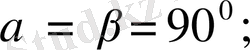
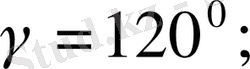
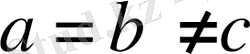 шарттарын қанағаттандырады. Егер үш элементарлық ұяларды 63. 2-суретте көрсетілгендей етіп қүрсақ, онда дұрыс алты бұрышты призма алынады.
шарттарын қанағаттандырады. Егер үш элементарлық ұяларды 63. 2-суретте көрсетілгендей етіп қүрсақ, онда дұрыс алты бұрышты призма алынады.
7.
Текшелік жүйе.
Барлық қабырғалары бірдей бұрыштары тік:
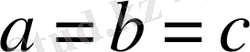
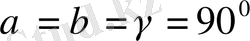 .
Элементарлық ұялары текше түрінде болады. Сонымен тордың 14 түрі бар, оларды
Браве торлары
деп атайды.
.
Элементарлық ұялары текше түрінде болады. Сонымен тордың 14 түрі бар, оларды
Браве торлары
деп атайды.
Кристалдық торлардың физикалық түрлері
Кристалдық тордың түйіндеріндегі орналасқан бөлшектердің табиғатынан тәуелділігіне қарай және бөлшектердің бір-бірімен өзара әсерлесуіне байланысты қристалдық тордың төрт түрі ажыратылады және соған тиісті кристалдың төрт: иондық, атомдық, метадцық және молекулалық түрлері болады.
1. Иондық кристалдар. Бұл түрдегі кристалдарда тордың түйінінде әр түрлі таңбалы иондар орналасады. Олардың арасындағы өзара әсерлесу күштерінің табиғаты электрлік болады (кулондық күштер) . Өзара әсерлесу күштері ара қашықтықтың квадратына кері пропорционал өзгереді. Мүндай түрдегі байланысты гетерополярлық немесе иондық деп атайды.
Иондық кристалдың мысалы ретінде ас тұзының кристалын алуға болады. Оның кристалдық торы 64. 1-суретінде келтірілген. Тордың бұл түрі қарапайым текше жүйесіне жатады. Көрсетілген суреттегі ақ түсті дөңгелектер оң зарядталған натрий иондары да, қаралары-теріс зарядталған хлор иондары; сонымен бірге әрбір натрий ионы алты хлор иондарымен қоршалған, ал әрбір хлор ионы алты натрий иондарымен қоршалған.
Химияда тұздар деп - аталатын көптеген заттардың кристалдары иондық кристалдар болып табылады. Мұндай кристалдар әр түрлі зарядталған иондарды олардың арасындағы тарту күшімен "ұстап" тұрады. Иондық кристалдардың балқу нүктелері өте жоғары (NаСІ 800°С, КСІ 790°С) болады.
2. Атомдық кристаддар. Атомдық кристалдардың түйіндерінде бейтарап (нейтраль) атомдар орналасады. Мұндай түрдегі кристалдардың түзілуі, атомдар арасындағы коваленттік (гомеополярлық) байланыстар арқылы жүреді.
Коваленттік байланыстар тек атомдық кристалдарға ғана тән емес, олар бірқатар екі атомды ( H 2 , O 2 , N 2 және т. б. ) қосылыстарға да тән. Мұндай байланыс әрбір атомның бір электронының коллективтенуінен (бірлесуінен) туады. Сыртқы валентгік электрондары бірлескен екі атомдардың арасында өте күшті электрлік өзара тартылыс күші пайда болады. Мұндай байланыс атомдардың валенттілігіне сәйкес бір, екі, үш және төрт қос электрондармен жүреді.
З. Металдық кристалдар. Металдық кристалдардың кристалдық торларының түйіндерінде оң иондар орналасады да, осы иондар арасындағы бос кеңістікте еркін электрондар қозғалып жүреді. Мұндай кристалдардағы байланысты барлық жүйенің еркін электрондары жүзеге асырады. Бұл электрондар оң иондарды бірге біріктіріп ұстап тұратын "цементтің" ролін атқарады. Бұлай болмаған күнде, иондар арасындағы тебілу күшінің әсерінен тор шашылып қалар еді. Сонымен қатар, кристалдық тордың аумағында бұл иондар электрондарды ұстап түрады, сондықтан да электрондар одан сытылып кете алмайды.
Еркін электрондар металдың көлемінде, кристалдық тордың түйіндеріндегі иондардың бар жоғына көңіл аудармай, қозғалып жүреді. Демек, металдардың өте жоғары электр өткізгіштігі осымен түсіндіріледі.
4. Молекулалық кристалдар. Кристаддық торлардың түйіндерінде белгілі ретпен бағытталған молекулалар (егер олар коп атомды болса) орналасады. Бұл жағдайдағы байланыс күштері молекулааралық Вандер-Ваальс күштері болады. Молекулалық торлар, сонымен кәдімгі мұз, сол сияқты құрғақ мұз (қатты көмірқышқыл) молекулалық кристалл болып табылады.
Кристалдың ақаулары
Кристалдьщ дәлме - дәл түрдегі идеал құрылымы көбінесе аз көлемде болады. Нақты монокристаддардың құрылымында қоспа бөлшектерінің (басқа заттардың бөлшектерінің) болуынан және кеңістік торларының дұрыстығының түрліше бұзылушылығынан кристаддарда бұрмаланушылық болады. Демек, кристалдардың ақауы деп оның құрылымының
дұрыстығының түрліше текте бұзылуын айтады. Ақаудың болуы кристалдардың физикалық, химиялық қасиеттеріне елеулі әсерін тигізеді.
Төменде кристаддарда кездесетін ақаулардың түрлеріне тоқтаймыз.
1. Нүктелік ақау. Мұндай ақаулар кристалл қүрылымының жекеленген нүктесінде байланыстың бұзылуынан болады. Кристалдың тәртіппен орналасқан түйіндерінің арасында, тиісті бөлшектер орын алмаған түйіндер кездеседі. Мұндай түйіндер ваканттық түйіңдер немесе вакансия деп аталады. Кейде түйінде басқа бір сортты бөлшек орналасып қоюы мүмкін, онда оны қоспаның орынды басуы деп атайды. Кристалдық тордың түйіндерінің арасына (көбіне өте кішкене өлшемді) бөлшек қоспалар ендірілсе онда оны қоспалардың ендірілуі деп атайды.
2. Дислокация ("жылжу" деген мағынаны береді) . Кристалдық идеал құрылымының бұзылуы тек нүктелерде ғана жүрмей сызық және
жазықтықтық бойымен де жүреді. Мұндай түрдегі құрылымның бұзылуын дислокациялар (жылжулар) деп атайды. Дислокапияның шектік және бұрандалық деп аталатын екі маңызды түрлері болады.
а) Шектік дислокацияланған кристалда, екі тұрақты жазықтықтар арасында, артық жартылай жазықтық байқалады . Осы жартылай жазықтың шегі қарастырылып отырған дислокацияның түрінде жатады. Дислокация сызығы сурет жазықтығына перпендикуляр __ таңбасымен белгіленген түзу болады. Дислокация манындағы кристалл оған құрылып бітпеген жазықты ендірудің нәтижесінде, күштену (зорлану) күйінде болады.
б) Бүрандалық дислокация көбіне ерітіндіде, не қортпада кристалдың өсу процесінде пайда болады. Ол кристалдың бір бөлігінің атомдарының екінші бөлігінің атомдарымен салыстырғанда ығысуының нәтижесінде түзеледі. Сондықтан дислокация сызығының айналасында спираль шиыршық түріндегі көлбеу жазықтық пайда болады .
3. Жазық ақаулар. Поликристалдық материалдарда түйіршіктіліктің бар болуы жазық ақаудың білінуінің нақты ақиқаттылығы деуге болады. Поликристалдық дене көптеген бірімен-бірі жалғасқан, қалай болса солай бағытталған кристалдардан (түйіршіктерден) түрады . Түіршіктердің арасындағы шекарадағы болшектердің кабаттары жазық ақаулардың байқалу аймағы болып табылады. Бұл аймақтардың ені бірнеше атом диаметріне тең және көрші әр түрлі бағытталған аймақтардың бір-бірімен түйісуін (жанасуын) қамтамасыз етеді. Көбінесе, поликристалдағы түйіршіктер кристалдың дұрыс пішініне сәйкес келмейді, олардың беттерінде кездейсоқ бағытталу орын алады. Температура жоғарылап артқан сайын, бөлшектің қозғалғыштығы артады және кейбір түйіршіктер басқа түйіршікгердің есебінен өсе бастайды.
Дислокацияны және оның қозғалысын элекгрондық микроскоппен бақылауға болады. Әдеттегі кристаддарда, оның бетіндегі дислокация тығыздығы өте үлкен және ол шамамен 10 6 см 2 болады.
Кристалдардың жылу сиымдылығы. Эйнштейн теориясы
Қатты денелердің жылу сиымдылығы жөніндегі мәселелер кристалдық тордың динамикасының көптеген негізгі мәселелерімен тығыз байланыста жатады.
Кристалға классикалық тұрғыдан қарағанда, мысалы, N атомдардан тұратын кристалл затына және 3N оның тербелмелі әрбір еркіндік дәрежесіне, орташа kT энергия сәйкес келетін жүйе болып саналады (1/2 kT кинетикалық энергия түрінде және 1/2 потенциялық энергия түрінде) . Демек, атом торындағы әрбір бөлшек атомға, иондық тордағы ионға немесе металдық торға орташа 3кТ энергия сәйкес келеді. Ендеше кристалл күйіндегі бір моль заттың энергиясын табуға болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz