Молекуланың құрылымы, химиялық байланыстары және энергетикалық деңгейлері


Заттың негізгі химиялық қасиеттерін сақтайтын және өз алдына «өмір сүре» алатын ең кішкене бөлшегін молекула дейміз. Молекула өзара химиялық байланыспен қосылған бірдей немесе әр түрлі атомдар системасы. Молекулада екі немесе одан да көп атомдар бола алады. Мысалы, Н 2 , О 2 , С0 2 , СН 4 және т, б. Молекуладағы атомдар саны өскен сайын оның мөлшері өсе береді. Молекула өзара химиялық байланыспен қосылған бірдей немесе ядроларының, барлық заряды барлық электрондардың зарядына тең. Электрондар молекулада белгілі бір күйде электрондық бұлт түзіп, ядролардың айналасында қозғалады. Молекулаға енетін атомдардың ішкі электрондық қабықтарындағы электрондар көп өзгеріске ұшырамайды. Негізінен молекуланың химиялық және физикалық, қасиеттерін анықтайтын сыртқы қабықта орналасатын валенттік электрондар. Атомдар жақындасып молекула түзгенде валенттік электрондар бір-бірімен әрекеттесіп химиялық байланыс түзеді. Молекуланың беріктігі атомдардың өзара байланысымен анықталады. Атомдар ядролары белгілі бір ара қашықтыққа келгенде, олардың арасында өзара тартылыс күші Ғ тр , ал өте жақын келгенде өзара тебіліс күші Ғ тр пайда болады (1-сурет) . Белгілі бір г 0 қашықтықта екі күш бір-бірін теңгеріп, қорытқы күш Ғ= 0. Бұл жағдай екі атом үш әрекетінің, потенциалдық энергиясының ең минимум мәніне Uо-ге сәйкес келеді (1 б-сурет) . г 0 қашықтық-байланыс ұзындығы, D энергия, молекула құрайтын атомдардың байланыс энергиясы немесе атомдарды ажырату үшін керек диссоциация энергиясы деп аталады. Диссоциация энергиясы теріс шама, ал атомдар молекула құраған кездегі бөлінетін энергия оң, шама. Молекуланың тұрақтылығы, беріктігі айтылған диссоциация энергиясына, химиялық активтігі де осыған байланысты болады. Молекула кұрайтын атомдар арасындағы байланыс екі түрге бөлінеді. Молекуладағы бір атом ядросының айналасында электрондар саны көп болып, екіншісінің айналасында электрондар аз болып жіктелуі мүмкін. Сөйтіп молекула әр түрлі таңбалы (оң, және теріс), бір-біріне тартылатын екі ионнан тұрады. Байланыстың мұндай түрін гетерополярлық немесе иондық байланыс деп атаймыз. Мысалы, NаСІ, KСІ - хлорлы калийде калий өзінің сыртқы қабықтағы валенттік бір электронын хлорға беріп оң зарядты ион, ал хлор бір электрон алып теріс ионға айналады. Сөйтіп пайда болған иондық молекуланы электрлік диполь ретінде қарастыруға болады. Иондардың ара қашықтығы, яғни байланыс ұзындығы г 0 =1, 3*10 -10 м.
Байланыстың екінші түрі гомеополярлық немесе коваленттік байланыс деп аталады. Бұл байланыс кезінде электрондардың бір бөлігі екі ядроны да айнала қозғалады. Байланыс, қарама-қарсы бағытталған спиндері бар қос электрондар арқылы болады (2-сурет) .
Коваленттік байланыс, бірдей ядролары бар атомдар Н 2 , О 2 , N 2 және т. с. с. және әр түрлі ядролы атомдар арасында (N0, НҒ, СН 4 және т. с. с. ) бола береді. Бірінші аталған (Н 2 , О 2 , N 2 ) молекулаларда электрондар симметриялы жіктеледі, ал екінші түрлерінде (N0, НР, СН 4 , НН 3 ) электрондар ассимметрия түзеді. Осының әсерінен молекула электрлік дипольдік момент алады. Коваленттік байланыс туралы алда толығырақ тоқталамыз.
23. МОЛЕКУЛАНЫҢ ЭНЕРГЕТИКАЛЫҚ ДЕҢГЕЙЛЕРІ ЖӘНЕ ТОЛҚЫНДЫҚ ФУНКЦИЯСЫ
Атом сияқты молекулада кванттық заңдарға бағынады. Молекулаларда атомдағыдай энергетикалық дискреттік мәндер қабылдап, әр түрлі күйлерде болады. Бірақ молекулалардың, энергетикалық деңгейлерінің құрылысы күрделі. Себебі, электрондардың козғалысымен қатар молекулалар кұрайтын атом ядроларының тербелісі және айналысы молекуланың энергетикалық күйіне әсер етеді. Тербелмелі қозғалыс кезінде ядролардың са-лыстырмалы орналасулары, ал айналмалы қозғалыс кезінде молекуланың кеңістікте орналасуы өзгереді. Электрондар қозгалысы ядро қозғалысына карағанда өте жылдам болғандықтан, молекуланың негізгі энергиясы электрондық энергиядан Е эл тұрады. Электрондар қоршаған ядролардың тербеліс энергиясы Е тб , молекуланың айналмалы қозғалысына келетін E айн энергия және электрондык, энергия Е эл келесідей қатынаста болады:
Еэл:Етб:Еайн=1:
m е - электрон массйсы, М - ядро массасы. Сонымен молекула-ның жалпы эыергиясы
Е = Е эл +Е Т б+Еайн, (1)
Е Э л>Е тб >Еайн. (2)
Молекуланың күйі оның ψ толқындық функциясымен аныкталады. Молекуланың толқындық функциясын және онын энергетикалық деңгейлерін әрбір аталған қозғалыстың түрі үшін Шредингер теңдеуін есептеу арқылы табады. Сонда молекуланың электрондық ψ эл , тербелмелі ψ тб , айналмалы ψ айн толқындық функциялары бар және оларға сәйкес Е эл , Е тб , Е айн энергиялары бар.
Молекула екі немесе одан да көп атомдардан тұратын орнықты система. Орнықты дейтініміз молекулаға сырттан белгілі бір энергия берілмесе ол атомдарға бөлінбейді. Басқаша айтқан-да, молекула система ретінде «өмір сүруі» үшін оның байланыс энергиясы, оны құрайтын бір-бірімен байланыспаған бөлек атомдар Системасының энергиясынан кем. Егер бір топ атомдар арасындағы әрекеттесу олардың жалпы энергиясын азайтатын болса, молекула құралады. Егер әрекеттесу жалпы энергиясын арттыратын болса, молекула түзілмейді. Атомдар бір-бірінен тебіледі.
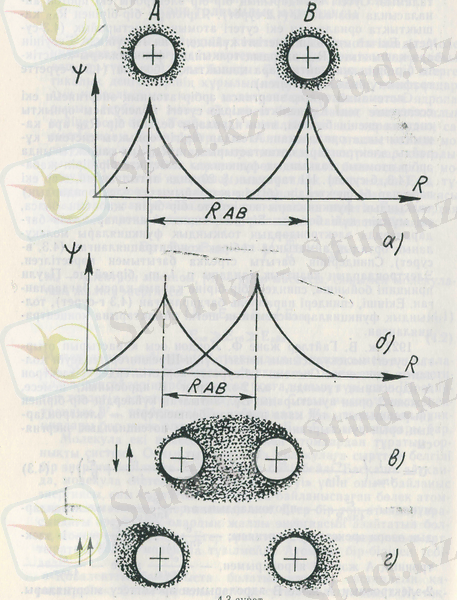
Коваленттік байланыста болатын атомдар системасын қарастырайық. Оның мысалы ретінде сутегі молекуласына Н 2 тоқталамыз. Сутегі атомдарыньң бір-бір электроны екі протон ай-наласында қозғалады (2-сурет) . Ядролары бір-бірінен R АВ қашықтықта орналасқан екі сутегі атомын қарастырайық (3-сурет) . Екі атомда өзінің негізгі күйінде, яғни 1s күйінде. Екеуінің ара қашықтығы R АВ олардың толқындық функциялары кеңістікте бір-бірін жаппайтын ара қашықтықта болсын (3 а-суретте график түрінде көрсетілген) .
Системаның толық энергиясы әрбір атомның энергиясын екі еселегенге тең. Күнделікті өмірде сутегі молекуласы орнықты система екенін білеміз, яғни ядролары белгілі бір R АВ ара қашықтығында орналасқан. Атомдар бірігіп орнықты система құрайды, электрондары ортақтастырылған. R АВ ара қашыкдығында әрбір атомның толқындық функциясы кеңістікте бір-бірін жабады (3, б-сурет) . Егер екі пара-пар бөлшектердің (біздің жағдайымызда электрондардың) толқындық функциялары кеңістікте бір-бірін жабатын болса, екі мүмкін күйі болады. Бірінші, спиндері антипараллель бағдарлағанда электрондардың толқындық функциялары молекуланың орталық, аймағында көбірек концентрацияланған (3, в-сурет) . Спиндерінің бағыты стрелка бағытымен көрсетілген. Электрондардың кванттық сандары n, l, m бірдей де, Паули принципі бойынша, спиндері бір-біріне қарама-қарсы бағдарланған. Екінші, спиндері параллель бағдарланған (3 г-сурет), толқындык функциялар системаның шеткі аймақтарына концентрацияланған.
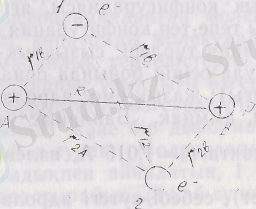
1927 ж. В. Гайтлер және Ф. Лондон осы қарастырып отырған сутегі молекуласының негізгі күйін Шредингер тендеуін қолданып есептеген. Система 4-суретте көрсетілгендей 1-электрон А ядросының тұсында, ал 2-электрон В ядросының, немесе, 1 және 2 орын ауыстырады. Бұл айтылған күйлердін, бір-бірінен айырмашылығы тек қана пара-пар бөлшектерін электрондардың орын ауыстырғанында. Системаның потенциалдық энергиясы
U=1/4πε 0 (-e 2 /r 1A - e 2 /r 2A - e 2 /r 1B - e 2 /r 2B + e 2 /r 12 + e 2 /r R ),
мұндағы e 2 /4πε 0 R - протондардың, ал e 2 /4πε 0 r 12 электрондардың өзара әрекеттесу энергиясы;
- e 2 /4πε 0 r 1A , - e 2 /4πε 0 r 1B - 1 электронның А және В ядроларымен, - e 2 /4πε 0 r 1A және - e 2 /4πε 0 r 1B - 2-электронның А және В ядроларымен әрекеттесу энергиялары.
Система үшін Шредингер теңдеуі:
▼ 2 1 - бірінші электронның координаталары бар Лаплас опера-торы, ▼ 2 2 - екіншісінікі. (4) теңдеуінен табылатын энергияның меншікті мәндері, ядролардың ара қашықтығы R-дың функ-циясы (5-сурет) . Сонымен қатар электрондық энергия Е эл электрондардың спиндерінің бір-біріне параллель, 5-суретте көрсетілген 1-қисық, немесе антипараллель бағдарлануына байланысты - 2-қисық. 3 және5-суреттерде молекула құралуы үшін электрондар спиндерінің антипараллель бағдарлануы керек
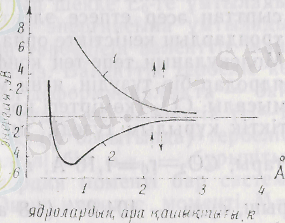
4-сурет 5-сурет
екені көрінеді. Алдында айтып кеткендей атомдар арасындағы өзара әрекеттесу энергиясы олардың жалпы энергиясын азайта-тын болса, молекула құралады дегенбіз. 4. 3 және 4. 5-суреттерден электрондар спиндері параллель болғанда системанын. жалпы энергиясы артып атомдардың электрондық бұлттары бір-бірінен тебіледі екен, яғни бұл жағдайда молекула құрауға мүмкіндік болмайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz