Бойль-Мариотт және Гей-Люссак заңдары: газ күйі мен температураны өлшеудің теориясы


Бойль - Мариотт және Гей - Люссак заңдары.
Температураны анықтау.
Газдардың өзі тұрған ыдысты тегіс толтырып, тұратын және сол ыдыстың қабырғаларына қысым түсіретін қасиеті бар.
Р
қысым сан жағынан алғанда ауданның бір өлшеу бірлігіне перпендикуляр бағытпен әсер ететін күшке тең физикалық шама болып табылады. Сонымен, егер S ауданға перпендикуляр бағытпен әсер ететін күш
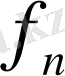 болса, онда р қысымы мынаған тең болады:
болса, онда р қысымы мынаған тең болады:
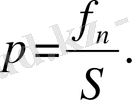
CGS системасында р қысымы бармен өлшенеді, бар дегенміз - 1 см 2 ауданға перпендикуляр бағытпен әсер ететін 1 дина күштің қысымы.
Өлшеу бірліктерінің халықаралық системасында қысым бірлігіне 1м 2 ауданға перпендикуляр бағытпен әсер ететін 1 ньютон күштің әсері алынады. Қысымның бұл бірлігі н / м 2 деп белгіленеді; 1 н / м 2 =10 бар екендігі өзінен - өзі түсінікті. Бұлармен қатар қысымды өлшеуге мынадай да бірліктер қолданылады:
1) . Техникалық атмосфера, ол - 1 см 2 ауданға түсетін 1 кг күштің қысымына тең.
2) . Физикалық атмосфера (қысқаша ат), ол - 1, 033 кг / см 2 қысымға тең.
3) сынап бағанасының миллиметрі (қысқаша мм Hg), ол - биіктігі 1 мм сынап бағанасының салмағы түсіретін қысымға тең. 760 мм Hg қысым бір физикалық атмосфераға тең. Бұл бірліктерді біріне - бірін айналдыру үшін мына қатыстарды қатыстарды пайдалануға болады:
Физ. ат техн. ат = 1033 Г / см 2 = 760 мм Hg = 1033· 981 бар = 1, 013 ·10 6 бар.
Газдың алынған белгілі бір мөлшері мынадай төрт шамамен сипатталады;
1) оның м массасы;
2) оның алып тұратын V көлемі;
3) р қысымы;
4) t темперитурасы. Бұл шамалардың барлығы да біріне - бірі тәуелді болады; жалпы алғанды, бұлардың біреуі өзнергенде қалғандарының барлығы да өзгереді. Осы шамалардың барлығын заңды түрде байланыстыратын формула газ күйінің теңдеуі деп аталады.
Газ күйінің жалпы теңдеуінің өрнегін қорытып шығармас бұрын жоғарыда көрсетілген төр шаманың екеуі тұрақты болатын жағдайда қатысы бар қарапайым эмпирикалық заңдылықтарды қарастырайық.
Температура тұрақты болғанда газдың берілген массасының ( т мен t тұрақты) қысымы оның көлеміне кері пропорционал болады (Бойль - мариотт заңы) ;
pV = const ( т мен t тұрақты болғанда) .
Температура тұрақты болғанда газдың берілген т массасының р қысымы мен V көлемінің арасындағы тәуелділік графих түрінде тең бүйірлі гиперболамен кескінделеді (1 - сурет) .
Бойль - Мариотт заңын кесікндейтін қисық сызық тұрақты температурада сызылатындықтан оны изотерма деп аталады.
Бойль - Мариотт заңы жуық заң болады. Атап айтқанда газдардың барлығы да өте үлкен қысымдарда, Бойль - Мариотт заңында айтылғандағыдан гөрі, аз сығылады. Алайда бөлме температурасына жуық температураларда және атмосфера қысымынан оншалықты айырмашылығы аз қысымдарда газдардың көпшілігі Бойль - Мариотт заңына жеткілікті түрде бағынады.
Ілгеріде айтылатын келесі заңдылықтар газдың қысымын немесе көлемін оның температурасымен байланыстырады. Алайда ең алдымен температураның өзі қалай өлшенетіндігін анықтап алу керек. Денелердің қыздыру немесе суыту, яғни олардың температурасын өзгерту, олардың барлық физикалық қасиетіне дерлік әсер етеді: дененің сызықтық өлшемдері өзгереді, олардың серпімділік қасиеттері, электр өткізгіштігі т. б. да өзгереді. Дененің температурасын өлшеу үшін осы өзгерістердің кез келгенін пайдалануға болады.
Сынапты термоиетр деп аталатын прибордағы сынап көлемінің өзгеруі бойынша температураны өлшеу методы тарихи қалыптасқан метод екендігі мәлім. Алайда сынапты термометрдің шкаласын тең бөліктерге бөліп градуилеу тәсілінде алдын ала t температура өзгергенде сынаптың көлемі сызықтық түрде өзгереді деп есептеледі. Егер біз термометрді басқа бір сұйықпен толтырып және оның бойынан сынапты термометрдің екі нүктесіне (мысалы, мұздың еру температурасына сәйкес келетін «0» - нүктеге және судың қацнау темпрературасына сәйкес келетін «100» - нүктеге сәйкес келетін екі нүкте белгілеп, сонан кейін шкаланы бұрыңғыша тең бөліктерге бөлсек, онда мұндай термометрдің орташа температураны көрсетуінің сынапты термометрдің көрсетуінен, аз да болса, айырмашылығы болады. Сонымен, бұл жағдайда температуралардың тағайындалған шкаласы көлемінің өзгеруіне қарай температура өлшенетін денеге («термометрлік» денеге) байланысты болады. Мұнда дененің (атап айтқанда, сынаптың) өзі кездейсоқ алынып отырғандықтан температуралардың шкаласы да кездейсоқ борлады. Термометрлік денені таңдап алуда қазірше ешбір теориялық негіздің жоқ екендігіне қарамастан, біз термометрлік дене ретінде өзінің басқа қасиеттері жағынан ең қарапайым заңдылықтарға бағынатын денені таңдап алу керек деп есептейміз. Мұндай дене ретінде Бойль - Мариотт заңына неғұрлым жақсы бағынатын газды алуға болады. 1877 жылы Өлшеулер мен таразылардың халықаралық комитетімен келісіп термометрлік дене ретінде сцтегі таңдап алынды және температураны сутегі термометрмен өлшеуге келісілді; мұндай температураның өзгеруі, қызғанда немесе
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz