Термодинамиканың І және ІІ заңдары: теориясы және изопроцестерге қолданылуы


«Мақсат» медициналық колледжі
РЕФЕРАТ
Тақырыбы:
«Термодинамиканың І және ІІ заңы»
Орындаған: Мадиярова А. Т.
Тексерген: Хамитова Г. С.
Орал, 2012ж.
Жоспар
Кіріспе
1. Термодинамиканың бірінші бастамасы
2. Термодинамиканың бірінші заңын изопроцестерге қолдану
3. ТЕРМОДИНАМИКАНЫҢ ЕКІНШІ ЗАҢЫ
Пайдаланылған әдебиеттер тізімі
Кіріспе
Организм және клетка қоршаған ортаның және клетканың арасында, сонымен қатар клетканың ішінде заттарды тасмалдаудың және химиялық реакциялардың нәтижесінде жұмыс істейтін химиялық машина. Осыған сәйкес биологиялық жүйені физикалық тұрғыдан түсіндіруде термодинамикаға негізделеді.
Термодинамика физиканың бір бөлімі ретінде энергия мен жұмыстың арасындағы қатысты карастырады. Термодинамиканы кейде жылудың жалпы теориясы деп те атайды.
Термодинамикалық дене немесе жүйе деп белгілі бір көлемге ие болатын затты айтады. Термодинамикалық жүйе (дене) үш параметрмен, температура Т, көлем V және қысым Р-сипатталады. Жүйенің бір күйден екінші күйге өтуін термодинамикалық процесс дейді (бір күйден екінші күйге өткенде бір параметрдің мәні өзгерсе болғаны) . Айталық, термодинамикалық жүйе бір күйден (V1, Р1, Т1) екінші күйге (V2, Р2, Т2) өтті делік. Онда ол і күйлерді бастан кешірсін. Енді осы жүйе кері бағытта 2 күйден 1 күйге келген кезде, барлық күйлерді басынан кешіре отырып, жүйенің өзінде де және оны қоршаған ортада да ешқандай өзгеріс байқалмаса, онда ондай процесті қайтымды процесс деп атайды. Егер жүйе 2-күйден 1-күйге өткенде не жүйенің өзінде, не оны қоршаған ортада өзгеріс болатын болса, ондай процесті қайтымсыз процесс деп атайды. Өмірде болып жататын процестер қайтымсыз процесс болып саналады.
1. Термодинамиканың бірінші бастамасы
Термодинамикалық тепе-теңдіктің жоқ болуына қарамастан жүйенің ұзақ уақыт бойына өзінің кейбір физикалық және химиялық қасиеттерін сақтап тұру қасиеті стационар күй деп аталады. Егер жүйенің параметрлері оның қоршаған ортамен әрекеттесу кезінде уақыт өткен сайын өзгермесе, онда жүйенің күйін стационарлы деп атайды. Осындай күйдің мысал ретінде үй тоңазытқышытың ішкі бөлігінің жұмысының күйі, адам денесінің күйі, үй бөлмесін жылытатын ауаның күйі және т. б.
Жүйенің әр түрлі бөлігіндегі стационарлы күйде болатын параметрлердің мәні әдетте өзгеше (әр түрлі) болып келеді. Адам денесінің әр бөліктеріндегі температура, биологиялық мембраналардың әр бөліктеріндегі диффузияланатын молекуланың концентрациясы және т. б. Жүйедегі, сонымен, кейбір параметрлер тұрақты градиенттерді ұстап тұрып, тұрақты жылдамдықпен химиялық реакциялар жүру мүмкін.
Стационарлық күй жүйе арқылы өтетін зат және энергия ағыны есебінде ұстап тұрылады. Схема түрінде суретте жүйенің әр түрлі нүктесінде температура бірдей емес стационарлық күйі (а) көрсетілген.
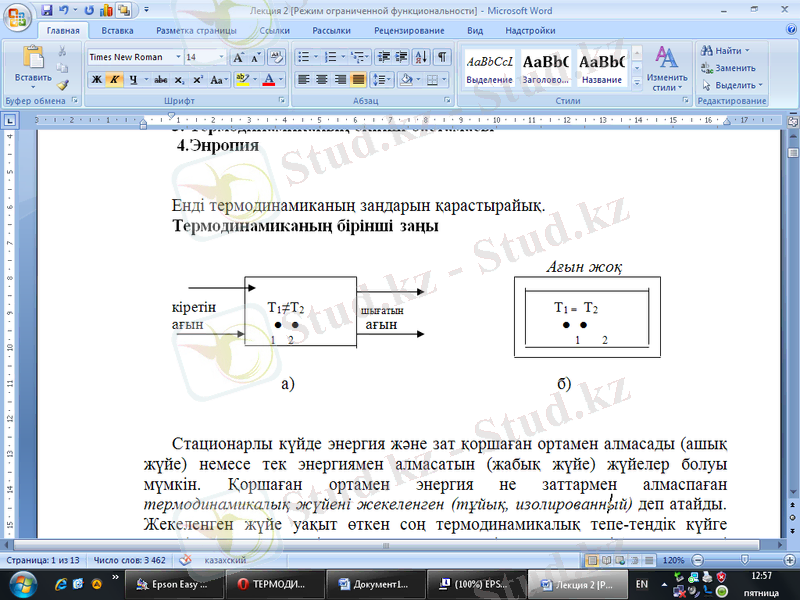
Стационарлы күйде энергия және зат қоршаған ортамен алмасады (ашық жүйе) немесе тек энергиямен алмасатын (жабық жүйе) жүйелер болуы мүмкін. Қоршаған ортамен энергия не заттармен алмаспаған термодинамикалық жүйені жекеленген (тұйық, изолированный) деп атайды. Жекеленген жүйе уақыт өткен соң термодинамикалық тепе-теңдік күйге келеді. Мұндай күйдегі, стационарлық күйдегі сияқты жүйенің параметрлері уақыт өткен соң өзгеріссіз қалады. Жекеленген жүйенің термодинамикалық тепе-теңдігі б) суретте көрсетілген.
Термодинамикалық жүйе деп клетканы, организмді және т. б. айтуға болады. Термодинамикалық жүйенің ашық және жабық деген екі түрі бар. Жабық жүйе де оқшауланған және тұйық болып бөлінеді. Егер жүйе өзін қоршаған ортаға энергия бермесе және алмаса, онымен зат алмаспаса, онда оны оқшауланған жүйе деп атайды. Басқаша айтқанда оқшауланған жүйе өзін қоршаған ортамен энергия және зат алмаспайды. Ал жүйе өзін қоршаған ортамен тек қана энергия алмаса алатын болса, онда оны тұйық жүйе деп атайды. Ал жүйе өзін қоршаған ортаға энергия берсе және алса, онымен зат алмаса алатын болса, ондай жүйені ашық жүйе деп атайды. Шынын айтқанда организм жылу машинасы ретінде емес, химиялық машина ретінде жұмыс істейді. Жабық жүйені қоршаған ортамен әрекеттесуін қарастырайық. Олардың арасындағы энергия алмасуы екі әртүрлі процестеріндегі жұмыс және жылу алмасу кезінде жүзеге асуы мүмкін.
Филогинетикалқ және онтогенетикалық дамуының кезкелген денгейнде, тірі ағзаның физияалогиялық процестерінің негізінде жататын физикалық заңдылықтарды зерттей отырып, бияалогиялық термодинамика барлық-жаратылыстану ғылымдарының фундаменті термодинамиканың бірінші бастамасынан:энергияның сақталу және аналу заңынан бастау алады
Энергия жоқтан пайда болмайды, және жойылмайды, ол тек бір түрден екінші түрге айналады. Әлемдегеі энергияның жалпы мөлшері уақыт өтуі бойынша тұрақты шама болып табылады. Ең алғаш бұл заң 1748 жылы М. В. Ломоносовтың Элерге жазған хатында айтылған. Тек жүз жыл өткеннен кейін, неміс дәрігері Роберт Мейер табиғаттағы барлық күштердің бірлігіне және жалпы «қозғалыс мөлшерінің» өзгермейтіндігі туралы қорытындыға келеді. Ломоносов, Гесс, Мейер, Джоуль, Гельгльц негіздеген бірініші бастама, тұйық жүйелерде энергияның әр түрлі формулаларын өзара айқындалуы үшін белгілі бір санның қатынас қажеттілігін тағайындады: сонымен мұндай жүйедегі энергияның жалпы мөлшері барлық уақытта тұрақты шама болып қалуы керек. Және тек қана қоршаған орта есебінен ұлғайып немесе кішейіп отыруы мүмкін.
Термодинамиканың бірінші бастамасы- термодинамикалық жүйелер үшін энергияның сақталу заңы; бұл заң бойынша жүйеге берілетін жылу оның ішкі энергиясын өзгертуге және жүйенің сыртқы күштерге қарсы жұмысына жұмсалады.
Дене күйінің барлық энергиясы - микроскопиялық қозғалысының толық түріндегі сыртқы кинетикалық энергиясы Ек және салмақ күші өрісі, электрлі немесе магнит өрісі жағдайындағы потенциалды энергия Еn, сонымен қатар, дене бөлшектерінің құрамдық әрекеттері мен қозғалу энергиясын жасаушы ішкі энергия U қосындыларынан тұрады:
Қаралып отырған жылудинамикалық жүйе шамаланса, онда дененің орталық салмақтық алмасу жылдамдығы өте аз (С=0), яғни қозғалыссыз жұмыстық дене көлемінің өзгеруі туралы сөз болады, сондықтан Ек=0. Айталық, Ер=0 сонымен, бұл жерде толық энергия ішкімен бірдей (E=U), ал жүйе энергиясының өзгеруі - жұмыстық дененің, ішкі энергиясының өзгеруіне келтіреді.
Жылудинамикасының бірінші заңына сәйкес, жұмыстық дененің энергиясы кезінде, қабылданған жағдайға тиісті кезіндегі жүйенің өтуі 1 бастапқы күйінен 2 соңғы мәндеріне артуы, денеге берілген жылулық dQ және мәніне келуі dL істелінген жүйе жұмысына тең: dU=dQ-dL немесе әдетте былай жазу қабылданған.

Сыртқы ортамен әрекеттестігі жоқ болғандағы кезінде (dQ=0 және dL=0), формуладағы dU=0, яғни жүйе энергиясы өзгеріссіз сақталады. Жүйелер қатнасының жекеленген жылулығы үшін, ондағы dQ=0 екені белгілі.

Теңдеу жұмыстық дененің еркінше алынған санды массасы m арналып жазылған, ал меншікті мәндері үшін былай жазылады:

мұндағы q - меншікті жылулық саны; l - меншікті жұмыс; u - меншікті ішкі энергия, q, u, l бірлік өлшемі Дж/кг.
Бұл теңдеу, жылудинамикасының бірінші заңының талдаушы тұжырымдалуын көрсетеді, осыған сәйкес жүйеге жеткізілген жылу, жүйелердің ішкі энергиясына жұмсалады және жұмыстың атқарылуына қарсы денеге түскен сыртқы күш. Олар, қайтымдыға да және сыртқы қайтымсыз процесстер үшін де әділетті. Себебі, қабылданған жағдайдағы жылуалмасуы кезінде, дене мен орта арасының соңғы температура айырмашылығы кезінде, қайтымсыз жылуалмасуына сәйкес келеді.
Қоршаған ортаның жұмыс жүйесін қарастыралық, сыртқы күштердің әрекетінен дене көлемінің өзгеруі жүреді. Механиканың жалпы ережесі бойынша, бұл жұмыс денеге түскен күш көбейтіндісімен, оның жылжуын анықтайды. Егер күш, бет ауданының элементіне әрекет етсе, ол элемент, қысым болады, ал осы элементтің ауданының көбейтіндісінің жылжуы, нормалы бағытпен бетке жатып, сол элементтің беттік көлемі болса, онда элементарлы жұмыс, қоршаған орта жүйесімен жасалу кезіндегі, дене көлемінің шексіз аз өзгеруінің көбейтіндісі ретінде анықталады:
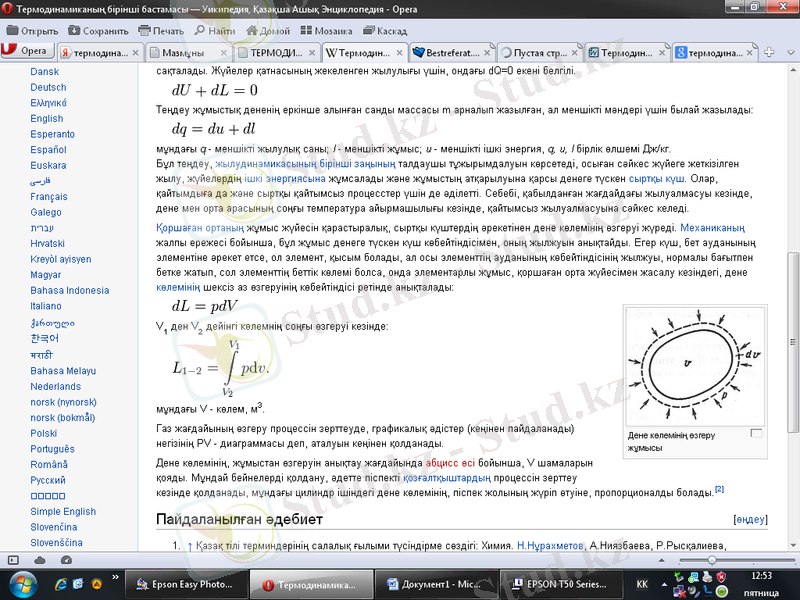
Газ жағдайының өзгеру процессін зерттеуде, графикалық әдістер (кеңінен пайдаланады) негізінің PV - диаграммасы деп, аталуын кеңінен қолданады.
Дене көлемінің, жұмыстан өзгеруін анықтау жағдайында абцисс өсі бойынша, V шамаларын қояды. Мұндай бейнелерді қолдану, әдетте піспекті қозғалтқыштардың процессін зерттеу кезінде қолданады, мұндағы цилиндр ішіндегі дене көлемінің, піспек жолының жүріп өтуіне, пропорционалды болады.
2. Термодинамиканың бірінші заңын изопроцестерге қолдану
Газ күйін сипаттайтын параметрлер температура Т, көлем V және қысым Р- қысым екені белгілі. Осы параметрлердің біреуі тұрақты болғанда жүретін процесті изопроцестер деп атайды. Олар Бойль-Мариотт, Гей-Люссак және Шарль заңдарымен анықталады. Енді термодинамиканың бірінші бастамасын осы процестерге қолданайық.
1. Изотермиялық процесс. Бұл процесте Т=const болады, қысым мен көлем былай байланысады: PV= const, яғни Бойль -Мариотт заңы бойынша: температура тұрақты болғанда, газдың берілген массасы үшін газ қысымының оның көлеміне көбейтіндісі де тұрақты шама болады.
Температура тұрақты болғандықтан бұл процесс кезінде ішкі энергия өзгермейді, яғни dU=0. Олай болса, термодинамиканың бірінші бастамасы изотериялық процесс үшін былай жазылады:
dQ=dA
Процесс кезінде температура тұрақты болса, ондай процесті изотермиялық процесс деп атайды.
2. Изохоралық процесс. Бұл процесте V= const, қысым мен температура
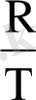 = const түріннде байланысқан. Шарль заңы: көлем тұрақты болғанда газдың берілген массасының қысымы газдың абсолют темпратурасына пропоционал болады. Көлем тұрақты болғанда өтетін процесті изохоралық процесс деп атайды. Изохоралық процесс үшін dA= 0. Олай болса бұл процесс үшін термодинамиканың бірінші бастамасы былай жазылады: dQ= dU.
= const түріннде байланысқан. Шарль заңы: көлем тұрақты болғанда газдың берілген массасының қысымы газдың абсолют темпратурасына пропоционал болады. Көлем тұрақты болғанда өтетін процесті изохоралық процесс деп атайды. Изохоралық процесс үшін dA= 0. Олай болса бұл процесс үшін термодинамиканың бірінші бастамасы былай жазылады: dQ= dU.
3. Изобаралық процесс P= const. Гей-Люссак заңы: қысым тұрақты болғанда, газдың берілген массасының көлемі газдың абсолют темпратурасына пропоционал болады. Бұл процесте
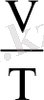 =const . Бұл кездегі жұмыс қысымның көлем өзгеруінің көбейтіндісімен анықталады.
=const . Бұл кездегі жұмыс қысымның көлем өзгеруінің көбейтіндісімен анықталады.
A=Р(V2 -V1)
Денелердің жылулық қасиеттерін сипаттау үшін термодинамикаға жылу сыйымдылық деген ұғым енгізіледі.
Денеге берілген немесе дененің берген жылуы мына формуламен анықталатыны белгілі: Q=mcΔΤ
Мұндағы m-дененің массасы, c-дененің меншікті жылу сыйымдылығы, ΔΤ- дене температурасының өзгеруі.
Кейбір жағдайларда дененің қызуы немесе сууы кезінде меншікті жылу сыйымдылығы өзгеріп отыруы мүмкін. Олай болса, темпера-тураның өзгеру интервалында температураның өте аз өзгеруін dΤ алып, ондағы с-ті тұрақты деп қарастыруға болады. Олай болса: dQ=сmdΤ
Осыдан с=
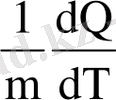
3. ТЕРМОДИНАМИКАНЫҢ ЕКІНШІ ЗАҢЫ
Термодинамиканың бірінші бастамасы энергияның сақталу занынан туындайды, бірақ процестің жүру бағыттың түсіндірмейді.
Термодинамиканың екінші заңы өмірде болатын процестердің бағыты жөнінде мағұлмат береді. Бұл заңның негізін салған француз физигі Сади Карно. 1884 жылы ол жылудың жұмысқа айналуы туралы ғылыми еңбек жазды. Термодинамиканың екінші заңының мәнін түсіну үшін мысал қарастырайық. Мысалы, тұз бен су алып, одан қоспа алуға мүмкіндік туады. Ал енді тұзды судан ажырату үшін суды буға айналдырып жіберу керек. Оған энергия қажет. Оның үстіне бұл кезде тұзды су қоспасын қоршаған ортаның да жағдайы өзгеріске ұшырайды. Сонымен диффузия бір бағытта жүретін процесс екен. Сол сияқты жылу алмасу да бір бағытта жүреді. Мысалы ыстық денені суық денемен түйістірсек, онда біраздан кейін ол екі дене температурасының теңесетінін байқаймыз. Ыстық дене суиды, ал суық дене жылиды. Сонда энергия ыстық денеден суық денеге беріледі. Осыған кері процесс болуы мүмкін емес. Олай болса жылу алмасу да бір бағытта жүретін процесс. Осы бағытты және өмірде болатын жылу процестерінің қайтымсыздығы термодинамиканың екінші заңымен анықталады. Бұл заңды сипаттайтын бірнеше анықтама бар, олар біріне-бірі эквивалентті. Соларға тоқталайық.
Клаузиус анықтамасы. Жылу ешқашан да суық денеден ыстық денеге берілмейді.
Томсон-Планк анықтамасы. Қыздырғышты суыту арқасында онан алынған жылу мөлшерін түгелімен жұмысқа айналдыру мүмкін емес.
Оствальд анықтамасы. Мәңгі двигательдің екінші түрін жасау мүмкін емес.
Кейде термодинамиканың бұл екі заңын мәңгі двигательдер жасауға болмайтынын дәлелдейтін заңдар деп те атайды.
Бірінші заң. Мәңгі двигательдің бірінші түрін жасау, яғни сырттан энергия алмай жұмыс атқаратын машина жасау мүмкін емес.
Екінші заң. Мәңгі двигательдің екінші түрін жасау, яғни тек бір дененің сууы нәтижесінде жұмыс жасайтын машина жасау мүмкін емес.
Жылу машинасы деп отының ішкі энергиясын механикалық энергияға айналдыратын, яғни отын молекуласының ретсіз (хаосты) қозғалысын тәртіпті қозғалысқа түсіретін құралды айтады.
Тіршілікте бізді қоршаған құбылыстар мен қозғалыстар үлкен үш топқа бөлінеді. Бірінші топтағы жұмыстарды жүргізу үшін сырттан күш жұмсалады және ол күштің мөлшері осы жұмысқа ту-ра пропорционалды. Мысалы, бір жүкті жоғары көтеру, тұрақты токты пайдаланып суды ыдырату, жер жырту, бір орнынан екінші орынға берілген затты тасымалдау сияқты жұмыстар осы топтағы жұмыстар мен қозғалыстарға дәлел. Оларды жүргізу үшін күш жүмсау қажет.
Демек, бұл топтағы жұмыстар өздігінен жүрмейді және оларды еріксіз жүргізілетін жұмыстар дейді екен. Екінші топқа өздігінен жүретін жұмыстар жатады. Мұндағы жұмыс нәти-жесінде сыртқы күшке қарсы жұмыс алынбайды. Оларға ешбір кедергісіздік жағдайларындағы горизонталь жазықтықтың үстін-де кішкене шардың дөңгелей қозғалуы, сағат маятнигінің тербел-мелі қозғалуы мысал. Ал үшінші топтағы жұмыстарға өздігінен, емін-еркін жүретін процестер жатады немесе мұндағы жұмыс нә-тижесінде пайда болатын өзгеріске, оған пропорционалды түрде сырттан күш жүмсалмайды. Оған көтерілген жүктің төмен түсуі, тастың құлауы, күшті қышқыл мен күшті негіздің өзара бірін-бірі нейтралдауы, жұмыс істеп түрған гальваникалық злементтегі кез келген химиялық реакциялар^ көмір, жанар май, газ сияқты отын-дардың жануы, қопарылғыш заттардың жарылуы, ылғалды атмос-ферадағы металдың (темірдің) тотықтануы сияқты өмір мен өнді-рісте жиі кездесетін құбылыстар мен процестер мысал. Үшінші топтағылар оң, ал бірінші топтағы, өздерінің жүруі үшін тыстан күш қажет ететіндер теріс жұмыс делінеді, екінші топтағыда жұ-мыс жоқ.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz