Таралу заңы және экстракция: тұндырма мен қайнатпа алу принциптері


Оңтүстік Қазақстан Медицина академиясы “АҚ”
Химиялық пәндер кафедрасы
Тақырыбы: Таралу заңы. Экстракция.
Тұндырма, қайнатпалар алу принциптері
Орындаған: Мұратхан И.
Тобы: В-ФҚБ-02-17
Қабылдаған: Джантураева А.
- Жоспар:
І. Кіріспе
ІІ. Негізгі бөлім
2. 1 Таралу заңы
2. 2 Экстракция
2. 3 Тұндырма, қайнатпа алу принциптері
ІІІ. Қорытынды
ІV. Пайдаланылған әдебиеттер
Екі араласпайтын сұйықтықта үшінші затты ерітсек, ол еріткіштер арасында белгілі түрде таралады. 3 - заттың концентрациясы аз және оның бөлшектерінің өлшемдері екі фазада бірдей болса, оның жүйедегі концентрациясын арттыру екі фазадағы осы заттың концентрацияларын пропорционалды түрде өсіреді. ТАРАЛУ ЗАҢЫ
Берілген температурада 3-ші компоненттің тепе-теңдіктегі екі сұйық фазалардағы концентрацияларының қатынасына тұрақты шама болып табылады.
K=С1, А/С2, В = С3, А/С4, В =
С5, А/С6, В = const
К - таралу коэффиценті, ол температураға, заттар табиғатына, ерітіндінің иондық күшіне тәуелді. Бірақ таралатын зат концентрациясына тәуелсіз.
Экстракция деп заттың екі өзара араласпайтын еріткіштердің арасында таралу процесін айтады. Бұл процесс әрекеттесуші массалар заңымен сипатталатын қайтымды процесс. Тепе-теңдік екі араласпайтын сұйықтардың, яғни екі фаза арасында жүргендіктен ол гетерогенді тепе-теңдікке жатады. Әдетте араласпайтын сұйықтың біреуі су, екіншісі - органикалық еріткіш. Көптеген органикалық сұйықтар сумен араласпайды. Осындай сұйықты суға қосқанда екі қабат пайда болады. Егер органикалық сұйықтың тығыздығы судың тығыздығынан үлкен болса, онда ол төменгі қабатта орналасады, ал керісінше органикалық сұйықтың тығыздығы судың тығыздығынан кем яғни, аз болса, бұл сұйық судың үстіне шығып жоғарғы қабат түзеді. Таңдап алған органикалық еріткішті судың ерітіндісімен шайқағаннан кейін оның тамшылары тез қосылып бөлек қабат түзуі қажет. Екі қабатқа тез бөліну органикалық сұйық пен судың тығыздықтарының қатынасына байланысты. Салыстырмалы тығыздық (сал. тығ. ) бірден анағұрлым көп не кем болуы керек.
Металдардың координациялық қосылыстарын экстракциялауға ауыр еріткіш ретінде кең хлороформ CHCl 3 (сал. тығ. 1, 49) және төртхлорлы көміртегі CCl 4 (сал. тығ. 1, 59) қолданылады. Әдетте жеңіл еріткіштер болып бензол C 6 H 6 (сал. тығ. 0, 88), диэтилді эфир C 2 H 5 OC 2 H 5 (сал. тығ. 0, 71) есептеледі. Көптеген заттарды экстракция жолымен бөлуде қолданылатын жақсы еріткіш қатарына метилизобутилкетон CH 3 COCH 2 CH(CH 3 ) 2 (сал. тығ. 0, 80) жатады.
Суда еріген заттың сумен араласпайтын органикалық еріткішке ауысуы: а) экстракцияланатын қосылыс органикалық еріткіште суға қарағанда жақсы ерісе; б) экстракцияланатын қосылыс зарядталмаған болса; в) оның молекуласының мөлшері үлкен болса басым жүреді.
Экстракциялану жүйелеріндегі тепе-теңдікті Нернст-Шилов таралу заңы және әрекеттесуші массалар заңымен сипаттауға болады. Фазалар түйіскенде заттың бір фазадан екінші фазаға ауысуы байқалады. Бір фазада заттың концентрациясы көбейеді, екіншісінде - азаяды. Концентрациялардың белгілі бір қатынасында динамикалық тепе-теңдік орнайды:
А су ↔︎ А орг
Тепе-теңдік константасы:
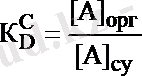
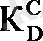 - концентрациялық таралу константасы деп аталады, [A]
o
және [A]
су
- заттың органикалық еріткіштегі және судағы тепе-теңдік концентрациялары.
- концентрациялық таралу константасы деп аталады, [A]
o
және [A]
су
- заттың органикалық еріткіштегі және судағы тепе-теңдік концентрациялары.
Таралу константасы экстракцияланатын зат пен еріткіштердің табиғатына және температураға тәуелді. Жиі
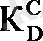 мәні жуық мәнмен заттың әр еріткіштегі ерігіштігінің қатынасымен анықталады. Мысалы, иодтың судағы ерігіштігі 0, 034 г/100мл, ал төртхлорлы көміртегіндегі ерігіштігі 2, 905 г/100мл, осыдан иодтың таралу константасы
мәні жуық мәнмен заттың әр еріткіштегі ерігіштігінің қатынасымен анықталады. Мысалы, иодтың судағы ерігіштігі 0, 034 г/100мл, ал төртхлорлы көміртегіндегі ерігіштігі 2, 905 г/100мл, осыдан иодтың таралу константасы
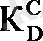 =2, 905/0, 034 = 85, 44.
=2, 905/0, 034 = 85, 44.
Экстракциялау процесінің тағы бір сандық сипаттамасы заттың органикалық фазадағы мөлшері мен оның жүйедегі жалпы мөлшерінің қатынасына сәйкес экстракциялану дәрежесі:
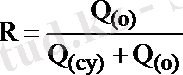
Q (o) , Q (су) - заттың органикалық фазадағы және судағы мөлшерлері.
Экстракциялану дәрежесін әдетте үлеспен не пайызбен белгілейді:
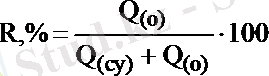
Егер заттың мөлшерін концентрация мен көлем арқылы белгілесек:
Q (o) = C A(o) . V (o) ; Q (су) = C A(cy) . V (cу)
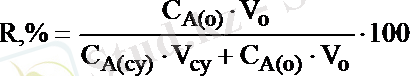 (14. 7)
(14. 7)
теңдігін алымын да, бөлімін де С А(су) . V o көбейтіндісіне бөліп, осы теңдіктің таралу коэффициентімен байланысын алуға болады:
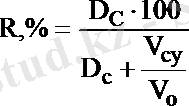 (14. 8)
(14. 8)
Егер V
cy
= V
o
болса, онда
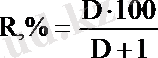
Экстракциядан кейін қалған заттың бөлігін бір деп алып, айырымды 100-ге көбейтсек “n” рет экстракциялағаннан кейінгі экстракциялау дәрежесін (R%) табамыз:

Бейорганикалық ионның комплекстік қосылыс түзіп экстракциялануын қайтымды химиялық реакция деп қарастыруға болады:
M n+ cy + nH 2 L (o) ↔︎ ML n(o) + mH + cy
Келтірілген реакцияның тепе-теңдік константасын экстракциялану константасы деп атайды - K ex :
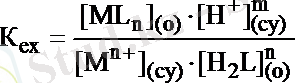 (14. 10)
(14. 10)
Егер органикалық фазада тек ML n , ал судағы фазада тек M n+ иондары жүрсе жүйенің таралу коэффициенті:
D С = [ML n ] o / [M n+ ] cy (14. 11)
Осыған сәйкес экстракциялану константасын былай жазуға болады:
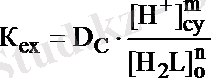 теңдіктен:
теңдіктен:
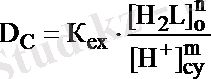
Таралу коэффициентінің мәні ерітіндінің рН-на және органикалық фазадағы лигандтың концентрациясына тәуелді.
(14. 13) теңдіктің екі жағын да логарифмдесек:
lgD С = nlg[H 2 L] o - mlg[H + ] cy + lgK ex
Егер сутегі иондарының концентрациясын тұрақты етіп ұстап, органикалық фазадағы H 2 L концентрациясын өзгертсек lgD С = f(lg[H 2 L] ) байланысына сәйкес түзудің көлбеу бұрышының тангенсі “n” мәніне тең болады. Егер керісінше [H 2 L] тұрақты болып, [H + ] өзгерсе, lgD С = f(lg[H + ] ) байланысына сәйкес түзудің көлбеуі бұрышының тангенсі “m” мәніне тең болады.
 tgα = n lg[H
2
L]
tgα = n lg[H
2
L]
 tgα = m pH
tgα = m pH
Осыдан экстракцияланатын қосылыстың құрамын анықтауға болады. Мысалы, мыс иондарын селективті экстракциялайтын оксим H 2 L мыспен реагенттің концентрациясы аз болғанда жасыл комплекс, ал реагент көп болғанда қоңыр комплекс түзеді. lgD С = f(lg[H 2 L] ) байланысының графигінен жасыл комплекске сәйкес “n” мәні бірге тең, ал қоңыр комплекс үшін n = 2. Осыдан жасыл комплекстің түзілу реакциясы: Cu 2+ + H 2 L → CuL + 2 H + , ал қоңыр комплекстің түзілу реакциясы: Cu 2+ + 2H 2 L → Cu(HL) 2 + 2H + .
Жоғарыда келтірілген теңдіктерде бір заттың әртүрлі фазаларда таралуы қарастырылды. Ал екі заттың бөлінуін сипаттайтын мән ол - бөліну коэффициенті. Бөліну коэффициенті бірдей жағдайда анықталған екі А және В заттарының таралу коэффициенттерінің қатынасына сәйкес:
К А/В = D А /D В
Неғұрлым бөліну коэффициентінің мәні үлкен болса, соғұрлым екі заттың бөлінуі толық жүреді. Ең жақсы бөліну К А/В >> 1 және D А . D В ≈ 1 болғанда байқалады.
Экстракциялық жүйелердің бірнеше жіктелуі бар. Біреуінің негізіне қосылыстардың судағы фазадан органикалық фазаға ауысуына сәйкес реакциялары жатады. Екіншісінің негізіне пайдаланатын органикалық еріткіштің (экстрагент) табиғаты жатады. Мысалы, экстрагенттің қышқылды-негіздік қасиетіне негізделіп экстрагенттерді үш топшаға бөлуге болады:
1. Бейтарапты - эфирлер, кетондар, спирттер;
2. Қышқылды (басқаша катионалмасқыш) - карбон қышқылдары, алкилфосфор қышқылдары, 8-оксихинолин, дитизон;
3. Негізді (анионалмасқыш) - жоғарғы молекулалық аминдер, төрттік аммоний негіздері.
Қышқылдық экстрагенттермен катионалмасу экстракциясы, негіздік экстрагенттермен анионалмасу экстракциясы жүреді.
Экстракциялық әдіс аналитикалық химияда кең қолданылады: реакциялардың таңдамалылығын арттыру, иондарды бөлу, микрокомпоненттерді концентрлеу, т. б. Экстракциялау әдісімен көпкомпонентті күрделі қоспаларды тиімді және тез бөлуге болады.
Тұндырма - дәрілік өсімдік шикізаттарынан спиртпен экстрациялау арқылы алынатын сұйық дәрілік сорындылар. Тұндырманың дәмі, иісі, бояуы оны дайындауда қолданылатын дәрілік өсімдік шикізаттарға (ДӨШ) ұқсас болады. ДӨШ-тің бір түрінен дайындалған сорындыны қарапайым, ал бірнеше түрінен алынған сорындыны - күрделі тұндырма деп атайды. Тұндырмаларды дайындау үшін кептірілген өсімдік материалдарын, ал кей кезде жас өсімдік шикізаттарын қолданады. Әсері күшті емес құрғақ стандартты шикізаттан тұндырманы 1: 5 не 1: 10 қатысында дайындайды. ДӨШ-тен әр түрлі тұндырмаларды дайындағанда, еріткіш ретінде этил спиртінің әр түрлі концентрациясын қолданады. Мысалы, меңдуана, бөріқарақат, шайқурай, т. б.
тұндырманы дайындағанда 70%-дық, кейде 40%-дық спирт экстрагент ретінде қолданылады. Тұндырманы мацерация, турбоэкстрациялы мацерация экстракт С) сақтайды. Тұндырмалар емдік тәжірибелерде жеке препарат ретінде ішке және сыртқа, сондай-ақ микстура, тамшылар, жағылмалар, пластырлар құрамына енгізіліп отырады. Стан төмен темп-рада бірнеше тәулік тұндырып, сүзіп тазалайды. Әсер етуші заттар тұндырманың мөлшерін, этанол концентрация -сын, тығыздығын, құрғақ қалдықты анықтайды. Егер әсер етуші заттардың мөлшері жоғары болса, тұндыр маны нормасына дейін сұйылтып, стандарттайды. Алынған тұндырмаларды түрлі шыны ыдыстарда қат тап, рәсімдеп, жарық түспейтін салқын жерде (12 - 15 айналымы, бөлшекті мацерация, перколяция, қою және құрғақ еріткі-концентраттарды еріту әдістерімен алады.
ҚАЙНАТПА - медицинада - дәрі-дәрмектің сұйық түрі. Оларды дәрілік өсімдік шикізатынан алынған концентратты суда еріту немесе су моншасымен қыздыра отырып сумен экстракциялау арқылы алады. Қайнатпаны сұйық дәрі ретінде ішеді (жүрек, бауыр, бүйрек, т. б. ауырғанда) және денеге шыққан жараны жуып, шаю үшін пайдаланады. Қайнатпаны дайындау үшін өсімдіктердің жапырақтары мен, гүлдерінің ірілігі 5 мм, сабағы, қабығы, тамыры мен тамыршаларын 3 мм, жемістері мен тұқымдарын 0, 5 мм-дей, ал қабаты қалың өсімдік жапырақтарын 1 мм-ден артық болмайтындай етіп ұсақтайды. Ұсақталған өсімдік шикізатын фарфор, эмаль немесе тотықпайтын металдан жасалған ыдысқа салып, үстіне салқын (бөлме темп-расындағы) су құйып, ыдыстың қақпағын жауып, оны қайнап тұрған су моншасында 30 мин қыздырады. Алынған қайнатпа суығаннан кейін (10 мин-тай) сүзіліп, ыдыста қалған өсімдік шикізаты арнайы түтікше үстінде (воронка) сығылады.
Сұйықтықтың көлемі рецептте көрсетілген көлемге жеткенше таза қайнаған су қосады. Қайнатпаны экстракт концентратты еріту арқылы дайындайтын болса, онда экстракт концентрат мөлшерін рецептте көрсетілген өсімдік шикізатының мөлшеріне тең етіп алады. Егер рецептте дәрілік шикізат мөлшері көрсетілмесе, онда өсімдік шикізатының 10 салмақ бөлігінен 100 көлем бөлік қайнатпа дайындалады. Күшті әсер ететін дәрілік өсімдік шикізаттарынан қайнатпаны тек дәрігер жасаған рецепт бойынша дайындайды. Жанаргүл, меруертгүл, мекет, шүйгін шөп, т. б. өсімдіктер тамыры мен тамыршасынан Қайнатпаны 1:30 қатысында дайындайды. Сироптар, тұндырмалар және сұйық экстракттар алдын ала дайындалған Қ-ға қосылады. Құрамында алколоидтар болатын өсімдік шикізатынан Қайнатпаны дайындағанда, оған лимон, шарап немесесутек хлор қышқылын қосады. Қышқыл мөлшері өсімдік шикізатының құрамындағы алколоидтың салмақ мөлшеріне байланысты қосылады. Емдік мақсатта жаңа дайындалған Қайнатпаны пайдаланады. Оны қолданар алдында шайқайды және салқын жерде сақтайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz