Рений қорытпасы негізіндегі рений-никель қаптамаларын электролиттік тұндыру және кондуктометриялық бағалау


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
Қ. И СӘТПАЕВ атындағы ҚАЗАҚ ҰЛТТЫҚ ТЕХНИКАЛЫҚ УНИВЕРСИТЕТІ
МП және АТМ кафедрасы
ЕСЕП БЕРУ
Тақырыбы: Рений қорытпасы негізінде қаптамаларды электролиттік тұндыру
Оқытушы Байқоңырова А. Ө.
Студент Саркеев Н. Ж.
Мамандығы 240440
Тобы МЦИ-03-1к
Алматы 2007ж.
Мазмұны
Кіріспе . . . 3
1. Ренийді және қорытпасын алу әдістері . . . 4
2. Рений және оның негізгі қосылыстарының физика-химиялық
қасиеттері . . . -
3. Ерітіндінің электр өткізгіштігін кондуктометр әдісімен анықтау
және нәтижелері . . . 9
3. 1 Ерітінділердің электр өткізгіштігі арқылы комплексті иондардың
тұрақсыздық константасын анықтау . . . 12
4. Рений қорытпаларын төрт камералы мембраналық электролизде алу
және тәжірибелік жұмыстар . . . 13
4. 1 Алынған рений қаптамаларын Na және аммоний гидроксидінде
анодтық еріту . . . 19
Қорытынды . . . 21
Пайдаланылған әдебиеттер . . . 22
Кіріспе
Қазіргі техника саласында қолданылатын сирек металдардың рөлі ерекше. Жоғарыда айтылған металдардың арасында кездесетін шашыранды металл рений маңызды орын алады. Ренийдің табиғаттағы шикізаттары мен өнеркәсіптегі өндіру технологиялары өте күрделі. Сондықтан ренийдің әр түрлі шикізаттарын анықтаумен қатар, металды келешекте өндіру процесінтерін болашақ жас мамандар жақсы меңгере білу керек.
Біздің ғасырымыздың 60-шы жылдарының соңында ренийдің дүние жүзілік өндірісі жылына 1-2 тонна деңгейіне жетті. Барлық өндірілген ренийдің 80 %-ке жуығы әр түрлі қоспалы құймалар алуға, әсіресе молибден мен вольфрамның құймаларында қолданылған. Содан кейінгі жылдары ренийді мұнай -химия өнеркәсібінде өте сапалы бензин (жанармай) алу үшін платина-ренийлі катализатор ретінде қолданды. Ренийді осы мақсатқа қолдану, қондырғының 40-50 %-ке дейін өнімділігін арттырып, катализатордың жұмыс істеу қабілеттілігін 3-6 ретке ұзартты және платина шығынын кемітті.
Сирек кездесетін металл ренийдің 90-жылдардан бастап жаңа салаларға қолдану басталды. Мысалы, кейінгі кезде ұшақтармен кеңістікте қолданылатын аппараттардың турбиналарын, реактивті және турбо реактивтік двигателдерін жасауға қолданылды. Осыған байланысты кейінгі кезде ренийді өндіру үшін жаңа өндіріс орындарын ашып, комплекстік техналогияларды қолдану арқылы мынадай шикізаттардан, мысалы молибденит пен мысты байытылған концентраттарынан ренийді толық бөліп алу негізделген.
1. Ренийдің қорытпасын алу әдістері
Кәзіргі уақытта Қазақстан Республикасының ренийді алатын жерінің негізгі көзі Жезқазған мыс рудаларының кен орны болып табылады. Мыс кендерінің құрамында 90 рений кездеседі [1] .
Мыс кендерін флатациялық байыту кезінде кендегі ренийдің біраз бөлігі күрделі тотыққан байланыста отвальдық бөлімге, ал қалған бөлігі флатациялық суда қалады. Мыс концентраттарын балқу процесі кезінде ренийдің негізгі бөлігі газдық фазаға өтеді, содан кейін күкірт қышқылында тазалайды. Күкірт қышқылымен жуу арқылы ренийді бөліп алады. Ренийді толық мыс концентраттарынан бөліп алу үшін газдарды толық ұстап, оның құрамынан көрсетілген процестер арқылы бөліп аламыз. Көптеген процестер арқылы күкірт қышқылымен жуылған ерітіндіде ренийдің мөлшері 150-130 г/дм және күкірт қышқылында 600 г /дм болады [2] .
Күкірт қышқылымен жуылған ерітіндіден ренийді бөліп алудың екі технологиясы бар-сорбциялық және экстракциялық [3] .
Сорбциялық процесс ренийді ион алмастырғыш арқылы қарапайым бөліп алу, сорбент ионның перренат ионға жеткілікті талғамдылығы және агрессивті ортада иониттердің химиялық тұрақтылығы. Бірақ бұл әдістің кемшілігі рений бойынша сорбенттің сыйымдылығының артығы және күкірт қышқылы концентратциясының белгілі бір мөлшерде ғана болатындығы-150 г/л [4] .
Ренийді бөліп алуда экстракциялық әдіс күкірт қышқылды ерітіндідегі концентратцияның жоғары интервалында және жоғары жылдамдықта процестің жүруіне негізделген. Бірақ та ол ластанған сулы ортада органикалық байланысқан болады. Сондықтан сулы ортадан тазартуды қажет етеді. Және де экстракциялық әдісте органикалық экстрагенттер қауіпті болады [5] .
Осы екі тенхологияның соңғы өнімі көптеген жағдайларда металдық ренийді алуда болып аммоний перренаты табылады.
Металдық ренийді алуда практикада аммоний перренатын жоғары температурада тотықтыру әдісі және қышқыл электролиттерді электролизде қолдану әдісі болып табылады [6] .
2. Ренийдің және оның негізгі қосылыстарының физика-
химиялық қасиеттері
Рений жоғары температурада 3180 0 С балқитын металл, оның сыртқы түрі болатқа ұқсайды. Сондықтан балқу температурасына байланысты, ол вольфрамнан кейінгі екінші ауыр металл, оның қорытпалары болатқа ұқсас келеді. Қалыпты жағдайда рений жұмсақ, ал ұнтақтары қара немесе сұр түсті болады. Ренийдің кейбір физикалық қасиеттері төменде көрсетілген.
Атомдық нөмірі 75
Атомдық салмағы 186, 31
Тығыздығы, кг/м 21, 0
Балқу температурасы, 0 С 3180 ± 20
Қайнау температурасы 0 , С 5900
Жылу өткізгізгіштігі, Вт 712, 3
Қаттылығы, МПА 1960
Модульды серпімділігі, ГПа 470
Қалыпты температурада рений ауада тұрақты, ал оны 300 0 С-тан жоғары қыздырғанда ренийдің ангидриді (Re 2 O 7 ) пайда болады, температураны одан жоғары көтерген сайын, тотығу процесі өте жылдам жүреді.
Сутегімен металл оның балқу температурасына дейін әрекеттеспейді, ол азотпен жалпы қосылыста болмайды, бірақ оның нитридтері, аммиак пен ренийдің хлоридін әрекеттестіру арқылы алынады. Ренийдің басқа баяу балқитын металдармен ерекшелігі, ол көміртегі, бром, йодпен әрекеттеспейді. Хлормен, күкіртпен және фтормен тек қыздырғанда әрекеттеседі. Тұз және сутек қышқылдарында рений ерімейді, ол азот пен күкірт қышқылдарын қыздырғанда және сутегінінің қос тотығында жақсы ериді.
Re + 7HNO 3 = HReO 4 + 3H 2 O + 7NO 2 (1)
2Re+7H 2 O 2 = 2HReO 4 +6H 2 O (2)
Ренийдің ұнтағы сілтілермен ауада тұрақты немесе тотықтандырғыштармен балқытқанда рений қышқылының тұздары түзіледі. Ренийдің өзі балқытылған күміс, қалайы, мырыш және мыста төзімді, ол никель мен темірде жақсы ериді. Ренийдің оң валентті 6, 5, 4, 3, 2, 1 және теріс 1 валентті қосылыстары белгілі, бірақ оның ішінде 7 валентті қосылыстары тұрақты келеді.
Рений технологиясында ренийдің 7, 6, 4, 3 валентті қосылыстары үлкен рөл атқарады. Рений қосылыстарының ішіндегі ең негізгі тотықтары: рений ангидриді
Re 2 O 7 , үш тотықты рений ReO 3 және ренийдің қос тотығы ReO 2 .
Рений ангидриді немесе (VII) валентті рений тотығы металмен немесе оның қосылыстарының ауада тотығуының нәтижесінде пайда болады. Мысалы, ренийдің дисульфиді ReS 2 .
4Re + 7O 2 = 2Re 2 O 7 + Q (3)
2ReS 2 + 7, 5O 2 = Re 2 О 7 + 4SO 2 (4)
Рений оксидінің (VII) кристалы ақшыл-сары түсті келеді. Балқу температурасы 297 0 С, қайнау температурасы 363 0 С.
Оның қаныққан буының қысымы мен әр түрлі температурадағы тәуелділігі төменде келтірілген.
Температурасы, 0 С 150 200 250 300 360
Қысымы Р, мм. сынап бағанасы: 5, 6*10 -3 0, 35 10, 2 160 711
Рений оксидінің (VII) өте ылғал тартқыш, сондықтан, ауада ылғалды сіңіріп рений қышқылын түзеді:
Re 2 O 7 + H 7 O = 2HReO 4 (5)
Көміртегі (II) мен күкірттің (IV) оксидтері рений ангидридін (VII) төменгі тотықтарына тотықсыздандырады. Сутегі оны 300 0 С-та диоксид тотығына (ReO 2 ),
500 0 С-та металға дейін тотықсыздандырады.
Ренийдің үш тотығы ReO 3 -қатты зат, сары-қызыл түсті келеді. Ол рений ұнтағының толық тотықталмаған кезінде түзіледі.
Таза үш тотықты ренийді ауаның қатынасынсыз 250 0 С-та, рений оксидін рений (VII) ұнтағымен қосып қыздырғанда түзіледі:
3Re 2 O 7 + Re = 7ReO 3 (6)
Ауада үш тотықты ренийді ReO 3 100 0 С-та дейін қыздырғанда тұрақты күйінде болады, ал температураны жоғары көтерген сайын рений ангидридіне дейін тотығады.
Вакуумде 400 0 С-тан жоғары температурада диспрпорцияланады (ыдырайды) :
3 ReO 3 ↔︎ ReO 2 + Re 2 O 7 (7)
Суда үш тотықты рений ReO 3 ерімейді. Тұз және күкірт қышқылдарымен және сумен араласқан сілті ерітінділерімен әрекеттеспейді. Натрий оксидімен қосып балқытқанда, натрий перренаты және натрий рениті түзіледі:
3ReO 3 + 2Na 2 O = 2 NaReO 4 + Na 2 ReO 3 (8)
Ренийдің қос тотығы ReO 3 -қатты зат, түсі қоңыр-қара, оны Re 2 O 7 немесе ReO 3 -ті сутегімен 300 0 С-та тотықсыздандырғанда, аммонийдің перренатын инертті ортада 400 0 С-та ыдыратқанда немесе бес хлорлы ренийді ReCI 5 гидролитті процеспен бөлу арқылы алуға болады:
3ReCI 5 + 8H 2 O → 2ReO 2 + H 2 O + 15HCI (9)
Вакуумде 750 0 С-тан жоғары қыздырғанда, ренийдің қос тотығы (ReO 2 ) ыдырап, рений және ренийдің оксиді (VII) түзіледі:
7ReO 2 →2Re 2 O 7 +3Re (10)
Химиялық сипаттамасы бойынша ренийдің қос тотығы (ReO 2 ) амфотерлі оксид.
Суда және сумен сұйытылған қышқылдарда, сонымен қатар концентрациясы жоғары тұз және фтор сутекті қышқылдарында ерімейді. Азот қышқылымен және сутегі қос тотығымен немесе хлорлы сумен өңдегенде, ренийдің қос тотығы рений қышқылына дейін тотығады.
Сілті мен ренийдің қос тотығын (ReO 2 ) қосып балқытқанда құрамында бір валентті металы бар Me 2 ReO 3 ренит түзіледі.
Рений қышқылы HReO 4 - өте күшті бір негізді қышқыл. Рений қышқылы рений ангидридін суда еріткенде немесе ерітіндіде ренийдің төменгі тотығын тотықтырғышпен әсер еткенде түзіледі.
Re 2 O 7 +H 2 O=2HReO 4 (11)
Рений қышқылының марганец қышқылынан айырмашылығы әлсіз тотықтан-дырғыш. Бос күйінде қышқылды бөліп алу қиын, өйткені концентрациялы рений қышқылының сулы ерітіндісін қыздырғанда ерітінді ыдырап рений ангидриді түзіледі.
Рений қышқылы ерітіндіде түссіз, концентрациясы 60%-те жоғары болса, ерітінді жасыл-сары түске айналады.
Рений қышқылы, карбонаттар, сілтілер және оксидтермен әрекеттескенде перренаттар (MeReO 4 ) түзіледі. Таллийдің, калийдің және рубидийдің перренаттары суда өте аз ериді. Натрий, магний және кальций перренаттары суда жақсы ериді, ал аммоний мен мыс перренаттары аздап ериді.
Перренаттардың кейбір қасиеттері 1-ші кестеде келтірілген.
1 кесте - Перренаттардың кейбір қасиеттері
Перренаттардың
Түрлері
Тығыздығы,
г/см 3
TlReO 4
KReO 4
RbReO 4
CsReО 4
NHReO 4
NaReO 4
Ca(ReO 4 ) 2
Cu(ReO 4 ) 2
Fe(ReO 4 ) 2
Fe(ReO 4 ) 2
0, 115
0, 36
0, 39
0, 33
2, 76
103
-
-
-
-
0, 289
1, 47
1, 56
1, 09
8, 7
145
187
210
233
270
0, 555
3, 2
3, 42
2, 44
16, 01
173
-
-
-
-
525
555
598
616
200 С-тан жоғары ыдырайды
414
934
ыдырайды
-
-
6, 89
4, 38
4, 73
4, 76
3, 55
5, 24
4, 94
3, 72
-
-
Ренийдің хлоридтері . Рений хлоридтерінің арасындағы зерттелгені бес және үш хлорлы рений. Бес хлорлы рений ReCI 5 , ренийді 400 0 С-тан жоғарғы температурада хлормен әрекеттестіргенде түзіледі. ReCI 5 - қара-қоңыр түсті қатты зат. Оның балқу температурасы 260 0 С және қайнау температурасы 330 0 C-ға тең. Ылғалды ауада түтінденіп, гидролизденудің нәтижесінде тұз қышқылының буы түзіледі. Суда ренийдің пентахлориды төмендегі реакция бойынша ыдырайды:
3ReCI 5 + (8+х) H 2 O = 2ReO2 ∙ XH 2 O + HReO 4 +15HCI (12)
Пентахлорид тұз қышқылында еріп, HReO 4 пен HReCI 5 түзіледі де ерітінді жасыл түске айналады. Пентахлоридінің ұшуы 150 0 С-тан басталады, 180 0 С-тан жоғары температурада диссоцияланып үш хлорлы рений ReCI 3 түзіледі.
Оттегі атмосферасында пентахлоридті қыздырғанда ренийдің оксихлоридтері түзіледі.
8ReCI 5 +4O 2 =5ReOCI 4 +3ReOCI 2 +7CI 2 ↑ (13)
Үш хлорлы рений- қызыл-қара түсті зат, 730 0 С-та қысыммен қысқанда балқиды. 550 0 С-та үш хлорлы рений ReCI 3 ұшады, ауада ReCI 3 дигидратқа ReCI 3 ∙2H 2 O айналады.
Суда және тұз қышқылында еріп, HReCI 4 түзіледі. Сутегі 250 0 -300 0 С-та үш хлорлы ренийді металға дейін тотықсыздандырады.
Үш хлорлы ренийді ауада қыздырғанда ренийдің оксихлориды түзіледі:
6ReCI 3 + 7O 2 = 2ReOCI 4 + 4ReO 3 + 3CI 2 (14)
Ренийдің екі оксихлориды белгілі:
Балқу температурасы, 0 С Қайнау температурасы, 0 С
ReOCI 4 30 228
ReO 3 CI 4. 5 130
Хлоридтерді (ReCI 5, ReCI 3 ) оттегімен қосып 150 0 - 400 0 С-та қыздырғанда, ренийдің оксихлоридтері түзіледі.
Ренийдің сульфидтері. Ренийдің сульфиді(Re 2 S 7 ) және дисульфиді (ReS 2 ) жақсы зерттелген.
Жеті күкіртті рений қара-қоңыр түсті зат. Қышқыл және сілті ерітінділерінен сутекті күкіртпен (H 2 S) тұнбаланады.
Ерітінділерде қышқылдардың концентрациясы(4н. HCI немесе 6н. H 2 SO 4 ) жоғары болғанда, ренийдің сульфидтері толық ерітінділермен тұнбаланады.
2HReO 4 + 7H 2 S = Re 2 S 7 ↓ + 8 H 2 O (15)
Сілті ерітінділерінен тұнбалау процесі баяу жүреді. Бірақ, реакция кезінде біраз мөлшерде күкірт түзіледі, оны қайнатып бөліп алуға болады.
Суда, тұз және күкірт қышқылдарында және сілтілерде, тиосілтілерде рений сульфиді (VII) ерімейді, ал азот қышқылында ыдырап түзіледі.
Re 2 S 7 + 14HNO 3 = 2HReO 4 + 7SO 2 ↑ + 14NO↑ + 6H 2 O (16)
Инертті атмосферада 300 0 -400 0 С-ға дейін қыздырғанда, рений сульфиді(VII) ыдырап келесі реакция жүреді:
Re 2 S 7 = 2ReS 2 + 3S (17)
Ауада қыздырғанда рений сульфиді (Re 2 S 7 ) рений оксидіне (VII) айналып жылу бөлінеді:
2Re 2 S 7 + 21O 2 = 2Re 2 O 7 + 14SO 2 ↑ + Q (18)
Рений сульфидінен (Re 2 S 7 ) термиялық әдіспен ыдыратып, ренийдің дисульфидін (Re 2 S 2 ) немесе 850 0 -1000 0 С-та ренийді күкіртпен тура әрекеттестіріп алуға болады.
Рений дисульфиді қара түсті зат, оның торы (решеткасы) кристалды гексоналды болып келеді, молибденит (МоS 2 ) торына ұқсас. ReS 2 тығыздығы 7, 5 г∕см 3 тең, ол ауада 300 0 С-тан жоғары температурада тотықтанып ренийдің тотығы Re 2 O 7 түзіледі:
2ReS 2 +7. 5 O 2 =Re 2 O 7 + 4SO 2 ↑ (19)
Ренийдің дисульфиді сілтілерде, тұз және күкірт қышқылдарында ерімейді. Ыстық азот қышқылы немесе оның сұйытылған ерітіндісі, оны HReO 4 -ге дейін тотықтырады. Сутегі ағынында ReS 2 қыздырғанда, металға дейін тотықсызданады [7] .
3. Ерітіндінің электр өткізгіштігін кондуктометр әдісімен анықтау
және нәтижелері .
Кондуктометр ОК/ I түрі сұйықтардың электр өткізгіштігін анықтайтын құрылғы. Құрылғының ерекшелігі жаңа технологияда дәл өлшеуге негізделген. Құрылғының шкаласы сименс(ом -1 ) бірлігімен градирленген. Басқа кондуктометрге қарағанда ешқандай қиындық туғызбайды. 0, 1 микросиментен 0, 5 аралығында өлшейді. Бұл практика жүзінде электр өткізгіштікті анықтауға мүмкіндік береді. Сонымен қатар құрылғы тіркейтін құрылғылармен және компенсографпен жалғанады. Осылардың көмегімен автоматты түрде регулировка жасап жазып алады. Құрылғыда алты контурдық өлшейтін және қосатын нүктесі бар. Демек алты нүктені бір ғана құрылғыда анықтап өлшеуге болады.
Кондуктометрді негізгі қолданылатын аймақтары.
Физика-химиялық өлшеулерде, электр өткізгіштікті анықтауда, иондардың қозғалуын, тұрақты диссоциясаны, ерігіштік коэффициентін және тағы басқа анықтауларда қолданылады.
Кондуктометрдің жұмыс істеу мақсаты :
Зерттелетін ерітіндіге екі нейтралды электрод салынады. Олардың геометриялық өлшемі толық анықталған және берілетін кернеуі белгілі болады. Кернеудің берілуі 1-суретте келтірілген.
1-сурет. Кернеудің принципті берілуі
Көрсетілген сызба компенсацияның керегінсіз электронды блокта электр өткізгіштіктің сименс бірлігінде ауытқусыз мәндерін есептеп береді.
Факт бойынша электролиттің электр өткізгіштігін анықтауда тоқты поляризациялық түрде қолдануға болады. Егер ерітіндінің электр өткізгіштігі жоғары болса, қажетті бөлігі жоғары болады. Осы мақсатқа байланысты құрылғыға 80 Гц пен 3 кГц беретін жеке генератор қосылады.
Қосылған 500 микросименстен жоғары бөлігі бір уақытта таралуды автоматты түрде өлшейді. Ерітіндінің электрөткізгіштігі үлесті электр өткізгіштікпен анықталады.
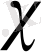 -ерітіндінің электр өткізгіштігі, электродтардың бет қабатында I см
2
аралығында бір-бірінен 1см қашықтықта орналасуы.
-ерітіндінің электр өткізгіштігі, электродтардың бет қабатында I см
2
аралығында бір-бірінен 1см қашықтықта орналасуы.
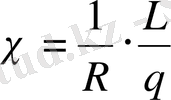 ом
-1
см
-1
(20)
ом
-1
см
-1
(20)
мұндағы:
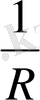 - электрөткізгіштік, (ом
-1
)
- электрөткізгіштік, (ом
-1
)
L- электродтардың аралығы, (см)
q-электродтардың бет қабаты, (см 3 )
Геометриялық анықтауы және кондуктометрде өлшенген ерітіндінің колибровкасы белгілі үлесті электр өткізгіштікте анықталады.
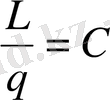 тұрақты қуысша (21)
тұрақты қуысша (21)
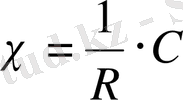 (22)
(22)
мұндағы: 1 ∕ R - құрылғының сименс шкаласындағы өзгерісі
 - колибровка жасалған ерітіндінің үлесті электр өткізгіштігі.
- колибровка жасалған ерітіндінің үлесті электр өткізгіштігі.
Электролиттердің электр өткізгіштігін анықтауда эквивалентті электр өткізгіштігі жиі қолданылады /
 /
/
Эквивалентті электр өткізгіштік үлесті электр өткізгіштікке қарағанда мына формуламен оңай анықталады.
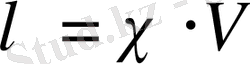 (23)
(23)
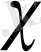 - үлесті электр өткізгіштік
- үлесті электр өткізгіштік
Ерітіндінің үлесті электр өткізгіштігінің мәндері 2-кестеде берілген[8] .
2 кесте - KCI ерітіндісінің үлесті электр өткізгіштігі
Концентрациясы,
н
Есептері:
1) 0. 01н KCI 20
0
С
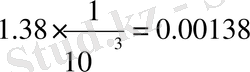
2) 0. 1н KCI 20
0
С
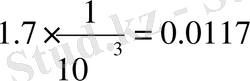
3) 1 н KCI 20
0
С
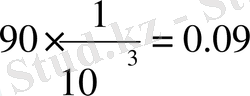
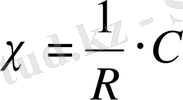 ;
;
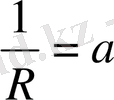 ;
;
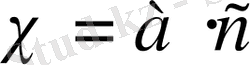 ;
;
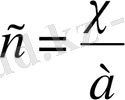
 1)
1)
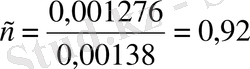
2)
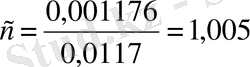
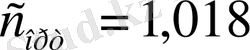
3)
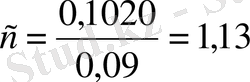
Құрамы әртүрлі ерітінділердің электр өткізгіштігін анықтау
1) 10 г/л - NaF, 1 мл- C 3 H 8 O 3
температурасы - 20
0
С
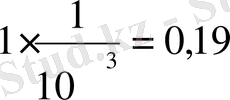
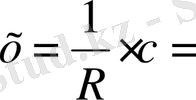 0, 019∙0, 018=0, 019342
0, 019∙0, 018=0, 019342
2) 20 г/л - NiSO 4 , 7, 2 г/л - NH 4 ReO 4
8, 4 г/л - H 2 WO 4, 10 г/л- NaF
температурасы - 20
0
С
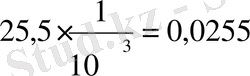
 0, 0255∙1, 018=0, 025959
0, 0255∙1, 018=0, 025959
3) 20 г/л- NiSO 4, 8, 4- H 2 WO 4
1 мл - C 3 H 8 O 3
температурасы - 20
0
С
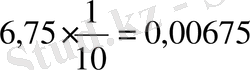
 0, 00675 ∙1, 08 = 0, 0068715
0, 00675 ∙1, 08 = 0, 0068715
4) 20 г/л- NiSO 4 , 7, 2 г/л - NH 4 ReO
1 мл - C 3 H 8 O 3
температурасы - 20
0
С
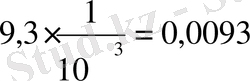
 0, 0093∙1, 08=0, 0094674
0, 0093∙1, 08=0, 0094674
5) 8, 4 г/л- H 2 WO 4 , 1 мл - C 3 H 8 O 3
температурасы - 20
0
С
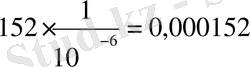
 0, 000152∙1, 08=0, 000154736
0, 000152∙1, 08=0, 000154736
6) 7, 2 г/л - NH 4 ReO 4 , 1 мл - C 3 H 8 O 3
температурасы - 20
0
С
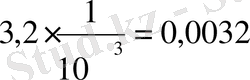
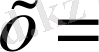 0, 0032∙1, 08=0, 0032576
0, 0032∙1, 08=0, 0032576
3. 1 Ерітінділердің электр өткізгіштігі арқылы комплексті
иондардың тұрақсыздық константасын анықтау.
Дайындалған қоспалардың комплексті анықтауында әртүрлі дайындалған ерітінділерді аламыз. Ерітінділер, мысалы - NiSO
4
(I) концентратциясы
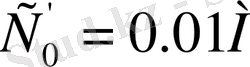 немесе C
3
H
8
O
3
тағы басқа комплекс түзуші концентратциялары
немесе C
3
H
8
O
3
тағы басқа комплекс түзуші концентратциялары
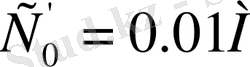 және
және
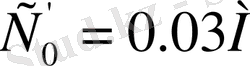 аламыз. Төртінші компанентке дистилденген су алынады. Алынған ерітінділердің мәндерін кестеге жазады. Осы қоспаларды I+IV, III+IV немесе I+III аналогты түрде анықтайды.
аламыз. Төртінші компанентке дистилденген су алынады. Алынған ерітінділердің мәндерін кестеге жазады. Осы қоспаларды I+IV, III+IV немесе I+III аналогты түрде анықтайды.
Осы кезде олардын артықшылығы
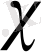 жеке анықталады.
жеке анықталады.
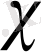 Е
-
Е
-
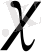 С
, мұндағы
С
, мұндағы
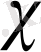 С
- қоспалардың I+II, I+III электр өткізгіштігі, а
С
- қоспалардың I+II, I+III электр өткізгіштігі, а
 қоспалардың I+IV немесе II+IV суммарлық электр өткізгіштігі. Осыдан кейін қоспаның құрамы мен
қоспалардың I+IV немесе II+IV суммарлық электр өткізгіштігі. Осыдан кейін қоспаның құрамы мен
 тәуелділігінде график тұрғызады.
тәуелділігінде график тұрғызады.
 Электр өткізгіштікті Ni мен глицериннің комплекс түзбейтіндігі немесе комплекс түзетіндігі үшін анықтаймыз. Егер дайындалған ерітінділер комплекс түзетін болса, электр өткізгіштігі азаяды, ал комплекс түзбесе электр өткізгіштігі өз мәнінде қалып кей кездері жоғарылайды. Әртүрлі қоспалардың электр өткізгіштігі 3-кестеде анықталған.
Электр өткізгіштікті Ni мен глицериннің комплекс түзбейтіндігі немесе комплекс түзетіндігі үшін анықтаймыз. Егер дайындалған ерітінділер комплекс түзетін болса, электр өткізгіштігі азаяды, ал комплекс түзбесе электр өткізгіштігі өз мәнінде қалып кей кездері жоғарылайды. Әртүрлі қоспалардың электр өткізгіштігі 3-кестеде анықталған.
3 кесте - NiSO 4, C 3 H 8 O 3 және H 2 O ерітінділерінің электр өткізгіштігінің анықталған мәндері.
NiSO 4
0, 01м мл
H 2 O мл
 1
1
Ом -1 см -1
C 3 H 8 O 3
0, 01м
H 2 O мл
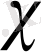 2
2
Ом -1 см -1
NiSO 4
0, 01м мл
C 3 H 8 O 3
0, 01м
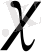 С
=
С
=
NiSO 4 +
C 3 H 8 O 3 0, 01м
Ом -1 см -1
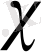 =
=
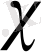 1
+
1
+
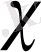 2
2
Ом -1 см -1































4. Рений қорытпаларын төрт камералы мембраналық
электролизде алу және тәжірибелік жұмыстар.
Рений қаптамаларын төрт камералы мембраналы электролизде алады. Төрт камералы мембраналы электролизер 2-суретте көрсетілген.
катод 5 анод
1 2 3 4
Жұмыс-
шы H 2 SO 4 H 2 SO 4 HCI
ерітінді (10г/л) (10 г/л) (10 г/л)
2-сурет. Төрт камералы мембраналы электролизер: 1-катодтық, 2, 3- ортаңғы, 4-анодтық камера, 5-мембрана
Төрт камералы мембраналы электризерде анод ретінде - графит, ал катод ретінде - мыс қолданылады. Әр камералар катион алмастырғыш мембраналармен (МК-40) бөлінген . Анодтық камераға тұз қышқылы ерітіндісі белгілі жылдамдықпен жоғарыдан тамшы түрінде келіп отырады, ал қалған камераларға ерітінділер присталдық насос көмегімен жіберіледі. Анодтық камераға тұз қышқылы 10- г/дм 3 , ал ортаңғы камераларға рн = 2 - тең күкірт қышқылы және катодтық камераға жұмысшы ерітінді құйылады. ТЕС-14 немесе ВСА-5 арқылы электризерге тұрақты электр тоғы беріледі. Кернеуді және тоқ күшін вольтамперметр М-253 арқылы бақылап отырады . Жұмыстың бастапқы кезінде катодты тазалап, таразыда салмағын есептеп алады. Жұмыс аяқталғаннан кейін қайта таразыда өлшейді. Яғни бұл жұмыс барысында ерітіндідегі металдың қаншасы катодқа отырғанын анықтайды. Сонымен қатар жұмысқа кеткен тоқ шығынын есептейді. Қаптамаларды кептіріп, микроскоп арқылы анализ жасаймыз. Жұмыс нәтижесінде алынған қаптамаға рентгенографиялық әдіспен және химиялық әдіспен құрамына анализ жасалады. . Алынған рений-никель қаптамаларын электрохимиялық ерітіндіде ерітеміз. Ал кейбір кездері алынған қаптамаларды муфельдік пеште 400-450 0 С температурада күйдіреді. Қаптаманың бет қабатындағы құрылысын электронды-микроскоп “SUPERPROВ-733” микроанализатор арқылы қағаз бетіне көшіріп оған талдау жасалады[9, 10] . 3, 4 суретте микроанализатор арқылы алынған қаптамалар келтірілген.
Тәжірибелік жұмыстар
1) 4, 6 г/л - NH 4 ReO 4
2, 0 г/л -NiSO 4
4, 0 г/л - (NH 4 ) 2 SO 4
0, 2 г/л - H 2 SO 4
Жұмыс жүру жағдайлары:
i к -400А/м 2
j=0, 408А
S
к
=10, 2
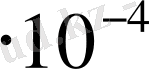 м
2
м
2
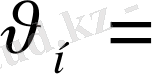 4мл/мин
4мл/мин
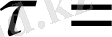 4сағ
4сағ
t =50 0
Мыс электрод массасы: m = 9. 4929г
Мыс электродтағы тұнба массасы: m = 10, 2502-9, 4929=0, 7576г
m = 0, 7576г
Тоқ бойынша есептеу
Жалпы Re-ге кеткен тоқ күші -26, 8 А∙сағ
Re) 26, 8 А∙сағ - 26, 6
0, 408∙4 А - х
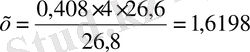
1, 6198 - 100%
0, 7576 - х
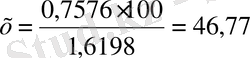 %
%
Ni) 26, 8 А∙сағ - 29, 35
0, 408∙4А - х
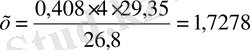
1, 7278 - 100%
0, 7576 - х
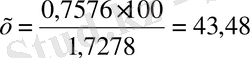 %
%
2) 20 г/л - NiSO 4
40 г/л - (NH 4 ) 2 SO 4
0, 5 мл - H 2 SO 4
1 мл - С 3 H 8 O 3
4, 6 г/л - NH 4 ReO 4
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz