Термодинамика: молекула-кинетикалық теория, заңдар және материалдардың жылулық қасиеттерін тәжірибелік зерттеу


Мазмұны
Белгілеулер мен қысқартулар
1 моль= 12 көміртек атомына тең бөлшектер саны.
1 кПа=
1 МПа=
1 =+273. 15
=3, 14
1 л=1
1см=
ПӘК = пайдалы әсер коэффициенті
1см =
1мл = л
1г = кг
1мг = г
1кДж = Дж
1мм = м
Кіріспе
Тақырыптың өзектілі: Адамдар ертеден суық пен ыстықтың ара-жігін айырып, температураны дененің жылыну дәрежесін сипаттайды деп есептеген. Жылу жайлы ғылымның дамуы температураны өлшеуге арналған құрал-термометр пайда болуымен басталады. Ең алғашқы термометрді 16 ғасырдың соңында Галилей жасады деп есептелінеді. Термодинамика механикалық жұмыс жасауға дененің ішкі энергиясын пайдаланудың негізгі тәсілдерін зерттейтін эмперикалық ғылым ретінде пайда болды.
Денелердің әртүрлі қасиеттері мен зат күйінің өзгерістері термодинамикада зерттелінеді. Термодинамика денелер мен табиғат құрылғысының тек макраскопиялық қасиеттерін зерттейді. Сонымен қатар физика ғылымындағы жылулық жұмыс және басқа энергия түрлерімен арадағы қарым-қатынасын зерттейтін тармағы. Тәжірибеден жинақталған нәтижелерге сүйенетін феноменологиялық ғылым. Ол көптеген құрамдас бөліктерден тұратын макраскопиялық жүйелер-термодинамикалық жүйелерді зерттейді. Мұндай жүйелерде жүретін процестер макраскопиялық шамалар, мысалға қысым және температура арқылы сипатталады, олар молекулалық деңгейге қолдануға келмейді.
Термодинамиканың негізгі ұғымдары: термодинамикадағы негізгі заңдар, газдардың молекула кинетикалық теориясы және фазалық өзгерістері мен термодинамиканың нақты газдарын толығырақ айтып түсіндіру.
Термодинамика лабораториясының құрамына кіретін құрылғылармен материалдардың жылулық қасиеттерін тәжіриебе жүзінде зерттеу жұмыстарын жүргізу. Металдар мен берілген жылуды сумен салысырып жылдың нақты мәндерін есептеу. Жылу тасымалдаушы мен температураның өзгеруі арасындағы қатынас туралы түбегейлі түсінік қалыптастырып, температура мен жылу арасындағы қатынастар мен судың балануының жасырын қызуын ақықтау.
Температураның қасиеттерін жан-жақты сипаттайтын зерттеу жұмыстары жүргізу. .
Жұмыстың мақсаты: Термодинамиканың әдістерін меңгеру.
Жұмыстың жаңалығы: Термодинамиканың лабораториядағы қондырғылар алғашқы рет жүйелі түрде қарастырылады.
Тәжірибелік құндылы: Термодинамика лабораториясында өткізілетін оқу процесінде қолданылады.
Дипломдық жұмыстың құрылымы : Дипломдық жұмыс кіріспеден, үш бөлімнен, қорытындыдан, пайдаланылған әдебиеттер тізімінен және қосымшадан тұрады. 35 сурет, 9 кесте бар. Әдебиеттер тізімі 27 және жұмыстың жалпы көлемі 64 бетті құрайды.
1 Термодинамиканың негізгі ұғымдары
1. 1 Идеал газдардың молекула-кинетикалық теориясы
Бізді қоршаған ортадағы денелер негізінен тоқсаннан астам біртекті атомдардан тұрады. Біртекті атомдардан құралған заттарды химиялық элементтер деп атайды. Оларға сутегі, көміртегі, күміс т. б. жатады. Атомдар бір-біріне тартылады. Осы тартылыстың нəтижесінде атомдар бірігіп, тұрақты күйге енеді. Яғни молекула түзеді. Ал бірдей молекулалардан құралған заттарды қосылыс деп атайды. Мұндай қосылыстарға, мысалы, су ( О), ас тұзы (NaCl) т. б. жатады. Заттың кішкене бір бөлігін бөлшек деп атайды. Біздің күнделікті көріп жүрген затымыз макроскопиялық деп есептеледі. Басқаша айтқанда, өте көптеген бөлшектерден тұрады.
Макроскопиялық заттар бір-біріне қарағанда реттелген түрде қозғалуы мүмкін. Оны механикада динамикалық қозғалыс деген атпен қарастырады. Бұл қозғалыстың басты ерекшелігі ретсіздігінде болып отыр. Осындай қозғалыс заңдылығын статистикалық деп атайды. Денелер өте көптеген макроскопиялық бөлшектерден құралғанда статистикалық заңдылық күшіне енеді .
Макроскопиялық денелерді құрайтын бөлшектердің ретсіз қозғалысын жылулық қозғалысы деп атайды. Жылулық қозғалысы арқылы əрбір макроскопиялық дененің ішкі күйі анықталады. Макроскопиялық денені құрайтын бөлшектер ретсіз қозғалыста болатындықтан, олар бірімен-бірі соқтығысып отырады.
Макроскопиялық дененің тепе-теңдік күйде болуы оның кез келген бөлігінде температура бірдей екендігін білдіреді. Ал макроскопиялық дененің əр бөлігіндегі температура түрліше болса, онда энергия оның бір бөлігінен екінші бөлігіне беріледі. Демек температура - макроскопиялық дене бөлшегінің жылулық қозғалысының интенсивтілігін көрсететін шама. Дененің температурасын өлшеу үшін термометрлер пайдаланылады. .
Макроскопиялық дененің күйін анықтайтын келесі параметр - қысым. Газ немесе сұйық молекулалары тəртіпсіз қозғалған кезде олар тек бірімен-бірі соқтығысып қана қоймай, сонымен қатар, ыдыс қабырғасымен де соқтығысады. Макроскопиялық бөлшектердің ыдыс қабырғаларына соққылау күшінің орташа мəні қысым деп аталады.
Сонымен, макроскопиялық денені қысым р, көлем V жəне температура T сипаттайды. Осы үшеуінің арасындағы байланысты анықтайтын мына формуланы макроскопиялық дене күйінің теңдеуі деп атайды.
Газ тəрізді заттарда молекулалар мен атомдар бір-бірінен қашығырақ орналасады. Өзара əсерлесу күші тек молекулалардың соқтығысуы кезінде пайда болады. Демек молекулалық күштердің əрекеті тек соқтығысқан молекулалардың энергия алмасуы кезінде ғана байқалады. Сонымен, ыдыстағы газ молекулаларының саны аз болса (тығыздығы аз), олардың бірімен-бірі соқтығысу мүмкіндігі азаяды. Осындай газды идеал газ дейді. Идеал газ деп молекулалар арасында өзара əсерлесу күштері болмайтын, жеке молекулалар көлемі ыдыс көлемімен салыстырғанда өте аз, тіпті оны еске алмауға да болатын жəне молекулалар арасындағы өзара соқтығысу абсолют серпімді болатын газдарды айтады .
Бойль-Маритт заңы. Газ күйіндегі заттардың меншікті көлемі болмайды. Сондықтан газдар ыдысқа толтырылғанда, сол ыдыстың көлемін толық алып тұрады және қабырғаларына белгілі бір қысым күшін түсіреді. ХVII ғасыдың ортасында ағылшын ғалымы Р. Бойль (1627-1691) және француз физигі З. Мариттың (1620-1684) бір-біріне тәуелсіз жасаған тәжірибе қорытындылары температура тұрақты болғанда газ көлемінің оның қысымына тәуелді өзгеретінін тұжырымдады:
Бұл тəуелділікті изотерма деп аталатын гипербола қисығымен көрсетуге болады (1. 1 сурет) . Газ күйінің бір күйден екінші күйге тұрақты температурада өтуі изотермалық процесс деп аталады .
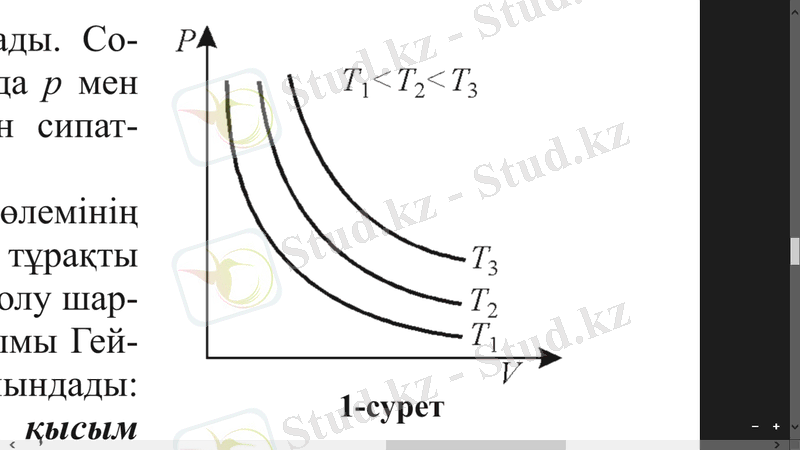
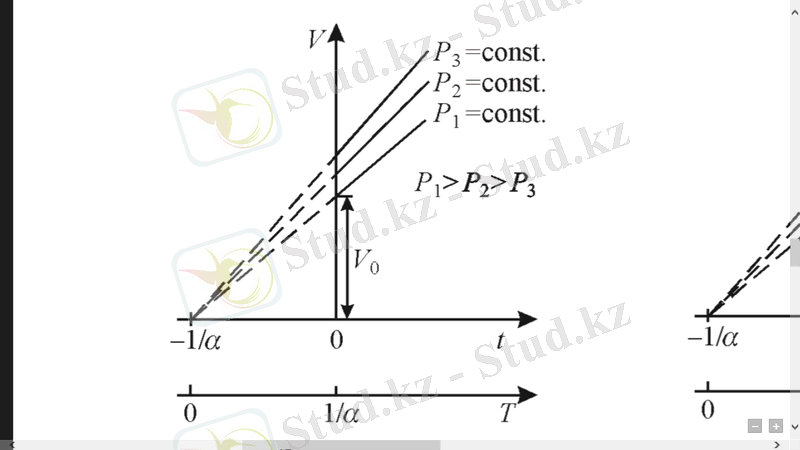
Гей-Люссак заңы. Газ көлемінің оның температурасына тұрақты қысымда тәуелді болу шартын бірінші рет француз ғалымы Гей-Люссак (1778-1850) тағайындады. Берілген газ массасы үшін қысым тұрақты болғанда, газ көлемі оның температурасына сызықты тәуелді өзгереді ( ) :
мұндағы: -газдың - тағы көлемі, - газдың көлемдік ұлғаюының термиялық коэффициенті. Тұрақты қысымда газ көлемі мен температураның тәуелділігі графикте түзу сызықпен көрсетіледі. Қысымның әрбір мәніне сәйкес келетін түзу сызық изобара деп аталады (1. 2 сурет) .
Шарль заңы. Тұрақты көлемде газ температурасының қысымға тəуелді болатыны да анықталады, яғни берілген газдың массасы үшін көлемі тұрақты болғанда, газ қысымы оның температурасына сызықты тəуелділікте өзгереді .
мұндағы: -газдардың 0 - тағы қысымы термиялық коэффициенті. Көлем тұрақты болғанда, - газ қысымының мен t тәуелділігі түзу сызықты және ол изохора деп аталады (1. 3 сурет) . Газ күйінің мұндай өзгеруін изохоралық процесс деп атайды. Зерттеудің нәтижелері газдардың термиялық коэффициенттері және бір-біріне шамалас екенін көрсетеді, яғни:
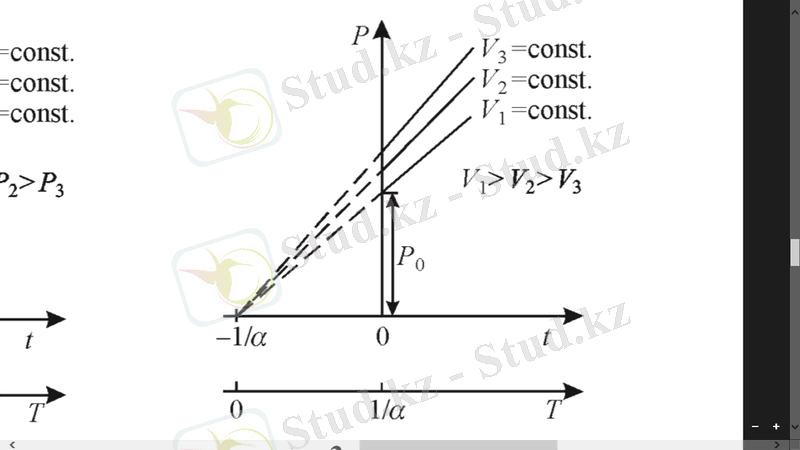
Изобара жəне изохора түзулері абсцисса осінде шамасы нүктесінде қиылысады. Температураның бастапқы санақ нүктесін осы нүктеге ауыстырып, температураның Цельсий шкаласынан абсолют Кельвин шкаласы деп аталатын басқа температуралық шкалаға өтуге болады .
Абсолют температура T мен Цельсий бойынша анықталған t температураның қатынасы мынадай болады
Мысалы, 0 -қа +273, 15К сәйкес келеді. 0К-ге тең температура абсолют нөл деп аталады, оған -273, 15°С мəні сəйкес келеді. Енді (1. 4) жəне (1. 5) теңдеулерге абсолют температураның мəнін қойып, оны басқа түрде жазуға болады:
бұдан V/ = T/ . Егер мен тұрақты шама екенін ескерсек, онда изобаралық процесс үшін:
Осындай əдіспен изохоралық процесс үшін де мынадай теңдікті жазуға болады, яғни:
Авогадро тағайындаған заң бойынша бірдей жағдайларда, яғни бірдей температура мен қысымда барлық газдардың мольдерінің көлемі бірдей болады. Əртүрлі заттардың бір мольдегі молекулалар саны бірдей болады: бұл Авогадро саны деп аталады .
Ағылшын физигі жəне химигі Дж. Дальтон (1766-1844) тағайындаған заң бойынша идеал газдар қоспасының жалпы қысымы сол қоспаны құрайтын газдардың парциал қысымдарының қосындысына тең болады, яғни:
мұндағы: - парциал қысымдар.
Клапейрон-Менделеев теңдеуі. Массасы газдың алғашқы күйін сипаттайтын параметрлердің мəндері болсын. Егер газдың күйі өзгерсе, онда оның соңғы күйін сипаттайтын параметрлер болады. Бойль-Мариотт жəне Гей-Люссак заңдары негізінде осы газдың екі күйінің арасындағы байланысты анықтауға болады. Ол үшін газдың бірінші күйдегі қысымын тұрақты деп оны, дейін қыздырамыз. Сонда оның көлемі - ден -ке дейін өзгереді. Бұл процесс изобаралық болғандықтан, Гей-Люссак заңы бойынша көлемнің өзгеруі: . Енді газ күйінің соңғы өзгерісін тұрақты температурада , көлемін өзгертіп байқауға болады: яғни газ қысымы -ден -ге дейін өзгерсе, онда көлемі -тен - ге дейін ұлғаяды. Бұл өзгеріс изотермалық болғандықтан, Бойль-Мариотт заңы негізінде:
Сонымен, берілген газ массасы үшін, газ күйінің өзгерісін көрсететін шама әр уақытта тұрақты болады, яғни:
Бұл теңдікті бірінші рет француз ғалымы және инженер Б. Клапейрон (1799-1864) Бойль-Мариотт және Гей-люссак заңдарын біріктіріп қорытып шығарғандықтан, ол идеал газ күйін сипаттайтын Клапейрон теңдеуі деп аталады . Сондықтан газдың сандық мəні бір мольге тең болса, (1. 9) теңдіктегі тұрақты шама барлық газдар үшін бірдей болады. Барлық газ үшін тұрақты шаманы R əрпімен белгілеп, оны универсал газ тұрақтысы деп атайды. Сонда (1. 9) теңдік мына түрде жазылады:
Енді (1. 9а) теңдеуден универсал газ тұрақтысының сандық мәнін анықтап шығарайық. Егер К, кПА, , болса, онда:
1 мольде ғана дұрыс болатын формуланы кез келген мөлшердегі массаға қолданатындай өзгертіп жазуға болады. Ол үшін газдың молярлық массасын әріпімен белгілейміз. Олай болса, тұрақты қысым мен температурада :
Бұл теңдік массасы кез келген газ үшін қорытылып шығарылған Клапейрон менделеев теңдеуі болып табылады.
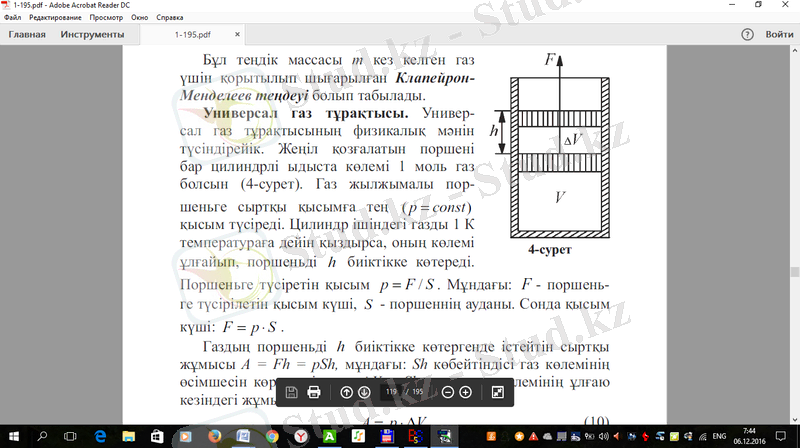
1. 4 сурет
Газдың поршеньді биіктікке көтергенде істейтін сыртқы жұмысы , мұндағы: көбейтіндісі газ көлемінің өсімшесін көрсетеді, яғни , сонда газ көлемінің ұлғаю кезіндегі жұмыс:
Егер газдың алғашқы күйін сипаттайтын теңдеу
болса, 1 K қыздырғаннан кейінгі көлемі -ге өзгеріп, (1. 11) теңдеуі басқа түрде көрсетіледі, яғни:
Соңғы (1. 11) және (1. 12) теңдеулерден мына теңдік шығады:
Егер де (1. 10) және (1. 13) теңдеулерді салыстырсақ, онда универсал газ тұрақтысы істелген жұмысқа тең болады:
Сонымен, универсал газ тұрақтысы 1 моль газды 1 К температураға қыздыру үшін кеткен изобаралық жұмысқа тең екен .
1. 2 Термодинамика заңдары.
Больцманның таралу заңы. Молекулалар санының биіктік бойынша өзгеруін, барометрлік формула арқылы анықтауға болады.
Егер , бұдан (1. 15) теңдеуін мына түрде жазуға болады:
екенін ескеріп, соңғы теңдеуді былайша жазамыз:
Осы формуланың mg( ) көрсеткішін газ бөлшектерінің - ден биіктікке көтерілген кездегі потенциалдық энергиясының өзгерісі деп есептейік: mg( ) = . Бұдан (1. 17) теңдік мынадай түрге келеді : немесе қатынасын енгізіп, мына түрге келтіреміз:
мұндағы: - молекулалардың салыстырмалы саны. (1. 18) формула Больцманның таралу заңы деп аталады. Бұл өрнек сыртқы күштердің потенциалдық өрісіндегі бөлшектердің таралуын сипаттайды жəне бұл теңдеуден температура төмендегенде, нөлге тең емес биіктікте бөлшектер саны азайып, ал жағдайында болатыны байқалады. Сөйтіп, абсолют нөлде барлық бөлшектер Жер бетінде орналасқан болар еді. Жоғары температурада, керісінше, биіктікке көтерілген сайын баяу кемиді, яғни молекулалар биіктікке көтерілген сайын біркелкі таралады. Мұның физикалық мəні мынадай: біріншіден, молекулалардың жерге таралуы нəтижесінде олар жер бетінде орналасуға ұмтылады, екіншіден, молекулалардың жылулық қозғалысы оларды барлық биіктік бойынша біркелкі таратуға тырысады. Молекулалар массасы m үлкен болса, аз болған сайын молекулалар жер бетіне таяу қоюлана түседі. Егер болса, шектік жағдайда жылулық қозғалыс толық тоқтап, молекулалар тартылыстың əсерінен жер бетінде орналасады. . Больцманның таралу заңының Максвелдің жылдамдықтар бойынша таралуының экспоненциалдық мүшесімен ұқсас екенін байқаймыз:
1. , себебі
2. себебі
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz