Аналитикалық химия: сапалық талдау әдістері, катиондарды топтау және теориялық негіздері


Оңтүстік Қазақстан педагогикалық университеті

«Химия және биология»кафедрасы
Аналитикалық химия
Дәрістік кешендер
5В011200-Химия мамандығының күндізгі және сырттай оқу бөлімінің студенттеріне арналған
(4 кредит)
Құрастырған: Джалилов К. А.
Шымкент - 2018
ЛЕКЦИЯ № 1-2.
Тақырыбы: Сапалық анализ пәні және әдістері
Аналитикалық химия - заттың сапасын және сандық мөлшерін анықтайтын химияның бір саласы. Химиялық талдау әдістері қойылатын мақсаттарына байланысты сапалық және сандық болып екі тарауға бөлінеді.
Сапалық талдаудың негізгі мақса ты зерттелетін заттың сапалық құрамын анықтау, демек қандай бөлшектерден (атом, ион, молекуладан) тұрандығын табу.
Сандық талдау әдісінің мақсаты зерттелетін заттың құрамындағы құрамдастардың (компоненттердің) массалық үлесін немесе грамм мөлшерін анықтау.
Химиялық талдау белгілі бір тәртіппен жүреді, яғни алдымен заттардың сапалық құрамы, содан соң сол заттардың сандық мөлшері анықталады. Заттарға химиялық талдау жасауда хиимиялық, физикалық, физика -химиялық және биологиялық әдістер қолданылады.
Физикалық әдістерде химиялық реакция жүзеге аспайды. Бұл әдістерде талданатын заттың физикалық параметрлері өлшенеді, мысалы балқу, қайнау температурасы, поляризация, электромагниттік қасиеттері, жарық сынуы, жарық жұтуы, электр және жылу өткізгіштігі.
Химиялық әдістерде химиялық әрекеттесулерді пайдаланады, олардың нәтижесінде сыртқы әсер жүзеге асады, мысалы - тұнбаға түсу, түсті ерітінділердің пайда болуы немесе газ тәріздес ұшқыш өнімдердің бөлінуі.
Физика-химиялық әдістер заттың қандай да болмасын химиялық әрекеттесу кезіндегі физикалық қасиетін (параметрін) өлшеуге негізделген. Оларға спектроскопия, электрохимия және басқа әдістерді жатқызуға болады. Физикалық және физика-химиялық әдістердің химиялықтан айырмашылығы олар аспап және құралдармен орындалады, себебі олар қандай да бір болмасын концентрацияға байланысты тіркеуді аналитикалық құралдар мен қондырғылардың көмегімен іске асырады, олар бұл тіркеуді, яғни талданатын заттың физикалық параметрлерін өлшейді.
Химиялық реакциялардың орындалу тәсілдеріне байланысты талдаудың мына түрлерін ажыратады:
1. «құрғақ» түрде талдау
2 ерітінді түрде талдау.
Құрғақ турдегі талдауды қатты заттармен жүргізеді. Бұл тәсілдің бірнеше түрі бар; біріншісі - пирохимиялық. Бұл әдісте затты от жалынында қыздырады, яғни жалынның түстерге боялуы жатады. Мысалы, натрий тұздары жалынды сары түске, барий тұздары - жасыл түске, калий тұздары - күлгін түске бояйды. Екінші бір түрі - ұнтақтау әдісі. Бұл әдісті 1898 ж. Ф. М. Фловинский ұсынған. Зерттелетін затты және реагентті келіге салып ұнтақтайды. Реакция нәтижесінде түсті қосылыс түзіледі, оның түсіне қарай қорытынды жасайды.
Ерітінді түріндегі талдауды ерітінділерде жүргізеді: бұл әдісте зерттелетін зат та, реагент те ерітінділер түрінде пайдаланылады.
Сынама шамасына қарай әдістердің жіктелуі
Пикограммды
әдіс
Химиялық талдауда жасалынатын заттың немесе қосылыстың ерекше көзге түсетін химиялық немесе физикалық қасиеттері болуы тиіс, оны аналитикалық қасиеттер деп атайды. Бұл аналитикалық қасиеттер оның сапасын және сандық үлесін анықтауға мүмкіндік береді, ал осы қасиеттерін көрсететін реакциялар - аналитикалық реакциялар деп аталады. Кез-келген ионның аналитикалық қасиетін көрсететін химиялық реактивті реагент деп атайды. Реагенттің әсерінен аналитикалық өзгеріс түріндегі хабар, белгі -сигнал пайда болуы мүмкін. Аналитикалық сигнал деп тұнба немесе түсті қосылыстардың түзілуін, газдың бөлінуін айтамыз. Аналитикалық сигнал қосылыстардың сапалық және сандық құрамы туралы мәлімет береді. Аналитикалық сигналды көзбен қоріп және түрлі құралдармен байқауға болады.
Аналитикалық сигналдарды көзбен көріп және түрлі құралдармен байқауға болады.
Аналитикалық реакцияларды ортақ және жеке деп айырады. Бір реагент бірнеше иондармен әрекеттесетін реакцияларды ортақ реакция деп атайды. Мысалы, HCl ерітіндісі Ag + , Hg 2 2+ , Pb 2+ катиондарымен әрекеттесіп, хлоридтер түзеді. Ортақ реакциялар зерттелетін ерітіндіде бір топ катиондардың болуын болжауға мүмкіндік береді.
Реагенттердің ионның бір түрімен ерекше қосылыстар түзу реакцияларын жеке реакция деп атайды.
Ортаның нақты жағдайында (рН, т. б. ) орындалатын ортақ реакцияларды топтық реакциялар, ал қолданылатын реагентті топтық реагент деп атайды. Мысалы, H 2 SO 4 ерітіндісі Ba 2+ , Ca 2+ , Sr 2+ иондарын этил спирті қатысында тұнбаға түсіреді, яғни H 2 SO 4 осы топ катиондарының топтық реагенті болып бір топ иондарын тұнбаға түсіру үшін пайдаланады.
Сапалық талдауда қолданылатын химиялық реакциялар, келесі талаптраға сай болуы қажет:
- тез немесе жылдам өтуі;
- реакцияның қайтымсыз болуы;
- сыртқы эффект байқалуы қажет: түсінің өзгеруі, тұнбаның түзілуі, газдың бөлініп шығуы;
- арнайылығымен және жоғары сезгіштігімен ерекшеленеді.
ЛЕКЦИЯ № 3-4.
Тақырыбы: Катиондардың классификациялау.
Катиондарды қышқылды-негіздік әдіспен топтау және талдау
Қышқылды-негіздік әдіс бойынша катиондарды топтауда ортақ реагенттер ретінде қышқылдар және негіздер ерітінділері пайдаланылады. Аталған әдіс бойынша катиондарды алты аналитикалық топқа бөледі.
Катиондарды қышқылды-негіздік әдіс бойынша топтау
Бірінші топ катиондарының топтық реагенті жоқ. Топқа Талдау кезінде бөлшектік әдісті пайдаланады.
Екінші аналитикалық Ag + , Hg 2 2+ , Pb 2+ катиондары жатады, топ реагенті 2 н HCl ерітіндісі. Топ реагентінің әсерінен ақ түсті, қышқылдарда ерімейтін AgCl, Hg 2 Cl 2 , PbCl 2 тұнбаларын түзеді.
Үшінші аналитикалық топты Ca 2+ , Sr 2+ , Ba 2+ құрайды. Оларды бөлу үшін сұйылтылған H 2 SO 4 ерітіндісі пайдаланылады. Топтық реагенттің әсерінен ақ кристалдық CaSO 4 , SrSO 4 , BaSO 4 тұнбалары түзіледі. Арасындағы өте нашар еритіні BaSO 4 , ал CaSO 4 пен SrSO 4 ерігіштігі жоғары, сондықтан оларды спирт қатысында тұндырады.
Төртінші аналитикалық топты Zn 2+ , Al 3+ , Cr 3+ , Sn 2+ , Sn 4+ , As 3+ , As +5 катиондары құрайды. Бұл топ катиондары амфотерлі қасиет көрсетеді, сондықтан NaOH-тың артық мөлшерінде еритін гидроксидтер түзеді: Zn(ОН) 2 , Al(ОН) 3 , Sn(ОН) 2 , Н 2 [Sn(OH) 6 ], Sn(OH) 4 .
Бесінші аналитикалық топты Mg 2+ , Mn 2+ , Fe 2+ , Fe 3+ , Bi 3+ , Sb 3+ , Sb 5+ катиондары құрайды. Топ реагенті NaOH ерітіндісі, ол бесіншітоп катиондарымен әрекеттескенде суда нашар еритін гидроксидтер түзеді: Mg(ОН) 2 , Mn(ОН) 2 , Fe(ОН) 2 , Fe(ОН) 3 , Bi(ОН) 3 , Sb(ОН) 3 , SbО(ОН) 3 .
Алтыншы аналитикалық топты Co 2+ , Ni 2+ , Cu 2+ , Cd 2+ , Hg 2+ катиондары құрайды. Топтық реагенті аммиак ерітіндісінің артық мөлшері. Ол кезде комплексті тұздар түзіледі: [Co(NH 3 ) 6 ] 2+ , [Ni(NH 3 ) 6 ] 2+ , [Cu(NH 3 ) 4 ] 2+ , [Cd(NH 3 ) 4 ] 2+ , [Hg(NH 3 ) 4 ] 2+ .
Катиондарды сульфидтік әдіспен топтау және талдау
(NH 4 ) 2 CO 3
(NH 3 +NH 4 Cl)
pH=9, 25
(NH 4 ) 2 S
(NH 3 +NH 4 Cl)
pH=9, 25
Na 2 S немесе (NH 4 ) 2 S
(NH 3 +NH 4 Cl)
pH=9, 25
Бірінші аналитикалық топты Na + , K + , NH 4 + , Li + катиондары құрайды, бұл топ катиондарының топтық реагенті жоқ. Оларды ерітіндіден бөлшектеп анықтайды.
Екінші аналитикалық топқа Ca 2+ , Sr 2+ , Ba 2+ , Mg 2+ катиондары жатады. Топтық реагенті (NH 4 ) 2 CO 3 ерітіндісі, аммоний карбонаты гидролизденеді, сондықтан оның гидролизін баяулату үшін ерітіндіге NH 4 OH қосады. Топтық реагенттің әсерінен ақ түсті карбонаттар тұнбаға түседі (CaСO 3 , SrСO 3 , BaСO 3 , MgСO 3 ) .
Үшінші аналитикалық топты Fe 2+ , Fe 3+ , Zn 2+ , Co 2+ , Mn 2+ , Ni 2+ Al 3+ , Cr 3+ катиондары құрайды. Топтық реагенті - аммоний сульфиді. Топтық реагентінің әсерінен қара түсті сульфидтер түзіледі: Fe 2 S 3 , FeS, ZnS, MnS сұйылтылған HCl, H 2 SO 4 ерітінділерінде ериді.
Төртінші аналитикалық топқа Cu 2+ , Cd 2+ , Hg 2+ , Bi 3+ , Sn 2+ , Sn 4+ , Sb 3+ , Sb 5+ катиондары жатады, топтық реагент Н 2 S тұз қышқылы ерітіндісі қатысында (HCl, pH<0, 5) . Бұл топ катиондары екі топқа бөлінеді: мыс топшасы (Cu 2+ , Cd 2+ , Hg 2+ , Bi 3+ ) және мышьяк топшас ы As 3+ , As +5 , Sn 2+ , Sn 4+ , Sb 3+ , Sb 5+ .
Cu 2+ , Hg 2+ , Bi 3+ катиондары қара түсті тұнбалар түзеді (CuS, HgS, Bi 2 S 3 ), Cd 2+ катиондары ашық сары тұнба түзеді (CdS ) . Олар сұйылтылған қышқылдарда ерімейді (H 2 SO 4 , HCl), ал бірақ тотықтырғыш қышқылдарда ериді, мысалы сұйылтылған НNO 3 ерітіндісінде.
Бесінші аналитикалық топқа Ag + , Hg 2 2+ , Pb 2+ катиондары жатады, топтық реагенті сұйылтылған тұз қышқылы ерітіндісі Ag + , Hg 2 2+ , Pb 2+ катиондарымен суда нашар еритін ақ түсті тұнба түзеді.
Катиондарды аммиакты-фосфатты әдіспен топтау және талдау
Катиондарды аммиакты-фосфатты әдіспен талдау барысында иондар бес топқа бөлінеді.
Бірінші аналитикалық топқа Na + , K + , NH 4 + катиондары жатады, бұл топ катиондарының топтық реагенті жоқ.
Екінші аналитикалық топты As 3+ , As + 5, Sn 2+ , Sn 4+ , Sb 3+ , Sb 5+ катиондары құрайды. НNO 3 ерітіндісін қосып, қыздырғанда суда нашар еритін тұнбалар түзеді.
Үшінші аналитикалық топты Ca 2+ , Sr 2+ , Ba 2+ , Mg 2+ Mn 2+ , Al 3+ , Cr 3+ , Fe 2+ , Fe 3+ , Bi 3+ катиондары құрайды, топтық реагенті (NH 4 ) 2 НРО 4 аммиак қатысында. Топтық реагентпен түрлі -түсті фосфаттар түзеді.
Төртінші аналитикалық топты Zn 2+ , Cu 2+ , Cd 2+ , Hg 2+ , Co 2+ , Ni 2+ құрайды, топтық реагенті (NH 4 ) 2 НРО 4- - ның концентрлі ерітіндісі. Бұл топ катиондарының фосфаттары концентрлі аммиак ерітіндісінде комплексті тұздар түзе ериді: [Co(NH 3 ) 6 ] 2+ , [Ni(NH 3 ) 6 ] 2+ , [Cu(NH 3 ) 4 ] 2+ , [Cd(NH 3 ) 4 ] 2+ , [Hg(NH 3 ) 4 ] 2+ , [Zn(NH 3 ) 4 ] 2+ . Бұл топ катиондарының фосфаттары сірке қышқылында да ериді.
Бесінші аналитикалық топқа Ag + , Hg 2 2+ , Pb 2+ катиондары жатады, топтық реагенті тұз қышқылы ерітіндісі, тұнбаға хлоридтер түседі.
ЛЕКЦИЯ № 5-6.
Тақырыбы: Әрекеттесуші массалар заңы. Сапалық анализдің теориялық негізі.
Химиялық реакцияның тепе-теңдік константасы әрекеттесуші заттардың концентрациясына тәуелділігін бірінші байқаған орыс ғалымы А. Н. Бекетов болды. Кейіннен бұл заңдылықты Норвегия ғалымдары Гульдберг және Вааге тұжырымдаған. Егер әрекеттесуші заттарды А және В деп, ал реакция өнімін С және Д деп белгілесек, онда А және В арасындағы қайтымды реакция мынадай түрде болады.
А+В = С+ D
Химиялық реакцияның жылдамдығы реакцияласушы заттардың концентрациясының көбейтіндісіне тура пропорционал:
V 1 = k 1 [A] [B]
Мұндағы k 1 -пропорционалдық коэффициенті (жылдамдық константасы), ол әрекеттесуші заттардың табиғатына, температураға тәуелді; [A], [B] - әрекеттесуші заттардың концентрациясы, моль/л.
Реакцияның бірінші кезеңінде бастапқы заттардың (А және В заттарының) концентрациясы басым келеді, сондықтан тура реакцияның жылдамдығы жоғары болады. Жүйеде реакция өнімі С және D болып, олардың концентрациялары өскен сайын, кері реакцияның жылдамдығы артады:
V 2 = k 2 [С] [D]
Мұндағы k 2 - кері реакцияның пропорционалдық коэффициенті (жылдамдық константасы) .
Бір уақыт кезеңінде тура және кері реакциялардың жылдамдықтары бір біріне тең болады:
V 1 = V 2
яғни жүйеде тепе-теңдік орнайды, сонда
k 1 [A] [B] = k 2 [С] [D]
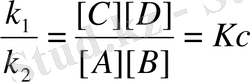
k 1 , k 2 - тұрақты шамалар, сондықтан К с турақты шама болады.
Қайтымды реакцияларда реакция нәтижесінде түзілген заттардың концентрациялар көбейтіндісінің реакцияға дейінгі алынған заттардың концентрацияларының көбейтіндісіне бөлгенде шығатын тұрақты шаманы тепе-теңдік константасы немесе концентрациялық константа деп атайды және К с әріпімен белгілейді. Константаның мәні температураға, әрекеттесуші заттардың табиғатына тәуелді, бірақ әрекеттесуші заттардың концентрациясына тәуелсіз. Егер К с > 1 болса, тура реакция жүреді, ал K c < 1 болғанда кері реакция басым болады. Мысалы, К с =10 3 , бұл тура реакцияның жылдамдығы кері реакцияның жылдамдығынан 1000 есе артық екендігін көрсетеді.
Егерде мынадай реакция жүретін болса:
aА+bВ = cС+ dD
Онда бұл жүйенің тепе-теңдік константасы мына теңдеумен анықталады:

c, d, a, b, - cтехиометриялық коэффициенттер.
Қышқылдар мен негіздердің протолиттік ілімі
Қышқылдар мен негіздердің «классикалық» теориясын С. Аррениус өткен ғасырдың соңында ұсынған. Бұл ілім бойынша, қышқылдарға иондану нәтижесінде сутек иондарын бөле жүретін қосылыстар, негіздерге - гидроксил иондарын түзетін қосылыстар жатады. Мысалы:
Қышқыл HCl = H + + Cl -
негіз NaOH = Na + + OH -
Бірақ, бұл электролиттік диссоциация ілімі органикалық қосылыстардың, мысалы, аминдердің, амидтердің, т. б. қышқылдық-негіздік қасиеттерін түсіндіре алмады. 1923 ж. Бренстед және ағылшын химигі Лоури қышқылдар мен негіздердің протолиттік ілімін ұсынды. Протолиттік ілім бойынша, қышқылдар дегеніміз иондану нәтижесінде протондар түзетін, ал негіздер протонды қосып алатын қосылыстар. Протолиттік теория ілеспелі қышқылдар мен негіздер деген ұғымды енгізді. Мысалы, HBr - қышқыл протонды (Н + ) бөліп шығарып - ілеспелі негіз түзеді, ал Br - - қышқылды ортада протонды қосып алып, оған ілескен қышқылды түзеді.
Көптеген қосылыстар протонды қосып та алады, бөліп те шығарады. Мысалы, НСО 3 - протонды бөліп шығарып, қышқыл рөлін атқарады; қышқыл ортада протонды қосып алып - негіздік қасиет көрсетеді.
НСО 3 - = Н + + СО 3 2- (қышқыл, сілітілік ортада)
СО 3 2- + 2Н + = Н 2 СО 3 (негіз, қышқылдық ортада)
Қышқылдық-негіздік әрекеттесілердің барлық реакцияларында, қышқылдан негізге протондар қайтымды тасымалданып тұрады, олар жаңа бөлшектер жұбын түзеді, олардың біреуі қайтадан протон беруге, екіншісі оны қабылдап алуға бейім.
қышқыл 1 = Н + + негіз 1
негіз 2 + H + = қышқыл 2
қышқыл 1 + негіз 2 += негіз 1 + қышқыл 2
Протолиттік ілім бойынша қышқылдар үш түрге бөлінеді:
1) бейтарап - НАn (HCl, HNO3) ;
2) катионды қышқылдар - BH + (NH 4 + , C 5 H 5 NH 2 + ) ;
3) анионды қышқылдар - HAn - (HSO 4 - , H 2 PO 4 - )
Бұл қышқылдардың барлық түрі протонды бөліп шығарады:
NH 4 + = NН 3 + H +
Протолиттік ілім бойынша негіздер де үш топқа бөлінеді:
1) бейтарап - В (NН 3 , С 6 H 5 N) ;
2) катионды - B + (AlOH 2+ , ZnOH + ) ;
3) анионды - An - (HSO 4 - , OH - ) .
Бұл қосылыстар протондарды қосып алады, мысалы:
NН 3 + H + = NH 4 +
ЛЕКЦИЯ № 7-8.
Тақырыбы: Әрекеттесуші массалар заңы. Сапалық анализдің теориялық негізі
Аналитикалық химияда көбінесе сұйық ерітінділер қолданылады. Ерітінділерді электролиттер деп те атайды. Электролит деп еріткіш молекулаларының әсерінен иондарға ыдырап, ерітінділері не балқымалары электр тогын өткізетін заттарды айтады. Электролит ерітінділерінде өтетін барлық ерекшеліктерді С. Аррениустің электролиттік диссоциация ілімі түсіндіреді. Оның мынадай қағидалары бар:
1. Қышқылдар, негіздер және тұздар молекулалары суда еріген кезде шартты түрде иондарға ыдырайды (диссоциацияланады)
2. Ол иондар химиялық және электрохимиялық реакцияларға дербес бөлшектер сияқты қатысады.
Электролиттердің иондану процесін сипаттау үшін электролиттік диссоциация дәрежесі (α) деген ұгым пайдаланылады.
Диссоциация дәрежесі - иондаған молекулалар санының жалпы еріген молекулалар санына қатынасымен сипатталады.
С i
α=
С ж
C i - иондарға ыдыраған молекулалардың концентрациясы, С ж - ерітіндідегі молекулалардың жалпы концентрациясы.
Мысалы, 0, 1 М сірке қышқылының диссоциация дәрежесі α=0, 0132 болса, онда 0, 0132 (немесе 1, 32 %) иондарға диссоциацияланған, ал 0, 9868 (немесе 98, 68 %) диссоциацияланбаған, яғни молекула күйінде екендігің білдіреді.
Барлық электролиттер диссоциациялану дәрежесіне байланысты шартты түрде үш топқа бөлінеді: күшті, әлсіз және күші орташа деп.
Температура 25 0 С және концентрациясы 0, 1 н ерітінділер үшін диссоциа-циялану дәрежесі α ≥ 0, 3 жоғары болса күшті , диссоциациялануы 0, 03 ≤ α < 0, 3 аралығында болса күші орташа , және α ≤ 0, 03 төмен болса әлсіз электролит деп атауға келісілген.
Күшті электролиттер ерітінділердегі иондар күйін сипаттау үшін олардың активті концентрациясы а (моль/л) деген ұғым енгізілді. Бұл шама ерітінділердегі иондардың бір-біріне әсерін есепке ала отырып, электр өткізгіштіктің, қату температурасының төмендеуі мен қайнау температу-расының жоғарылауының дәл мәндерін анықтауға мүмкіндік береді. Активті концентрация иондардың шартты концентрациясы, ол күшті электролиттің молярлы концентрациясымен келесі өрнек арқылы байланысады:
а = f . C м
мұндағы: f - активтілік коэффициентті, ерітіндідегі барлық иондардың валенттілігіне және концентрациясына тәуелді, сондай-ақ электр өрісінің интенсивтілігіне және ерітіндінің иондық күшіне байланысты:
I = 0, 5 ∑C
i
.
z
i
2
,
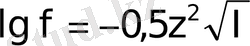 Equation. 3
Equation. 3
мұндағы С i - ионның концентрациясы, z i -ионның заряды.
Әлсіз электролиттер. Оствальдтың сұйылту заңы.
Ерітінділерде толық диссоциацияланбайтын және электр тоғын нашар өткізетін электролиттерді әлсіз электролиттер деп атайды. Мұндай электро-литтердің диссоциациялануы қайтымды процес болғандықтан, олардың ерітінділерінде диссоциацияланбаған молекулалар және иондар арасында тепе-теңдік орнайды. Бұл процесс әрекеттесуші массалар заңына бағынып, электролиттік диссоциациялануды сипаттайтын тепе-теңдік константасы болу керек.
Мысалға, бір әлсіз электролиттің диссоциациялануын қарастырайық:
СН 3 СООН ⇔ Н + + СН 3 СОО -
Тепе-теңдік константасы былай жазылады:
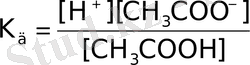
Бұл тепе-теңдік константасын диссоциациялану константасы деп атайды. Ол электролиттің иондарға диссоциацияланғыштық қабілетін көрсетеді.
Мысалы: К д (СН 3 СООН) = 1, 76 . 10 -5 - әлсіз
К д (НСN) = 4, 79 . 10 -10 - өте әлсіз
Диссоциациялану константасы мен диссоциациялану дәрежесінің арасында байланыс бар, оның бірі белгілі болса, екіншісін есептеп шығаруға болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz