Магний ұнтағы қоспалары негізіндегі жалынсыз қыздырғыштардың химиялық-технологиялық зерттеуі


Әл-Фapаби aтындaғы қaзaқ ұлттық унивepcитeтi
XИМИЯ ЖӘНЕ XИМИЯЛЫҚ ТEXНOЛOГИЯ ФAКУЛЬТEТI
Xимиялық физикa жәнe мaтepиaлтaну кaфeдpacы
«5В072000-бeйоpгaникaлық зaттapдың химиялық тeхнологияcы»
ДИПЛОМДЫҚ ЖҰМЫС
Магний ұнтағы қоспасы негізіндегі жалынсыз қыздырғыштарды зерттеу
- Әдеби шолу
Магний және оның қасиеттері
Магний III периодтың, II топтың негізгі топшасының элементі, атомдық нөмері 12, олай болса ядросында 12 протон бар, электрондарының жалпы саны да 12, салыстырмалы атомдық массасы 24, сондықтан ядросындағы нейтрондар саны да 12 болады ) .
Магнийдің 12 электроны үш электрондық қабаттарға бөлініп орналасқан: 1s 2 2s 2 2p 6 3s 2
Валенттілік электроны 3s 2 , олар кванттық ұяшықта жұптасып орналасқан; валенттігі II; тотығу дәрежесі 0, +2.
Магний табиғатта таралуы бойынша сегізінші орында тұр; табиғи минералдары магнезит MgCO
3
, доломит MgCO
3
 CaCO
3
, карналлит KCl
CaCO
3
, карналлит KCl
 MgCl
2
MgCl
2
 6H
2
O, асбест 3MgO
6H
2
O, асбест 3MgO
 2H
2
O
2H
2
O
 2SiO
2
. Оның минералдары Қостанай өңірінде (асбест) кездеседі.
2SiO
2
. Оның минералдары Қостанай өңірінде (асбест) кездеседі.
Магний ионы жасыл өсімдіктердің хлорофил дәндерінде, теніз суларында болады.
Магнийді хлоридінің балқындысын 750 0 C электролиздеп алады.
MgCl
2
 Mg + Cl
2
Mg + Cl
2
Магний күмістей ақ, жеңіл (
 г/см
3
), балқу температурасы 651
0
С, қайнау температурасы 1096
0
С, ауада оңай тотығып, жарқырап жанады, тығыз оксидтік қабатпен қапталатын металл.
г/см
3
), балқу температурасы 651
0
С, қайнау температурасы 1096
0
С, ауада оңай тотығып, жарқырап жанады, тығыз оксидтік қабатпен қапталатын металл.
Магний химиялық белсенді металл (
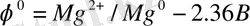 ), бетіндегі оксидтік қабыршақтан тазартылған магний оттегімен, хлормен, азотпен, фосформен, кремниймен әрекеттеседі.
), бетіндегі оксидтік қабыршақтан тазартылған магний оттегімен, хлормен, азотпен, фосформен, кремниймен әрекеттеседі.
а) жай заттармен әрекеттесуі:
2Mg + O 2 = 2MgO магний оксиді
Mg + S = MgS магний сульфиді
3Mg + N 2 = Mg 3 N 2 магний нитриді
3Mg + 2P = Mg 3 P 2 магний фосфиді
2Mg + Si = Mg 2 Si магний силициді
ә) күрделі заттармен әрекеттесуі:
2Mg + H
2
O = MgO + O
2
2Mg + SiO 2 = 2MgO + Si
2Mg + TiCl 4 = 2MgCl 2 + Ti
Осы реакция бойынша Өскеменнің титан-магний комбинатында титан өндіріледі. Химиялық, медициналық аспаптар; ұшақ, кеме, зымыран жасауда қолданылатын болатты асылдандыру үшін титан таптырмайды металл. Ол болатқа беріктік пен коррозияға тұрақтылық береді
3Mg + MoO 3 = 3MgO + Mo
3Mg + WO 3 = 3MgO + W
Магний көмірқышқыл газында да жанады:
Mg + CO
2
= MgO + CO
2Mg + CO 2 = 2MgO + C
Нағыз металл ретінде қышқылдармен әрекеттеседі:
Mg + 2HCl = MgCl
2
+ H
2
Осы реакциялардың барлығында магний-тотықсыздандырғыш. Органикалық синтезде магнийорганикалық қосылыстар кеңінен қолданылады, олар мына реакция бойынша алынады:
C
2
H
5
Cl + Mg
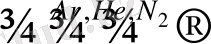 С
2
H
5
- Mg - Cl (Гриньяр реактиві)
С
2
H
5
- Mg - Cl (Гриньяр реактиві)
Оксиді MgO - күйдірілген магнезия, негіздік оксид, магний карбонатын термиялық айырып алады:
MgCO 3 MgO + CO 2
Магний оксидіне суда нашар еритін магний гидроксиді сәйкес келеді. Негіздік оксид болғандықтан қышқылдық оксидтермен, қышқылдармен реакцияға түседі.
MgO + CO 2 = MgCO 3
MgO + H 2 SO 4 = MgSO 4 + H 2 O
Гидроксиді Mg(OH) 2 - ақ түсті ұнтақ, суда нашар ериді, орташа күшті негіз.
Алынуы: MgSO 4 + 2NaOH = ↓Mg(OH) 2 + Na 2 SO 4
Магний гидроксиді қышқылда және аммоний хлоридінде ериді.
Mg(OH) 2 + H 2 SO 4 = MgSO 4 + 2H 2 O
Mg(OH) 2 + 2NH 4 Cl = MgCl 2 + 2NH 4 OH
Тұздары: MgCl 2 - магний хлориді, теңіз суынан алынады
MgSO
4
 7H
2
O - ащы тұз, «ағылшын» тұзы
7H
2
O - ащы тұз, «ағылшын» тұзы
MgCO
3
 CaCO
3
- доломит
CaCO
3
- доломит
Магнийдің фториді, сульфиті, сульфаты, карбонаты, силикаты, фосфаты ерімейтін тұздар. Ерімтал тұздары мына заттармен әрекеттеседі:
тұздармен 3Mg(NO
3
)
2
+ 2Na
3
PO
4
= Mg
3
(PO
4
)
2
 + 6NaNO
3
+ 6NaNO
3
қышқылдармен MgCO
3
+ 2HCl = MgCl
2
+ H
2
O + CO
2
негіздермен MgCl
2
+ 2NaOH = Mg(OH)
2
 + 2NaCl
+ 2NaCl
2Mg(NO
3
)
2
 2MgO + 4NO
2
2MgO + 4NO
2
 + O
2
+ O
2
Магнийдің және оның қосылыстарының қолданылуы:
Магний - тотықсыздандырғыш ретінде металл (W, Mo, Ti, Nb, Ta, т. т. ), кейбір бейметалдарды (Si) және женіл құймалар (дюралюмин) . Магналия құймасы ең жеңіл (10% Mg, 90% Al) алуда қолданылады. Зымыран және ұшақ жасауда қолданалатын құйма) - электрон (~90% Mg) дайындауда және шойынның механикалық қасиеттерін жақсарту үшін қосылады.
MgO + H 2 O = Mg(OH) 2 - «магнезиялық сүт» асқазанның қышқылдылығын бейтараптау үшін қолданалады;
MgCl 2 - балқындысын электролиздеп алу үшін;
KCl
 MgCl
2
MgCl
2
 6H
2
O - карналлит тыңайтқыш ретінде және қыс мезгілінде көшелердегі қарды еріту үшін;
6H
2
O - карналлит тыңайтқыш ретінде және қыс мезгілінде көшелердегі қарды еріту үшін;
MgCO 3 - парфюмерияда, опалар мен тіс пасталарының құрамына қосылатын зат.
Магнийдің қосылыстарын жалынның түсі арқылы анықтауға болмайды. Магний иондарын мына реакция бойынша түзілген:
MgCl
2
+ 3NH
4
OH + H
3
PO
4
= MgNH
4
PO
4
 + 2NH
4
Cl + 3H
2
O
+ 2NH
4
Cl + 3H
2
O
Магнийаммоний ортофосфатының ақ түсті кристалдарының формасына қарай анықтайды.
Металлдарға негізделген ұнтақ қоспалары
1973 жылдан бастап жалынсыз қыздырғыштар үшін экзотермиялық қоспалар қолданыла бастады. Экзотермиялық тотығу-тотықсыздану реакцияларын жүргізу үшін Fe, Mg, Al, Zn тобындағы металлдардан, MnO 2 , PbO 2 , NiO 2 оксидтерінен және құрамында темірі бар магнийден тұратын қоспа қолданылды. [1, 2]
АҚШ армиясының зерттеу, әзірлеу және инжиниринг орталығы Natick (Natick) Power Applications Inc компаниясымен келісім-шарт жасады., Донг аралы, hot SheetTM жылудың патенттелген автономды электрохимиялық көзін тағам жылыту құралы ретінде пайдалану мүмкіндігін анықтау үшін. Eatentree. Ыстық Парақ магний анодынан, карбонэлектродтан және электролит тұзынан тұратын уытты емес электрохимиялық қыздыру элементі болып табылады. Патентке өтінімдер оны табаны қыздыру үшін пайдалануға болады деп болжайды, тек ыстық Парақ торабына су қосу. Осы келісім-шарт аяқталғаннан кейін ыстық Парақ элементінің геометриясы мен конфигурациясын түрлендіру, оңтайландыру және оралған материалды тиімді қыздыру үшін пакетке біріктіру қажет екендігі анықталды
1983-1986 жылдары химиялық қыздырғыш төсеніштерінің өнериапқыштары тамақ өнімдерін қыздыру мен медициналық қолдану үшін қыздырғыш төсеніштерге патент алды. Патент берілгеннен кейін көп ұзамай өнертапқыш Огойо штатының Цинценнатти қаласында ZestoTherm деп аталатын корпорацио құрды. ZestoTherm кілемше матрицасына натрий хлоридін қосу арқылы электр төсеніштерін модификациялауды жалғастырды, төсенішті активтендіруге тұзды судың орнына қарапайым суды қолдану үшін. Бұл жылытқыш кейінірек коммерциялық қол жетімді тағам жылытқышқа айналды. Қалыптарды электрохимиялық қыздыру су қосу арқылы белсендіріледі. Сумен Реакциядан кейін уытты емес қалдық түзіледі, ол магний гидроксийдінің әлсіз ерітіндісінен тұрады.
1. Электрохимиялық реакция
Катод O 2 + 2H 2 O+4e→4OH -
Анод 2Mg→2Mg 2+ +4e -
2. коррозия
Mg+2H 2 O→ Mg(OH) 2
Mg 2+ + 2Cl - →MgCl 2
3Гидролиз реакциясы
MgCl 2 +H 2 O+ OH - → Mg(OH) Cl-( H 2 O) + Cl -
«Механикалық қоспа» деп аталатын магний мен темірден тұратын қортпаны дайындау әдістері белгілі. Қортпаны шарлы диірменде магний үгінділері мен инертті еріткіштегі темір ұнтағының қоспасынан дайындайды. Еріткішті буландырып артық темірді бөліп алғаннан кейін құрамында 10 мас% темір бар магний қортпасы пайда болады. Қортпа 5. 6 Дж/г меншікті жылуы бар натрий хлоридінің аз мөлшерінің қатысуымен сумен белсенді реакцияға түседі.
Мұндай қоспаның кемшілігі сумен реакцияның жоғары жылдамдығы болып табылады, бұл оны сутегі алу үшін құрылғыға пайдалануға тиімді, бірақ жылуалмастырғыштарда қолдануға мүмкіндік бермейді. Темір, темір оксиді, мырыш, хром, алюминий және магний металлдарымен магний қортпасын өндіру қызығушылық тудырды. Бір әдісте қортпалар ұсақ металл бөлшектерді магнийдің ірі бөлшектеріне механикалық престеумен, басқа әдісте балқытыл, ан магнийге қатты металл бөлшектерін енгізумен және салқындатумен жасалады, бұл катализатордың магнезиум көлеміне біркелкі таралуын қамтамсыз етеді. Екі әдіс те микроэлектрохимиялық ұяшықтарды қалыптастыруға негізделген. Патентке [8] cәйкес ұяшықтарды қыздыруға арналған жоғары температурамен қамтамасыз ететін құрылғы белгілі, ол үшін магний қортпалары шарлы диірменде мыс, титан, хром, никель, көміртегі ұнтақтарымен түзіледі. Кемшілігі дененің күйіп қалуының алдын алу үшін меншіктк жылу бөлуі төмен қортпалар алу ұсынылады.
Құрамында темір бар магний қортпасының ұнтағы, NaCl тұзы, беттік активті зат және pH реттегіш ретінде тамақ қышқылының ангидридінен тұратын шар диірменде дайындалған қоспа жалынсыз қыздырғыштарға арналған экзотермиялық композиция белгілі. Экзотермиялық композициясы бар кеуекті қаптамаға қышқылды сіңдіруге болады. Қышқыл pH ортасын 4-7 аралығында бақылайды, өйткені магнийдің сумен реакциясы pH төмен болса өте тез және pH жоғары болса өте баяу жүреді. Бұл композицияның кемшілігі беттік активті заттардың, ангидридтердің немесе бос қышқылдардың бар екндігі болып табылады, компаненттің құрамындағы магний қортпасының үлесін азайтады, сондықтан да компазиттің жылу бөлуін төмендетеді. Ең жақын техникалық шешім жалынсыз қыздырғышта сумен экзотермиялық әсер ететін ұнтақ қоспасы болып табылады, екі мата емес полистэрден құралған пакет ішінде экзотермиялық қоспа қүрайтын көптеген компаненттерден құралғанғ атап айтқанда деформер, инертті толтырғыш және NaCl ұнтағы. Инертті толтырғыш қоспаға Магнийдің сумен реакциясын тұрақтандырғыш ретінде қосылады. Осының салдарынан магний қортпасының үлесі төмендеп композиттің жалпы жылуын азайтады. [9]
Электрохимиялық қыздырғыштардың жастықшалары су қосу ақылы белсендіріледі. Сумен реакциядан кейін уытты емес қалдық түзіледі, ол магний гидроксийдінің әлсіз ерітіндісінен тұрады. Патентке сәйкес, құрамында 5% Fe үлесі бар 4г Mg 151г тағамның температурасын шамамен 55ºС қа; төменгі температурасы 21 ºС және жоғарғысы 76 ºС қа дейін жоғарлатуға қабілетті. Жылу қаптамадан газ және бу тәрісзді сутегі бөлінеді. Газ тәрізлі сутегі тез ыдырайды және қауіп төндірмейді. Ашық жалынның және ұшқынның көмегімен сутегіні жағу әрекеті тұтануды тудыра алмайды. Қаптамадан жылу өткізгіштігі бойынша тамаққа жылу беріледі. Жылу металл магнийдің сумен реакцияға түсуі арқылы өндіріледі. [10]
Mg+ 2H 2 O→Mg(OH) 2 + H 2 +
[∆H= -351кДж/моль]
[11] мақалада дала жағдайында армияға рационды жылытуға арналған жаңа жалынсыз электромагниттік жылытқыштар ұсынылған. Ол гистерезис және қатты темірдегі құйынды жылу қуатын және рационды қыздыру үшін қысқа мыс өзекшелерде қысқа тұйықталудың жылу қуатын пайдаланады. Электр машиналарындағы температураны және шығындарды ұлғайтудың кері есебі негізінде отсыз қыздырғыштың математикалық моделі көрсетілген. Үшөлшемді уақытша қадамның соңғы элементтерін талдау нәтижесінде магнит өрісі мен құйынды токтың таралуы, сондай-ақ қыздырғышта қысқа тұйықталу тогының сигналы және айналудың әртүрлі жылдамдықтары бар қыздырғыштың жылу қуаты келтірілген. есептеледі. Соңында, эксперимент ұсынылған және қыздырғыштың температурасының жоғарылау қисықтары әртүрлі жылдамдықпен салынған. Осы мақалада жүргізілген зерттеулер мұндай жылытқыштарды одан әрі зерттеу үшін негізгі платформа құрды. Жоғарыда айтылғандай, магний негізіндегі композициялардың бірнеше кемшіліктері бар. Магний қасиеті жылу бөлумен сумен өзара әрекеттесетіні белгілі. Реакция РН ортасынан 8, 5 төмен өтеді. РН жоғарылауы өзара әрекеттесуге кедергі келтіретін беттің пассивациясына алып келеді және магний сутегі Судан ығыстырылуын тоқтатады. Бұл өзара әрекеттесуді практикалық пайдалану магний реакциясының жылдамдығын реттеу үшін ортаның рН әсер ететін қосымша қосылыстарды енгізу қажет. Қышқыл ангидридтері мен бос қышқылдар процесті жылдамдатушы ретінде, ал күшті негіздердің тұздары мен әлсіз қышқылдардың тұздары, мысалы, бикарбонаттар, карбонаттар, фосфаттар және сілтілі металдардың полифосфаттары, кальций гидроксиді және т. б. баяулататын реакция ретінде әрекет етуі мүмкін. , Кемшілігі 5 кДж / г (магний) кем болатын реакцияның меншікті жылуы болып табылады және магний қоспасында отынды босататын негізгі компоненттің құрамын төмендететін балласт болып табылатын қосымша қосылыстардың болуы жылу бөлу әсерімен арттыру үшін онымен микрогальваникалық элемент құрайтын металл катализаторы бар магний қорытпалары пайдаланылады сумен магний электрохимиялық болып табылады. Бұдан басқа, композициялар жылудың біркелкі бөлінбеуімен сипатталады, тек тотығу-қалпына келтіру реакцияларының бастапқы сатысында қарқынды болады, бұл қыздырылған объектімен жылу алмасу процесінің елеулі кемшілігі болып табылады. Тағы бір кемшілік тотығу-тотықыздану реакцияларының табиғаты қоспа компоненттеріне сақтау жағдайында байланысуға мүмкіндік бермейтіні және күрделі конструкцияны қыздырғыштардың, компресстердің және басқа да өнімдердің бірнеше бөлімшелерімен алдын ала анықтайтыны болып табылады. Реакцияны бастау үшін компоненттер Мұқият араласуы керек, бұл оларды пайдалану ыңғайсыздығын алдын ала анықтайды [12] .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz