Сілтілік металдардың физико-химиялық сипаттамасы және олардың негізіндегі жалынсыз қыздырғыштардың құрамы мен қолданылуы


І ӘДЕБИ ШОЛУ
1. 1 Сілтілік металдардың жалпы қасиеттері
Периодтық жүйенің I тобының негізгі топшасына: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr жатады. Бұл топшада орналасқан элементтер сілтілік металдар деп аталды. Себебі олардың өздері және олардың оксидтері сумен әрекеттесіп, сілтілер түзеді. Сілтілік металдардың атомдарының сыртқы энергетикалық деңгейінде бір электрон бар - ns 1 . Сілтілік металдардың ішінде натрий мен калий қосылыстары бізге ерте заманнан белгілі. Бұл екі элементтің де тірі азға үшін маңызы өте зор. Литий алғаш рет жеке химиялық элемент ретінде XIX ғасырдың басында ашылған болатын. Алайда өнеркәсіптік деңгейде шамамен 40 жыл бұрын қолданысқа ене бастады. Рубидий мен цезий ғылыми тұрғыдан қызығушылық тудырғанымен, өнеркәсіпте аз қолданысқа ие. 87-нші нөмірлі ұстатпайтын франций табиғатта өте аз уақытта пайда болды, сондықтан ол тек 1939 жылы ашылған болатын.
Сілтілік металдардан тек натрий мен калий ғана кең тараған. Жер қыртысындағы натрийдің массалық үлесі - 2, 64 %, ал калийдің массалық үлесі - 2, 60 %-ды құрайды. Литий, рубидий және цезийдің мөлшерлері біршама азырақ мөлшерді құрайды. Жер қыртысындағы литийдің массалық үлесі - 6, 5·10 -3 %, рубидийдің массалық үлесі - 0, 031 %, цезийдің массалық үлесі - 7·10 -4 %-ды құрайды. Сілтілік металдар табиғатта бос күйінде кездеспейді. Натрийдің негізгі табиғи қосылыстары галит немесе тас тұзы және мирабилит немесе глаубер тұзы минералдары болып табылады. Калийдің мағызды минералдарына сильвин, карналлит, сильвинит жатады. Рубидий және цезий шашыраңқы элемент болғандықтан, олардың қосылыстары калий минералдарының құрамында кездеседі. Франций - радиоактивті элемент. Бұл элементтің іздері табиғи уранның ыдырау өнімдерінен табылған. Франций изотопының өмір сүру мерзімінің аздығына байланысты оны көп мөлшерде алу қиындық тудырады, сондықтан металл францийдің және оның қосылыстарының қасиеттері жеткілікті түрде зерттелмеген. Сілтілік металдар иондарының үлкен ( заряды аз, радиусы үлкен) болғанымен, олардың d - электрондары жоқ және кешенді қосылыстар түзуі қиын. Кез келген басқа топта орналасқан металдардың иондарымен салыстырғанда, олардың кешенді қосылыстарының саны біршама аз. Кешен түзу қабілеті топтың төменгі жағына қарай төмендейді.
Сілтілік металдарда валенттілік электрондары s - элементтері деп те атайды. S элементтері қалыпты жағдайда кристалдық күйде болады, басқа металдарға қарағанда тығыздықтары төмен. Литий, калий және натрий судан жеңіл (0, 53 - 0, 86 г/см3), сондықтан су бетінде қалқып жүреді. Олардың балқу және қайнау температуралары төмен, бұл олардың кристалдық торларындағы металдық байланыстың әлсіз болуынан. Бұл олардың кристалдық торларындағы металдық байланыстың әлсіз болуынан. Бұл металдар және олардың қосылыстары жалын түсін төмендегідей өзгертеді: литий - қызыл, натрий - сары, калий - күлгін түске бояйды. Литийді 1817 жылы А. Арфведсон, рубидий мен цезийді 1861 жылы Р. Бунзен, натрий мен калийді 1807 жылы Г. Дэви ашқан. Рубидий мен цезий фотоэлементтерді жасауда қолданыс табады, өйткені жарық әсерінен ядросымен нашар байланысқан электрондары оңай үзіліп кетеді.
Сілтілік металдардың физикалық қасиеттері. Литий, натрий, калий, рубидий еркін күйінде күміс-ақ түсті металдар, цезий алтын-сары түсті. Барлық металдар өте жұмсақ және иілгіш болып келеді. Ең қаттысы литий, қалған металдарды пышақпен оңай кесуге болады. Барлық сілтілік металдар аз тығыздыққа ие. Ең жеңіл металл - литий, оның тығыздығы тек 0, 53 г/см3. Сілтілік металдардың балқу және қайнау температурасы төмен, және де элементтің реттік нөмерінің артуымен металдың балқу температурасы төмендейді.
Кесте-1. Сілтілік металдардың сипаттамалары (элемент және жай зат)
Элемент
Валенттілік
электрондық формуласы
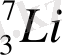
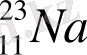
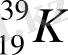
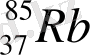
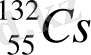
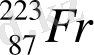
Натрий және оның қосылыстары. Натрий периодтың III топтың негізгі топшасының элементі, атомдық нөмері 11, сондықтан ядросындағы протон саны 12, электрондық жалпы саны 11, салыстырмалы атомдық массасы 23. Натрийдің электрондары үш электрондық қабатта орналасқан: 1s 2 2s 2 2p 6 3s 1 . Валенттілігі I, тотығу дәрежесі 0, +1.
Натрий табиғатта көптеп кездесетін элемент. Жер қыртысында таралуы бойынша натрий алтыншы орында тұр. Натрийдің табиғи минералдары: NaCl - галит, ас тұзы, NaNO
3
- чили селитрасы, Na
3
AlF
6
- криолит, Na
2
SO
4
 10H
2
O- мирабилит немесе глаубер тұзы, Na
2
B
4
O
7
10H
2
O- мирабилит немесе глаубер тұзы, Na
2
B
4
O
7
 10H
2
O - бура.
10H
2
O - бура.
Натрий өзінің гидроксидінің немесе хлоридінің балқымасының электролизі арқылы алынады.
2NaCl
 2Na+Cl
2
2Na+Cl
2
Натрий пышақпен оңай кесілетін жұмсақ металл (p = 0, 97 г/см3), жаңа кескен кезде жылтырап тұрады, бірақ ауада тотығып күңгірт тартады, сондықтан ол барлық сілтілік металдар сияқты сусыз керосиннің астында сақталады. Электр тоғы мен жылуды өте жақсы өткізеді.
Натриймен жұмыс істегенде аса сақ болу керек, оның түйірін қолмен ұстауға болмайды, себебі ол терідегі сумен әрекеттесіп, оны күйдіреді. Металдың қалдығын кез келген жерге тастауға болмайды.
Натрий ғылым мен техниканың әр алуан саласында қолданылады; ядролық реакторларда жылу тасымалдаушы ретінде, органикалық реакцияларда өршіткі, медицинада радиоактивті изотоп күйінде қолданылады.
Натрий - органикалық синтезде, металдар алуда тотықсыздандырғыш ретінде, жылуды жақсы өткізетіндіктен авиамоторлардың тоңазытқыш жүйелерінде.
NaCl - физиологиялық ерітінде (0, 9 %) қан плазмасын уақытша ауыстыру үшін, керамика өндірісінде, консервант ретінде; NaOH - сабын, қағаз, жасанды жібек өндірістерінде, мұнай өндеуде; Na 2 CO 3 - шыны, сабын өндірістерінде, судың кермектілігін жоюда; NaHCO 3 - шыны, кондитер өндірістерінде; NaNO 3 - азобояулар алуда, азотты тыңайтқыш ретінде; Na 2 SO 4 - шыны және вискоза талшығын алуда; Na 2 SO 3 - консервант, ағартқыш, залалсыздандырғыш ретінде; Na 2 O 2 - сүңгуір қайықтарда оттегін алу үшін қолданылады:
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2
Натрийдің қосылыстарын жалынның түсін сары түске бояуы арқылы анықтауға болады. Натрий гидроксиді - қағаз, сабын, дәрі-дәрмек, жасанды талшық өндірісінде, мұнай өнімдерін тазартуда қолданылады. NaOH - каустикалық сода, күйдірігіш натр деген атпен белгілі; өте су тартқыш (гигроскопиялық), ақ түсті қатты зат. Ол суда ерігенде көп мөлшерде жылу бөлінеді, ерітіндісі сілті деп аталады. Алу әдістері төмендегідей:
2Na+ 2H
2
O = 2NaOH + 2H
2
Na
2
CO
3
+ Ca(OH)
2
= CaCO
3
 + 2NaOH
+ 2NaOH
Калийді натриймен бірдей уақытта Г. Дэви анықтаған болатын. Калий гидроксидінің сулы электролизі кезінде анықтаған. Элемент өз атауын осы қосылыстың атауынан «күйдіргіш калий» алған болатын. Калийдің қасиеттері натрийдің қасиеттерінен едәуір ерекшеленеді, бұл олардың атомдары мен иондарының радиусы шамаларының айырмашылығына байланысты.
Калий. Калий IV периодтың I топтың негізгі топшасының элементі. Атомдық нөмері 19, сондықтан ядро заряды +19, электрондардың жалпы саны да 19, нейтрон саны 20, салыстырмалы атомдық массасы 39. Калийдің 19 электроны төрт денгейде бөлініп орналасқан:1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
Валенттілік электроны 4s
1
, валенттілігі I, тотығу дәрежесі 0, +1. Калий табиғатта таралуы бойынша жетінші орында тұр, оның табиғи минералдары сильвинит KCl
 NaCl, карналлит KCl
NaCl, карналлит KCl
 MgCl
2
MgCl
2
 6H
2
O, каинит KCl
6H
2
O, каинит KCl
 MgSO
4
MgSO
4
 6H
2
O, өсімдіктің күлінде сақар K
2
CO
3
күйінде кездеседі. Рубидий мен цезий калий минералдарымен бірге болады (Ақтобе облысында Жыландыда, Атырау өңірінде) . Калийді оның хлоридінің балқу температурасы жоғары болғандықтан (650
0
C) көбінесе гидроксидінің балқындысын (сақар қосылған) электролиздеу арқылы алады.
6H
2
O, өсімдіктің күлінде сақар K
2
CO
3
күйінде кездеседі. Рубидий мен цезий калий минералдарымен бірге болады (Ақтобе облысында Жыландыда, Атырау өңірінде) . Калийді оның хлоридінің балқу температурасы жоғары болғандықтан (650
0
C) көбінесе гидроксидінің балқындысын (сақар қосылған) электролиздеу арқылы алады.
Калий жеңіл (
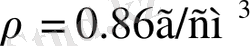 ), оңай кесілетін, балқу температурасы 64
0
C, қайнау температурасы 776
0
C болатын металл. Калийдің химиялық белсенділігі өте жоғары, ол металдардың электрохимиялық кернеу қатарының басында (Li - ден кейін) орналасқан (
), оңай кесілетін, балқу температурасы 64
0
C, қайнау температурасы 776
0
C болатын металл. Калийдің химиялық белсенділігі өте жоғары, ол металдардың электрохимиялық кернеу қатарының басында (Li - ден кейін) орналасқан (
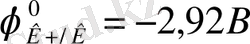 ) .
) .
Калий және оның қосылыстарының қолданылуы. Калий - атомдық реакторларда жылу тасымалдаушы ретінде;
KNO 3 - кешенді тыңайтқыш, қара дәрінің құрам бөлігі (75 % KNO 3 , 15% C, 10% S) . Қара дәрінің қопарылу реакциясы:
2KNO
3
+ 3C + S = K
2
S + N
2
 + 3CO
2
+ 3CO
2
Себебі,
2KNO
3
 2KNO
2
+ O
2
2KNO
2
+ O
2
K 2 CO 3 - шыны, сабын өндірісінде, нан-тоқаш өндірісінде қопсытқыш ретінде;
KJ - Люголь ерітіндісін дайындауда (J 2 + KJ), баспадан (ангина) емдеу үшін, иодталған ас тұзын алу үшін.
KClO 3 - бертолле тұзы, калий хлораты; сіріңке өндірісінде, пиротехникада, оттегін алу үшін қолданылады.
2 KClO
3
= 2KCl + 3O
2
Калийдің қосылыстарын жалынның түсін күлгін түске бояуына қарай анықтаймыз.
1861 жылы минерал тұздарын спектралды талдаумен зерттегенде Роберт Бунзен жаңа элементті тапты. Оның болуы басқа элементтер көрсетпеген спектрде қара-қызыл сызықтармен дәлелденді. Бұл сызықтардың түсі бойынша элемент рубидий деп аталды (rubidus-қара-қызыл) . 1863 ж. Бунзен бұл металды таза күйінде рубидия тарратын (шарап қышқыл тұзы) күйемен қалпына келтірді. Элементтің ерекшелігі-оның атомдарының жеңіл қоздырғыштығы. Көрінетін спектрдің қызыл сәулелерінің әсерінен электрондық эмиссия пайда болады.
Цезийдің ашылуы рубидий сияқты спектральды талдаумен байланысты. 1860 ж. т. Бунзен белгілі бір элементке жатпайтын спектрдегі екі ашық көгілдір сызыққа тап болды. Осыдан "цезиус" (caesius - аспан көк) атауы пайда болды. Бұл элемент сілтілік металдар тобына жататын соңғы элемент. Ең үлкен атомдық радиус және ионизацияның ең кіші потенциалдары осы элементке тән. Цезий металдық қасиетке ие. Сыртқы 6s-электронын беруге ұмтылуы оның барлық реакцияларда қарқынды әрекеттесетінене айқын дәлел. Атомдық 5D-және 6S-орбиталь энергияларының аздаған айырмашылығы атомдардың жеңіл қоздырғыштығын тудырады. Цезийде электрондық эмиссия көрінбейтін инфрақызыл сәулелердің (жылу) әсерінен байқалады. Атом құрылымының көрсетілген ерекшелігі элементтің жақсы ток өткізгіш екенін сипаттайды. Осының бәрі электрондық аспаптарда цезийдің таптырмас элемент екеніне дәлел. Соңғы уақытта болашақ отыны ретінде және термоядролық синтез проблемасын шешуге байланысты цезий плазмасына көп көңіл бөлінуде.
Ауада литий тек оттегімен ғана емес, азотпен де белсенді әрекет етеді және Li 3 N (75% дейін) және Li 2 O тұратын пленкамен жабылады.
Сілтілік металдардың қолданылуы. Сілтілік металдардың ішіндегі ең көп қолданылатыны - натрий. Оны көбінесе металдар мен құймалар өндірісінде қолданады. Және де натрий бейорганикалық және органикалық қосылыстар, мысалы Na 2 O 2 , NaCN алу үшін қолданылады. Ол органикалық қосылыстардың тотықсыздандырғышы, кейбір реакциялардың катализаторлары болады. Натрийдің калиймен құймасы ядролық энергия көздерінде жылутасымалдағыш (жылуды тасымалдаушы) ретінде қолданылады. Сілтілік металдардың басқалары көп қолданысқа ие емес. Калий, рубидий мен цезийді жарық энергиясын электр энергиясына айналдыратын фотоэлементтер жасауға қолданады. Калий ядролық реакторларда жылутасымалдағыш ретінде қолданылатын құймалар құрамына енеді. Литий мыс, магний және алюминий негізіндегі құймалар өндірісінде (құймалардың жеңіл болуын қамтамасыз етеді) қолданылады. Халық шаруашылығында натрий мен калий қосылыстары кеңінен қолданылады. Натрий хлориді натрий, хлор, хлорсутек қышқылы және сожда сияқты маңызды химиялық қосылыстар өндірісіне қажетті шикізат ретінде қолданылады. Натрий сульфаты күкірт қышқылы, сода және шыны өндірісінде пайдаланылады.
1. 2 Сілтілік металдар негізіндегі жалынсыз қыздырғыштар.
Жалынсыз қыздырғыштар далалық жағдайларда тағамдарды жылыту мақсатында қолданылатын химиялық жылу көздері. Көптеген зерттеулер көрсеткендей жалынсыз қыздырғыштар жеңіл, қауіпсіз, пайдалануға ыңғайлы, баптауларды мүлде немесе жартылай қажет етпейтін, тағамды жылдам жылытатын және жалынсыз болуы қажет. Жалынсыз қыздырғыштар түнгі уақытта әртүрлі жағдайларда қолдануға ыңғайлы, және желдің немесе қолайсыз ауа райының әсеріне ұшырамайды.
Жалынсыз қыздырғыштар пакет-қыздырғыштан тұрады. Қыздырғыш элемент (пакет-қыздырғыш) - ақ кеуекті пакет, оның ішінде химиялық қоспа болады. Сумен жанасқанда қыздырғыш элемент суды буландыра жылудың айтарлықтай мөлшерін бөліп шығарады. Осы кезде бөлінген бу температурасы +80 о С-қа дейін көтеріледі. Жалынсыз қыздырғыштар - тағамды қыздыру үшін пайдаланылатын белсенді экзотермиялық, химиялық қыздырғыш болып табылады. Жалынсыз қыздырғыштар американдық әскери топтың талабы бойынша, 226, 8 г жалынсыз қыздырғыш 12 минут аралығында температураны 56 0 С көтере алу қажет. Және де бұл жалынсыз қыздырғыштарда көзге көрінетін жалын болмайды. Жалынсыз қыздырғыштар құрамына аз мөлщерде темір, ас тұзы және жұқа ұнтақталған металл магний кіреді. Реакцияны белсендіру үшін судың аз мөлшерін қосады. Жалынсыз қыздырғыштар алу барысында тотығу - тотықсыздану процесі орын алады. Су келесі химиялық реакцияға сәйкес металл магнийді тотықтырады:
Mg + 2H 2 O → Mg (OH) 2 + H 2 [+ жылу (q) ] (1)
Бұл реакция темірдің оттегімен әрекеттесуіне ұқсас. Бірақ реакция баяу жылдамдықта өткендіктен, темір бөлшектері мен ас тұзы реакциясын жеделдету үшін магний бөлшектері қосылады.
Қазіргі таңда әлемнің көптеген елдерінде жалынсыз қыздырғыштардың жаңа құрамын әзірлеуге көп көңіл бөлінуде. Жылытқыштар консервіленген өнімдермен бірге АҚШ, Еуропа, Жапония, Ресей және басқа елдердің әскери қызметшілерінің жеке тамақтану рациондарының құрамына кіреді. Олар азық-түлік жылыту үшін қарапайым қауіпсіз әдісті қамтамасыз етеді.
1980 жылдары КСРО-да қарулы күштер қызметкерлері мен кәсіптері далалық қызметпен байланысты барлық адамдар үшін жеке тамақтану рационын жақсарту бойынша жұмыстар жүргізе бастады. Тәжірибе барысында жалынсыз қыздырғыштар толық от көзіне лайықты алмастыру деп санады. Өкінішке орай, Қазақстанда отсыз тамақ жылытқыштарын әзірлеу бойынша зерттеу жұмыстары жоқ. Қазақстандағы жалынсыз қыздырғыштардың құрамдары әлемнің түрлі елдерінен импортталады. Сондықтан ұлттық мүдделер шеңберінде тамақты жалынсыз қыздырғыштардың отандық құрамдарын құру бойынша ғылыми зерттеулер мен технологиялық әзірлемелерді жүргізу өзекті болып табылады және практикалық маңызы бар.
Жылыту элементі ретінде химиялық қоспасы бар ақ кеуекті пакет қолданылады. Сумен жанасқан кезде жылыту элементі ішіне түскен суды буландыра отырып, айтарлықтай жылу бөледі. Барлық процесс қыздырғыш пакет ішінде өтеді. Жалынсыз қыздырғыштардың мөлшері шамамен 50-60 г, құрайды. Ал өлшемі 30*20 см құрайды. Олардың толық қыздыру уақыты 10-15 минут ішінде ауытқиды. Ылғалдылығы 70%-дан аспайтын, температура -40+40 0 С аралығында болатын жағдайда жалынсыз қыздырғыштарды 3 жылғы дейін сақтауға болады. Жалынсыз қыздырғыштардың түріне байланысты барлық көрсетілген шамалар шамалы өзгеруі мүмкін.
Mg - Fe тотығу - тотықсыздану реакциясы өте белсенді жүреді, бірақ өнімге көп мөлшерде сутегі бөледі. Бұл реакцияны пайдалану автоматты қаптау кезінде өрт қаупін төндіруі мүмкін. Жалынсыз қыздырғыштардың, белсенділігі төмен, көптеген сумен реакциялары бар. Жылу көзі үшін пайдаланылуы мүмкін балама материалдардың мысалдары:
1. Кальций оксиді плюс кальций гидроксиді алу үшін су.
2. Сусыз кальций хлориді плюс гидратталған кальций хлоридін алуға арналған су.
3. Магний оксиді плюс магний гидроксидін алу үшін су.
4. Сумен цеолитті молекулалық сит.
5. Сумен Силикагель.
Автономды қыздыру аппараттарына жарықтандырғыш ретінде және тағамдарды қыздыратын немесе дайындайтын жалынсыз қыздырғыштардың негізі ретінде қолданылатын химиялық жылу көздері саласындағы өнертабыстардың тарихы тереңде жатыр. Жалынсыз қыздырғыштар сарбаздардың жекелеген әскери тағамдарын қыздыруға арналған құрылғымен жабдықтау қажеттілігі туындады. Жылыту аппараттарының алдыңғы жүйелерінің талдаулары көрсеткендей қыздырғыштардың оңтайлы құрылғысы жеңіл, қауіпсіз, пайдалануға ыңғайлы, түзетулерді мүлде немесе жартылай қажет етпейтін, тағамды жылдам жылытатын және жалынсыз болуы қажет. Жалынсыз қыздырғыштар түнгі уақытта әртүрлі жағдайларда қолдануға ыңғайлы, және желдің немесе қолайсыз ауа райының әсеріне ұшырамайды. Осылайша, өздігінен қыздыратын қаптаманың өндіру технологиясы жүз жылдан астам уақыт бойы белгілі. Олардың ұнтақ құрамдарының әртүрлі болуына байланысты жалынсыз қыздырғыштар кеңінен қолданылуда. Қыздырғыштардың танымал маркасында кальций карбонаты, натрий карбонаты, кальций оксиді және алюминий ұнтақтарының қоспасы экзотермиялық реакцияны тудырады.
Металдарға негізделген ұнтақ қоспалары. 1973 жылдан бастап жалынсыз қыздырғыштар үшін экзотермиялық қоспалар қолданыла бастады. Экзотермиялық тотығу-тотықсыздану реакцияларын жүргізу үшін Fe, Mg, Al, Zn тобындағы металдардан, MnO 2 , PbO 2 , NiO 2 оксидтерінен және құрамында темірі бар магнийден тұратын қоспа қолданылды.
Карбонаттар негізіндегі ұнтақты қоспалар құрамында магний бар композиттермен қатар сілтілі металдар карбонаттарымен қосылыстар да зерттелді. Сілтілі металдар карбонаттарын пайдалану тарихы, сондай-ақ ең ерте кезден зерттелді. Сілтілі металдар карбонаттарын қыздыру компоненті болып табылатын консервілік банкалар 1900-ші жылдардың басынан бастап дайындалған және негізінен тау-кен экспедициялары мен зерттеулерінде пайдалануға арналған. Мысалы, американдық аэростат Алан Рамси Хоулси, 1910 жылы Гордон Беннет Кубогы үшін әуе шарлары жарысында өз әріптесімен жеңіске жетті, ол өзімен бірге үш өздігінен қызатын сорпа банкаларын алды деді. Басқа американдық археолог Хирам Бингхэм, өзінің "земля инков" кітабында 1909 жылдан 1915 жылға дейін Оңтүстік Америкаға саяхат кезінде өзі қызатын консервілерді қалай жейтінін айтты. Алайда, бұған қарамастан, "ақылды" қаптама кең таралған жоқ. Өйткені, соғыс кезінде барлық өздігінен қызатын консервілер әскер мұқтаждарына сақталды және тек алты жыл өткен соң сөрелерге қайтарылды. Бірақ сол кезде де олар жаппай сұраныстың тауары болған жоқ, өйткені бағасы тым жоғары болды. Сондықтан өзін-өзі қыздыру технологиясы ұзақ уақыт әскери "қару-жараққа" қалды.
Өнертабыстың ерекшеліктеріне сәйкес жылу көзі негізінен сілтілі жер металының пероксидінен, сілтілі металл карбонатынан және қалпына келтіргіштен жасалған құрғақ ұнтақ тәрізді композицияны қамтитын пайдалануға дайын, буып-түю үшін қолайлы жылу көзі ұсынылады. Су қосылған кезде сілтілі жер металының пероксидін және сілтілі металл карбонатын реакция өнімі ретінде бөлінетін жылу энергиясын қамтамасыз ете отырып, қалпына келтіргішпен реакцияға енетін ерітіндіде пероксидті шығарады. Сілтілі жер металының асқын тотығы-кальций пероксиді. Кальций пероксиді кальций гидроксидімен және қышқылмен қоспа түрінде берілуі мүмкін, мұнда молярлық қышқыл мөлшері кальций гидроксидіне баламалы. Қышқыл щавель қышқылын, лимон қышқылын және алма қышқылын қамтитын топтан таңдалуы мүмкін. Құрамында Янтарь қышқылы болуы мүмкін. Сілтілі металл карбонаты натрий карбонаты болуы мүмкін. Қалпына келтіргіш ұнтақ тәрізді композиция түрінде беріледі. Қалпына келтіргіште алюминий болуы мүмкін. Қалпына келтіргіш құрамында күкірт атомы бар химиялық құрылыммен алюминий қосылысын қамтуы мүмкін. Сондай-ақ, қалпына келтіргіш құрамында натрий метабисульфиті немесе аскорбин қышқылы болуы мүмкін. Реакция түрі төменде келтірілген [14]
3CaO 2 + 3Na 2 CO3 + 2Al = 3CaCO3 + 2NaAlO 2 + 4NaOH (2)
Ұнтақ тәрізді қатты заттардың қоспасы қолданғанда бұзылмайды, Осылайша жасалған, мата емес немесе мата талшықтан жасалған ыңғайлыш ағын су кеуекті реакциялық пакеттерге орналастырылуы мүмкін. Реакциялық қап әдетте екі қабатты тәсілмен орналасқан, 10 см * 20 см өлшемді талшықты материалдың тік бұрышты табағынан жасалуы мүмкін, олар қылықапды анықтауға болады, бірнеше кіші қалтаға ыңғайлы бөлінген, екі жағынан тігілетін, термоөңделген, желімделген немесе өзге де түрде бірге бекітілген материал.
Мұндай жұмыстарды авторлар зерттеді [15] Реагенттерге сөндірілмеген әк (CaO), натрий гидроксиді, кобальт, хром, темір, темір гидроксиді, магний, марганец, магний хлориді, молибден, қалайыоксиді (II), титан, натрий, кальций гидроксиді, күкіртқышқылы, азот қышқылы және металл натрий кіреді. Реагенттер бөлме температурасында металл немесе металл қосылысы түрінде оттегімен әрекеттесетін оксидті құрайды және экзотермиялық сипаттамасы болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz