Мектеп химиясында V-топ (азот топшасы) элементтерін оқытуда инновациялық технологияларды енгізу және тиімділігін бағалау


Оңтүстік Қазақстан педагогикалық университеті
Міралиева Меруерт Әбласанқыызы
«Мектеп химия курсында V-топтың элементтерін оқытуда иновациялық технологияларды пайдалану»
ДИПЛОМДЫҚ ЖҰМЫС
Шифры: 5В011200 Мамандықтың атауы: «Химия»
Шымкент, 2017
Ф. 7. 04-15
Оңтүстік Қазақстан педагогикалық университеті
Кафедра «Жаратылыстану пәндері»
«Қорғауға жіберілді»
Кафедра меңгерушісі
а. ш. ғ. к., Ш. А. Жумабаев
«» 2017ж.
ДИПЛОМДЫҚ ЖҰМЫС
Тақырыбы: «Мектеп химия курсында V-топтың элементтерін оқытуда иновациялық технологияларды пайдалану»
Шифры: 5В011200 Мамандықтың аталуы: «Химия»
Орындаған: 112-31 топ студенті Міралиева М. Ә.
Ғылыми жетекшісі т. ғ. к., : Төлешова К. Т.
Норма бақылаушы:
Шымкент, 2017
Ф. 7. 04-16
Оңтүстік Қазақстан педагогикалық университеті
Факультеті Жаратылыстану - педагогикалық
Мамандығы: Химия - 5В0112000
Кафедрасы:«Жаратылыстану пәндері»
«Бекітемін»
Кафедра меңгерушісі
«»2017ж.
Дипломдық жұмысты (жобаны) орындауға
ТАПСЫРМА
Студентке Міралиева Меруерт Әбласанқызы
112-31тобы химия мамандығы 5В011200 Химия
топ, мамандық, оқу түрі
Дипломдық жұмыстың (жобаның) тақырыбы:
Мектеп химия курсында V-топтың элементтерін оқытуда иновациялық технологияларды пайдалану
университет ректорының « » 20___ ж. № бұйрығымен бекітілген.
Аяқталған жұмысты (жобаның) тапсыру мерзімі «» 20___ ж.
Жұмысты орындауға бастапқы мәліметтер (заңдар, әдебиет көздері, өндірістік мәліметтер)
Дипломдық жұмысты (жобаны) орындауға қатысты сұрақтар тізімі :
1. Тыңайтқыштардан бастап N, Р, As, Sb, Bi элементтеріне дейін
2. V топтың элементтерінің жалпы сипаттамасы
3. «Азот топшасы» тақырыбы бойынша сабақтарды өту әдістемесі
4. VA топша элементтерін ойындық әдіспен оқыту әдістемесі
5. Азот және фосфор элементтерін тірек-сызбалар негізінде оқыту
6. «Азот топшасы» тарауын қорытындылау сабақтарында жаңа технология элементтерін қолдану
7. Орта мектептің 8 сыныбында «Vа топша - азот топшасы» тақырыбын тірек-конспектілер бойынша өтуге арналған сабақ жасалымы
8. 8 сынып химия пәні курсының оқу үрдісінде «Азот топшасы» тақырыбын жаңаша технологиямен өтудің нәтижелерін есептеу .
Графикалық материалдар тізімі (сызбалар, кестелер, диаграммалар, т. б. )
Жұмыс көлемі 2 суретті, 4 кестені, қорытынды мен 44 пайдаланылған әдебиеттер тізімін қамтитын 63 баспалық беттен тұрады.
Ұсынылатын негізгі әдебиеттер тізімі
1. Қазақстан Республикасының 2015 жылға дейінгі білім беруді дамыту тұжырымдамасы // Шымкент келбеті. - 2004. - 9 қаңтар, 15-16 бб. 2. Назарбаев Н. Ә. Еркін елдің ертеңі - кемел білім мен кенен ғылымда // Егемен Қазақстан. - 2004. -14 қазан, 1-2 б.
3. Қазақстан Республикасының Білім туралы заңы.
4. Қазақстан Республикасы "Білім" мемлекеттік бағдарламасы. // Қазақстан мұғалімі. - 2000. 28 қазан,
5. Назарбаев Н. Ә. «Қазақстан - 2030» Ел Президентінің Қазақстан халқына Жолдауы. Алматы, «Кітап «, 1998.
67 Назарбаев Н. Ә. Заманның сыншысы да, тарихшысы да - бүгінгі жастар // Орталық Қазақстан. 2001-№6, 7 ақпан.
7. Амонашвили Ш. А. Воспитателъная и образователъная функция оценки учения школъников. - М., 1984.
8. Бұзаубақова К. Жаңа педагогикалық технологиялар // Қазақстан мектебі. - 2005. -№4. -5-86.
9. Бегжігітова А. Модулъдік оқыту технологиясы. // Білім кілті. 2006, - 186 б.
10. Жанпейісова М. М. Технология модулъного обучения. - Актобе, РИПК СО, 1999.
11. Жанпейісова М. М. Модулъдік оқыту технологиясы оқушыны дамыту құралы ретінде. Алматы. 2002, 6-7 б.
12. Клипберг Л. Проблемы теории обучения. /пер. с нем. / - М., 1984.
13. Қайырбекова А. Модулъдік технология негізінде // Ұлагат. 2003-№2, 38/6.
14. Қалықова А. және т. б. Оқыту үрдісінде педагогикалық технологияларды ұстамды пайдалану // Білім. 2006, -№3, 22 б.
15. Шаповаленко С. Г. Методика обучения химии в восьмилетней и средней школе. - М. : Учпедгиз, 1963. - 667 б.
16. Аликберова А. Ж. Химия бойынша қолданбалы есептер мен қызықты тәжірибелер. - А., : Ғылым, 2002. - 432 б.
17. Қазақстан Республикасындағы 12 жылдық жалпы орта білім беру ұйымдарында бейінді білім беру тұжырымдамасы- Астана 2010 ж.
18. Қазақстан Республикасының білім беруді дамытудың 2011-2020 ж. арналған мемлекеттік бағдарламасы.
19. . Жалпы білім беретін оқу мекемелерінің жұмыс оқу жоспарын жасауға ұсыныстар. М. Ж. Жадрина, С. Д. Мұқанова- Алматы 2004 ж
7. Жұмыс бойынша кеңес берулер (бөлімдер бойынша)
Бөлімдер
Тапсырманы
бердім(қолы)
Тапсырманы
алдым(қолы)
II-бөлім
III-бөлім
Қорытынды
Әдебиеттер тізімі
Алдын-ала қорғау
8. Дипломдық жұмысты( жобаның) орындау кестесі
Тапсырманы беру мерзімі «» 20___ ж.
Ғылыми жетекші, т. ғ. к., Төлешова к. Т.
Тапсырманы орындауға алған студент: Міралиева М. Ә.
МАЗМҰНЫ
Кіріспе . . . 7
1. Теориялық бөлім . 9
1. 1 Тыңайтқыштардан бастап N, Р, As, Sb, Bi элементтеріне дейін . . . 9
1. 2 V топтың элементтерінің жалпы сипаттамасы . . . 20
2. Әдістемелік бөлім . . . 27
2. 1 «Азот топшасы» тақырыбы бойынша сабақтарды өту әдістемесі . . . 27
2. 2 VA топша элементтерін ойындық әдіспен оқыту әдістемесі . . . 27
2. 3 Азот және фосфор элементтерін тірек-сызбалар негізінде оқыту . . . 35
2. 4 «Азот топшасы» тарауын қорытындылау сабақтарында жаңа
технология элементтерін қолдану . . . 39
3. Эксперименттік бөлім . . . 45
3. 1 Орта мектептің 8 сыныбында «Vа топша - азот топшасы» тақырыбын
тірек-конспектілер бойынша өтуге арналған сабақ жасалымы . . . 45
3. 2 8 сынып химия пәні курсының оқу үрдісінде «Азот топшасы»
тақырыбын жаңаша технологиямен өтудің нәтижелерін есептеу . . . 61
Қорытынды . . . 63
Пайдаланылған әдебиеттер тізімі . . . 64
Кіріспе
Қазіргі таңда оқушылардың білім, білік, дағдыларын қалыптастырып, оқуға деген қызығушылықтарын арттыру мұғалімдер алдында тұрған аса жауапты міндеттердің бірі. Өмір талабы - оқу үрдісін тиімді педагогикалық технологияларды қолданып, қарқынды әдіспен ұйымдастыру, яғни шектеулі уакыт ішінде сабақ үстіндегі жұмыс өнімділігін арттыру.
М. Қ. Кұрманалиев "Педагогикалық технология - оқу үрдісін ұйымдастыру тәсілдерінің жиынтығы немесе мұғалімінің нақты ic-әрекетіне байланысты және алдына қойған мақсаттарына жетуге бағытталған белгілі ретпен орындалатын ic-шаралар. Педагогикалық технология оқытудың арнайы формаларын, әдістері мен тәсілдерін айкындайтын педагогикалық нұсқаулардың жиынтығы", - деген [1-4] .
Бұл орайда пән мұғалімдері сабақты өткізудің әдіс-тәсілдерін жаңартып, көрнекті техникалық құралдармен, қосымша материалдармен байытып отыруы керек [5, 6] .
Осыған орай, бейметалдарға жататын V-топ элементтерін, яғни «Азот топшасы» тақырыбын өту оқушылардың химия курсының маңызды теориялық мәселелерін және Д. И. Менделеевтің химиялық элементтерінің периодтық жүйесі, периодтық заң, атом құрылысы, химиялық байланыс, химиялық реакциялардың жүру заңдылықтары, электролиттік диссоциация, тотығу-тотықсыздану реакциялары секілді фактілік оқу материалдарын білуге негізделген. Сондықтан тақырыптың оқу материалының үлкен бөлігі дедуктивті түрде өтілуі мүмкін.
Зерттеу мақсаты: оқушыларда тиімді педагогикалық әдістеме арқылы оларда іргелі теориялық химиялық білім негізін қалыптастыру мақсатында ұсынылған әдістемені жасау, оны негіздеу және эксперименттік тексеруден өткізу.
Зерттеу нысаны: орта мектепте бейметалдарды мектеп оқушыларымен химия сабақтарын өткізу үрдісі.
Зерттеу міндеттері:
1. «V топша - азот топшасы элементтері» туралы жалпы мәліметтерды қарастырып, олардың қасиеттері мен сипаттамаларын мазмұндау.
2. Ұсынылушы тірек-конспекті әдісінің мәнін, маңызы мен ерекшеліктерін қарастыру.
2. Инновациялық әдіс ретінде тірек-конспекті әдістемесін оқу үрдісіне енгізу арқылы оның тиімділігін анықтау, оқушылардың білімді игеру деңгейіне тигізер ықпалын зерттеу;
4. Педагогикалық салыстырмалы (бақылау және эксперименттік) зерттеу арқылы сапалық және сандық оң көрсеткіштерге қол жеткізу, әрі осы әдістеме бойынша ұсыныстар беру.
Зерттеу базасы: Шымкент қаласындағы А. Байтұрсынов атындағы № 64 мектеп-гимназиясында өтті. Зерттеу эксперимент жұмыстарына мектеп оқушылары қатысты.
Зерттеудің ғылыми жаңашылдығы мен теориялық маңыздылығы келесі жұмыстармен негізделеді:
- ұсынылған әдістеменің білім мен машықты арттырудағы маңызы анықталды;
- мектеп оқушыларының химия бойынша үлгерімділік деңгейіне тірек-конспекті негізінде оқыту әдісінің тиімділік жағдайлары зерттелді;
- «V топша элементтері» бойынша тірек-конспекті үлгісі ұсынылып, оның құрылымы мен дидактикалық маңызы көрсетілді, іс-тәжірибелік тиімділігі дәлелденді.
Жұмыстың құрылымы мен көлемі
Дипломдық жұмыс орта мекте химиядан бейметалдарды интерактивті әдістермен оқыту әдістемесі. V-топтың беәметалдарға жататын элементтерін оқытуда инновациялық технологияларды пайдалану бойынша әдістемелік ұсыныстар жасауға және оларды тиімділігін байқау мақсатында орта мектептегі оқу үрдісінде сынауға арналған.
Жұмыс көлемі 2 суретті, 4 кестені, қорытынды мен 58 пайдаланылған әдебиеттер тізімін қамтитын 64 баспалық беттен тұрады.
1. Теориялық бөлім
1. 1 Тыңайтқыштардан бастап N, Р, As, Sb, Bi элементтеріне дейін
Селитра - табиғи натрий және калий нитраты. Қытайда жаңа дәуірдің алғашқы ғасырларында-ақ белгілі болған, оны оқ-дәрі және от-шашу дайындау үшін қолданған. Кейіннен ол еуропа алхимиктерінің еңбектерінде кездеседі (латынша аты - nitro немесе sal nitri) . Алхимиктер селитраны темір купоросымен - темір (ІІ) сульфатының гептагидратымен қосып қыздыру арқылы ұзақ уақыт бойы латынша aqua fortis («ащы су», орысша «ащы арақ») деп аталатын азот қышқылын алды:
4HNO 3 + 2(FeSО 4 ·7H 2 О) →Fe 2 О 3 +2К 2 SO 4 +2HNO 3 +2NO 2 ↑+13H 2 O
Таза азот қышқылын ең алғаш неміс химигі Иоганн Рудольф Глаубер селитраға купорос майымен (концентрлі күкірт қышқылымен) әсер ету арқылы алған болатын:
KNO 3 +H 2 SO 4 (конц) →KHSO 4 +HNO 3
Осы ғалым азот қышқылы поташпен KNO 3 әрекеттескенде таза калий селитрасы түзілетіндігін тапты. Бұл ашылудың маңызы өте зор болды, себебі, оқ-дәрі шығаруға қажетті селитраны Еуропа Шығыстан таситын, сондай-ақ ат қоралардың қабырғаларындағы тұзды қақтан немесе микроағзалардың әсерінен құрамында азоты бар органикалық заттардың соңғы өнімі ретінде түзілетін селитралы шұңқырлардан алатын [7] .
Ертадегі алхимиктер селитра NaNO 3 , темір купоросы FeSO 4 ·7H 2 O, алюмокалий ашудасы KАl(SO 4 ) 2 ·H 2 O және мүсәтір NH 4 Cl қосып қыздыру арқылы «металдардың патшасы» - алтынды еріте алатын сұйық алды. Сондықтан оны aqua regia, яғни «патша суы» немесе «патша арағы» деп атады.
Патша арағы - үш көлем тұз қышқылы мен бір көлем азот қышқылын араластырғанда түзілетін сары түсті сұйықтық. Патша арағында платина секілді қиын еритін металл да оңай ериді:
3Pt+18HCl+4HNO 3 =3H 2 [PtCl 6 ] +4NO↑+8H 2 O
Патша арағының жоғары тотықтырғыш қабілеті күшті тотықтырғыш - атомдық хлор мен нитрозил хлориді NOCl түзіле жүретін қайтымды реакцияға негізделген:
HNO 3 +3HCl=2[Cl] +2H 2 O+NOCl
Соңғы өнім сұйықтыққа сары және сарғылт түс береді.
Азотты XVIII ғасырда бір-біріне қатыссыз түрде бірнеше ғалым ашты. Ағылшын зерттеушісі Генри Кавендиш ауаны бірнеше рет қатты қызған көмірдің үстінен өткізіп (осылайша оттегі бөлінген), содан соң түзілген көмірқышқыл газын сіңіру үшін сілті ертіндісі арқылы өткізгенде түзілген жаңа газды тыныс алуға жарамайтын болғандықтан «тұншықтырғыш газ» (азот) деп атады. Тәжірибенің нәтижесі мерзімінде жарияланбағандықтан азотты ашу иелігі ағылшынның басқа ғалымына бұйырды [8] .
Кавендиштің отандасы Джозеф Пристли (1733-1804) майшамның жабық ыдыста жануын бақылау арқылы жану мен тыныс алуды қолдамайтын газдың түзілгендігін сипаттады.
Ең соңында ағьшшынның тағы бір ғалымы Даниэль Резерфорд (1749-1819) азотты ауадан алды. Кавендиш пен Пристлиден айырмашылығы, ол өзінің бөліп алған «тұншықтырғыш ауасының» алыну жолы мен қасиеттерін сипаттап, 1772 жылы жариялады. Сондықтан да азотты ашқан Резерфорд болып саналады. Бұл мысалдар ғылым тарихында мынадай жағдайды еске салады: кім зерттеу еңбегінің нәтижесін бірінші жарияласа, ашылу құрметі сол ғалымға тиесілі болады.
Табиғатта азот көп мөлшерде ауада байланыспаған түрде кездеседі. Атмосфералық ауаның негізгі құрамын анықтаған А. Л. Лавуазьенің ұсынысымен жана элемент «азот» деп аталды. Бұл атау гректің «зое» «Tipшілік» және «а» деген қосымша («не») «тіршіліксіз», «өмір бермейтін» дегенді білдіреді. Азоттың латынша «nirogenium» атауы «селитра түзуші (туғызушы) ».
Азот - иіссіз, түссіз және дәмі жоқ, суда аз еритін газ (t бқ = -210°С қн , -196°С) . Бос азот молекуладағы байланыстың бepiктігіне байланысты химиялық инертті. Сондықтан азот химиялық реакцияға қиын түседі, жануды және тыныс алуды қолдамайды. Адам ағзасында орташа 1, 8 кг азот болады.
Аммиак
Бұл иісін бip иіскесең өмір бойы ұмытылмастай есіңде қалатын "аромат". Құтының аузын ашсаң болғаны өткір иіс бірден бөлменің ішін алып кетеді. "Аммиак" cөзі мүсәтірдің NН 4 С1 бұрынғы ecкi атауы sal ammoniac дегеннен шыққан. Оны Амон құдайына табынатын жерге жақын Ливиядан өндірген.
Мүсәтір спирті - бұл аммиактың сулы ертіндісі. Қалыпты жағдайда аммиак - түссіз газ, сұйықтыққа тез айналатын (t бқ =-78°C, t қн =-33°C), суда жақсы еритін: 20°С температурада 702 л аммиак epice, О°С температурада - 1176 л аммиак ериді екен. Мұндай өте жоғары epiгіштік су мен аммиак молекулаларының арасында берік сутектік байланыстың түзілуімен түсіндіріледі.
Аммиактың молекуласы үшбұрышты пирамида пішінді, ішкі жағында азот атомы, ал төрт бұрышында - үш атом сутегі және бip электронды жұп орналасқан. Аммиак молекуласындағы H-N-H бұрышы (107, 8°) тетраэдрге жакын. Cyтeгi ионы Н + қосылғанда, ол аммоний катионына NH 4 + айналады да пішіні дұрыс тетраэдрга келеді.
Құрамында аммиак бар ертінді сілтілік орта көрсетеді, оған ертіндіге фенолфталеин қосу арқылы оңай көз жеткізуге болады. Бipaқ натрий гидроксидімен салыстырғанда әлсіз негіз болып табылады.
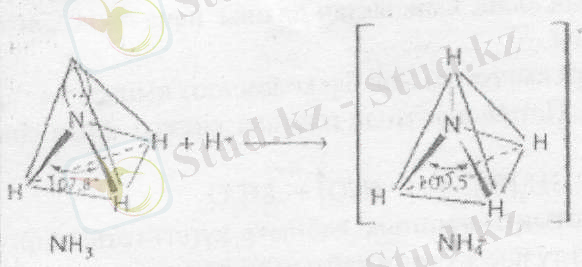
Аммиак - күшті тотықсыздандырғыш. Оттегінде ол бос азотқа дейін тотығып, жанады (4NH 3 +3О 2 =2N 2 +6Н 2 О), ал платина катализатор болғанда NО-ға айналады:
4NH 3 +5О 2 →Pt→4NO+ 6Н 2 О
Сулы ертіндіде аммиак бромды бромид-ионға дейін оңай тотықсыздандырады:
8NH 3 +3Br 2 =6NH 4 Br+N 2
Құрғақ аммиак немесе аммоний галогенидтері хлормен, броммен немесе йодпен әрекеттескенде тұрақсыз қосылыс - азот галогенидтері түзіледі: NH 3 , NBr 3 , NІ 3 ·nNH 3 . Йодты азоттың қара ұнтағы кішкентай жанасудан-ақ атылады.
Көп мөлшерде (50 мл/м 3 бастап) аммиак улы. Егер мүсәтір спирті шашқанда көзге тиіп кетсе, тез арада өте көп мөлшердегі сумен жуу керек.
Зымырандарға қандай жағармай қолданады?
Аммиактан өзге азоттың бірнеше сутекті қосылысы белгілі. Соның бipi - аммиактың иісі бар, түссіз сұйықтық - гидразин N 2 H 4 (t бқ =2°C, t қн =114°С) . Гидразиннің молекуласы бip байланыспен қосылған элемент - элемент (бұл жағдайда N-N) екі бірдей үзіндіден тұратындықтан сутегінің аскын тотығын еске түсіреді. Аммиак сияқты гидразин де күшті тотықсыздандырғыш болып табылады, негіздердің қасиетін көрсетеді, мысалы, гидрозоний тұздары белгілі ([N 2 H 5 ] + C1) . Аммиактан айырмашылығы - гидразин ауада өте көп мөлшерде жылу бөліп оңай жанады. Осы қасиетіне байланысты гидразиннің органикалық туындалары, соның ішінде 1, 1-диметилгидразин-гептил (СН 3 ) N-NH 2 көп қолданылады) зымыранға жағармай ретінде қолданылады [9, 10] .
Гидроксид ионы бар ма?!
Аммиактың судағы ертіндісі онда аз мөлшерде болса да гидроксид-иондары болғандықтан (натрий және калий гироксидімен салыстырғанда) әлсіз негіз саналады. Бұрын ертіндідегі гидроксид-ионньң аз мөлшерін аммиак сумен әрекеттескенде негіздік қасиет көрсететін аммоний гидроксидінің түзілуімен ттүсіндіртеін:
NH 3 +Н 2 О=[NH 4 OH] NH 4 + +ОН -
Бірақ зерттеулер көрсеткендей, мұндай қосылыс ертінді түрінде де, қатты күйінде де болмайды екен. Судағы ертіндісінде аммиак негізінен тек аз ғана мөлшері иондарға ыдырайтын гидрат күйінде NH 3 ·nН 2 О болады екен. Бірақ төмен температурада аммиак қатты гидрат түзеді: NH 3 ·Н 2 О t бқ =-79 0 С (құрамы болжамды негіз NH 4 OH сияқты) .
Азот оксидтері
Азот мүмкін болатын тотығу дәрежелеріне сәйкес көп оксидтер түзетін элементтердің бірі. Әр тотығу дәрежесіндегі оксидтердің әрқайсысының өзіндік қасиеттері бар.
Азот (І) оксиді «көңілдендіргіш газ» деп аталатын түссіз газ, жеңіл есірткілік әсері бар. Ол аммоний нитраты ыдырағанда түзіледі:
NH 4 NO 3 →N 2 О+2Н 2 О
Бұл қосылыс әлсіз тотықтырғыш қасиет көрсетеді: сөніп бара жатқан сәуле оттегіндегідей от алады.
Азот (ІІ) оксиді NO N 2 O секілді сілтілермен әрекеттеспейді, ешқашан тұз түзбейді. Бірақ NO (t бқ =-164 0 С, t қн =-152°С) түссіз, суда аз еритін газ. Оны әдетте мысқа сұйытылған азот қышқылымен әсер ету арқылы алады. Ол ауада қоңыр түсті азот (IV) оксидіне дейін оңай тотығады. Суытқанда NО 2 молекуласы димерленеді де, газ N 2 О молекуласынан тұратын сары-қоңыр түсті сұйықтыққа айналады. Димерлі молекулалар N 2 O 4 газтәрізді NO 2 құрамында 140 0 С болады, температура жоғарылауымен олардың үлесі азая түседі.
Бірдей көлемдегі NO мен NO 2 әрекеттесуінен түзілетін азот (ІІІ) оксиді N 2 O 3 ашық көк түсті әдемі сұйықтық (t бқ =+101 0 С, -40 0 С төмен градуста температураға тұрақты) . Бұл оксид сумен қосылып, көк түсті әлсіз азотты қышқыл түзеді. Оның тұздары нитриттер органикалық өндірісінде, сондай-ақ тамақ өнеркәсібінде, мысалы етті өңдеуде қолданылады. Аз мөлшерде натрий нитритімен өңделген ет ұзақ уақытқа дейін өзінің бастапқы түсін сақтайды. Нитрит бұлшықет ұлпасындағы миоглобин ақуызымен әрекеттесіп, қан-қызыл қосылыс түзеді. Ал нитриттердің көп мөлшері улы болады. Бала үшін натрий нитритінің өлімге әкелетін мөлшері - 0, 18 г.
Азот (V) оксиді N 2 O 5 - NО 2 + және NО 3 - иондарынан түзілетін ақ түсті кристалдық зат. Оны зертханалық практикада сирек қолданады. Ал оның азот қышқылы кез-келген кедей деген зертхананың өзінен табылатын ең қажетті реактив.
Қышқылдардың патшасы
Түссіз, ешнәрсемен ерекшеленбейтін осы бір сұйықтықтың қаншалықты күшті екендігін бірден түсіну қиын. Азот қышқылының күшті тотықтырғыш екендігі сондай, ол кейбір органикалық заттар (скипидар) онымен жанасқан сәте-ақ тұтанып кетеді.
Сусыз азот қышқылы НNO 3 (t қн =83 0 С) түссіз, өткір иісті ұшқыш сұйықтық, ұшқыштығына байланысты оны «түтіндегіш» деп атаған. Зертханада оны Глаубер әдісімен алады - селитраға концентрлі күкірт қышқылымен әсер ету арқылы алады
Азот қышқылы күшті - ол суда иондарға толық ыдырайды. Іс-тәжірибеде концентрлі азот қышқылы деп аталатын 68% epiтіндісі қолданылады.
Азот қышқылын минералды тыңайтқыштар өндірісінде, дәрі-дәрмек өнеркәсібінде, жарылғыш заттар өндіруде, сондай-ақ зертханада тотықтырғыш ретінде қолданады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz