Орта мектепте химиялық реакция жылдамдығы мен катализ тақырыбының қолданбалы-әдістемелік негіздері


Кіріспе
Заманауи жағдайларда мектепте химияны оқыту әдістемесінің ең өзекті мәселелерінің бірі - пәндік білімнің практикалық бағдарлануын қамтамасыз ету болып табылады. Бұл зерттелуші теориялық қағидалар, өмір практикасы мен қолданбалы сипаттағы химиялық білімді демонстрациялау арасындағы тығыз өзарабайланысты анықтау қажеттігін білдіреді.
Оқушылардың танымдық қызығушылығын сақтау үшін олардың көздерін химиялық білімнің қосарлы табиғатына жеткізіп, оқу материалын меңгерудегі тұлғалық қажеттілікті қалыптастыру қажет. Бұған құрамында өзіндік бақылау сұрақтарынан басқа, тұрмысқа пайдалы қолданбалы сипаттағы ақпараты бар арнайы құрылған тапсырмалар жол ашуы мүмкін [1] .
Осыған байланысты, магистрлік жұмыс тақырыбы - орта мектепте химия сабақтарында «Химиялық реакция жылдамдығы және катализ» тақырыбының қолданбалы аспектілерін зерттеу барынша өзекті болып табылады .
Зерттеудің ғылыми жаңашылдығы химиядан жеке тақырып, нақтылап айтқанда «Химиялық реакция жылдамдығы және катализ» тақырыбы бойынша сабақты өтудің тиімді әдістемелік жасалымының алғаш рет ұсынылып, оның оқу үрдісінде практикалық сыналуымен ерекшеленеді.
Ғылыми жұмыстың мақсаты - химиялық реакция жылдамдығы және катализ теориясының орта мектеп курсында орны мен маңызын анықтау және қазіргі заманға сай әдістемелік нұсқауларды құру.
Осы мақсатты орындау үшін мынадай міндеттер көзделіп отыр:
- химиялық кинетика және катализ ұғымы мен осыған байланысты ережелер туралы мәліметтер жинақтау, оларды тереңірек зерттеу және мәндерін ашу;
- мектеп химия курсындағы химиялық реакциялардың жүру заңдылықтары, реакция жылдамдығы және химиялық тепе-теңдік тақырыпшалары бойынша сабақ (дәстүрлі, сарамандық және зертханалық) түрлерінің әдістемелік жасалымдарын жасау және оларды ұсыну;
- «Химиялық реакциялардың жүру заңдылықтары» тақырыбында технологиялық үрдіс мысалында құбылыстар мен өзгерістер мәнін ашу, осыған сай оқушылар білімін бағалау тесттерін ұсыну;
- Ұсынылған тақырып бойынша әдістемелік сабақтың енгізілу нәтижесіндегі тиімділігін анықтау және ұсыныстар беру.
1 Әдеби шолу. Химиялық кинетика және катализ ұғымдары
Химиялық кинетика - химиялық реакциялардың жылдамдығы мен механизмдеріне түрлі факторлар әсерін зерттейтін физикалық химияның бөлігі.
Химиялық реакция мехнизмі ретінде бастапқы заттардың реакция өнімдеріне айналуы кезінде жүретін аралық реакциялар түсіндіріледі.
Химиялық кинетаиканың негізгі ұғымы болып химиялық реакция жылдамдығы түсінігі табылады. Реакция жүретін жүйеге байланысты «реакция жылдамдығы » ұғымы біршама ерекшеленеді.
Гомогендік химиялық реакциялар деп әрекеттесуші заттар бір фазада болатын реакцияларды айтады. Бұл газтектес заттар арасындағы немесе сулы ертінділердегі реакциялар болуы мүмкін. Мұндай реакциялар үшін орташа жылдамдық (уақыт бірлігінде әрекеттесуші заттардың біреуінің концентрациясының өзгерісіне тең) :
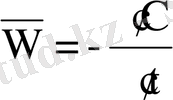
Химиялық реакцияның мезеттік немесе шынайы жылдамдығы келесіге тең:
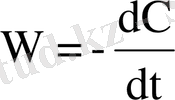
Теңдеудің оң жақ бөлігіндегі теріс таңба бастапқы зат концентрациясының кеміп жатқандығын көресетді. Демек, гомогенді химиялық реакция жылдамдығы дегеніміз - уақыт бойынша бастапқы заттардың туынды концентрациялары.
Гетерогенді реакция дагеніміз әрекеттесуші заттар түрлі фазада болатын реакция. Гетерогенді реакцияларға түрлі агрегаттық күйде болатын заттар арасындағы реакциялар жатады.
Гетерогенді химиялық реакция жылдамдығы уақыт бірлігінде фазалар бөлінісі бетінің аудан бірлігіндегі кез-келген бастапқы зат мөлшерінің өзгерісіне тең:
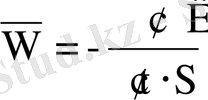
Химиялық реакцияның кинетикалық теңдеуі деп зат концентрацияларымен реакция жылдамдығын байланыстыратын математикалық формуланы айтады. Бұл теңдеу тек эксперименттік жолмен ғана анықталуы мүмкін.
Механизмге байланысты барлық химиялық реакциялар жай және күрделі болып жіктеледі. Жай реакциялар деп теңдеудің сол жақ бөлігінде жазылған молекулалардың бірмезгілде соқтығысуы есебінен бір сатыда орын алатын реакцияларды айтамыз. Жай реакцияларға бір, екі немесе кейде сирек те болса үш молекула қатысуы мүмкін. Сондықтан жай реакцияларды мономолекулалық, димолекулалық және тримолекулалық реакциялар деп жіктейді. Ықтималдық теориясы тұрғысынан бірмезгілде төрт және одан да көп молекуланың бірмезгілде соқтығысуы өте қиын болғандықтан, тримолекулалықтан жоғары реакциялар кездеспейді. Жай реакциялар үшін кинетикалық теңдеулер салыстырмалы түрде қарапайым. Мысалы, H 2 +I 2 =2HI реакциясы үшін кинетикалық теңдеу келесі түрге ие:
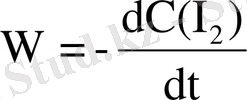 . 3 = k ∙ C(I
2
) ∙ C(H
2
)
. 3 = k ∙ C(I
2
) ∙ C(H
2
)
Күрделі реакциялар бірнеше сатыда жүріп, мұндағы барлық сатылар өзара байланысты болады. Сондықтан күрделі реакциялардың кинетикалық теңдеулері жай реакцияларға қарағанда біршама үлкен болады. Мысалы, күрделі H 2 +Br 2 =2HBr реакциясы үшін келесі белгілі:
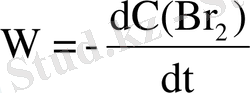 . 3 =
. 3 =
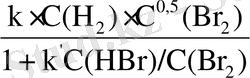 . 3
. 3
Кинетикалық теңдеудің күрделілігі реакция механизмінің күрделілігімен тікелей байланысты.
Химиялық кинетиканың негізгі заңы эксперименттік мәліметтердің көптеген санынан шығатын және реакция жылдамдығының концентрацияға тәуелділігін өрнектейтін постулат болып табылады. Бұл заң әрекеттесуші массалар заңы деп аталады. Ол әрбір уақыт мезетіндегі химиялық реакция жылдамдығының біршама дәрежеге келтірілген әрекеттесуші заттар концентрацияларына пропорционалды екендігін көрсетеді.
Егер химиялық реакция теңдеуі келесі түрге ие болса:
a A + b B + d D → өнімдер,
онда әрекеттесуші массалар заңының формуласын келесі түрде жазуға болады:
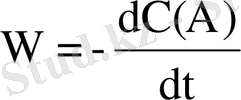 = k ∙
= k ∙
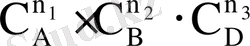 .
.
Бұл теңдеудегі k - химиялық реакция жылдамдығының константасы - концентрацияға емес, температураға тәуелді реакцияның маңызды сипаттамасы. Егер барлық заттар концентрациясы 1 моль/л-ге тең болса, онда химиялық реакция жылдамдығының константасы реакция жылдамдығына тең. n 1 , n 2 , n 3 дәрежелік көрсеткіштері А, В және D заттары бойынша химиялық реакцияның жекелеген реттері деп аталады. Жай реакциялар үшін жекелеген реттер - нөлден үшке дейінгі кішігірім бүтін сандар. Күрделі реакциялар үшін жекелеген реттер бөлшектік те, теріс сандар да болуы мүмкін. Жекелеген реттер қосындысы химиялық реацияның n = n 1 + n 2 + n 3 реті деп аталады. Осылайша, химиялық реакция реті дегеніміз кинетикалық теңдеудегі концентрация дәрежелері көрсеткіштерінің қосындысы.
Катализ - өздері реагенттермен әрекеттеспей, химиялық реакция соңында өзгеріссіз қалатын, катализаторлар деп аталатын заттардың қатысындағы химиялық реакция жылдамыдығының өзгерісі.
Барлық маңызды өнеркәсіптік үрдістер катализаторлар қатысында жүзеге асады. Жануарлар мен өсімдік жүйелерінде катализдік реакциялардың ауқымды мөлшері жүріп жатады. Катализаторлар әсерінен бұл кездегі жылдамдық миллион есе артуы мүмкін.
Катализдік реакциялардың ортақ қасиеттері:
1. Реакцияға катализатрдың қатысуы оның химиялық теңдеуінде көрініс бермейді. Дегенмен реакция жылдамдығы катализатор мөлшеріне пропорционал.
2. Катализатор спецификалық әсерге ие. Ол бір реакция жылдамдығын өзгертсе, ал екіншісіне әсер етпеуі де мүмкін.
3. Катализатор химиялық тепе-теңдікті ығыстырмайды, өйткені ол тура және кері реакция жылдамдықтарын бірдей шамада өзгертеді.
4. Кейбір заттар (промоторлар) катализаторлар әсерін күшейтсе, ал кейбіреулері (улар) - әлсіретеді.
Оң және теріс катализ деп бөлінеді. Оң катализді жай ғана катализ десе, ал терісін - басытқылау (ингибирлеу) деп атайды.
Катализ гомогенді және гетерогенді болып та бөлінеді. Гомогенді катализ катализатор мен реагенттер бірдей фазада болған жағдайда байқалады. Гомогендік катализге мысал болып қышқылдар немесе сілтілер қатысындағы сулы ертінділердегі реакциялар табылады.
Гетерогенді катализ кезінде катализатор мен әрекеттесуші заттар түрлі фазада болады. Катализдік реакциялардың басым бөлігі қатты катализатордағы гетерогендік жүйелерде жүреді.
Катализатордың әсер теу механизмін келесі сызбамен көрсетуге болады:
1. А + В = АВ (катализаторсыз) ;
2.
а) А + К = АК;
б) АК + В = АВ + К (катализатормен) .
Катализатордың алғашында заттардың біреуімен тұрақсыз байланысып, ал кейін екінші реагенттің оны осы қосылыстан ығыстырып шығаратындығы көрініп тұр.
Қазіргі кездегі катализаторлардың химиялық реакция жылдамдығына әсері туралы түсінік катализатордың активтендіру энергиясын ұлғайтса және (немесе) химиялық реакцияның активтендіру энергиясын арттырса, реакция жылдамдығының да артатындығын түсіндіреді.
1. 1 Химиялық реакция жылдамдығына температураның әсері
Көптеген химиялық реакциялар жылдамдығының температура жоғарылауымен артатындығы белгілі. Реакция жылдамдығына температураның сандық әсерін екі жолмен есептеуге болады.
Салыстырмалы төмен температуралар кезінде ертінділерде жүретін реакциялар үшін Вант-Гоффтың эмпирикалық ережесін қоладнуға болады: температураны әрбір 10 о С-қа жоғарылатқан кезде реакция жылдамдығы 2-4 есе артады.
Реакция жылдамдығына температураның нақты, әрі ғылыми негізделген әсерін негізін швед ғалымы С. Аррениус ұсынған активті соқтығысулар теориясы суреттейді. Бұл теорияның мәні оның үш қағидасында көрсетілген: «Химиялық реакциялардың жүру заңдылықтар» тақырыбында технологиялық үрдіс мысалында құбылыстар мен өзгерістер мәнін ашу, осыған сай оқушылар білімін бағалау тесттерін ұсыну;
- Ұсынылған тақырып бойынша әдістемелік сабақтың енгізілу нәтижесіндегі тиімділігін анықтау және ұсыныстар беру.
1. Молекулалар әрекеттесуі үшін олар соқтығысулар тиіс.
2. Бөлшектер соқтығысулары шынымен де химиялық айналуға алып келуі үшін, соқтығысушы молекулалардың артықша энергиялары активтендіру энергиясынан (Е а ) асуы тиіс, яғни реагент молекулалары бір потенциалдық кедергіні жеңуі қажет.
Химиялық реакцияның активтендіру энергиясы деп әрекеттесуі үшін соқтығысу сәтінде молекулалар иеленуі тиіс артықша энергияны айтады.
Активтендіру энергиясымен салыстырғанда артықша энергияға ие молекулалар активті молекулалар деп аталады. Активті молекулалар үлесіне байланысты реакция жылдамдығы жоғары немесе төмен болуы мүмкін. Реакция жылдамдығы константасының температура мен активтендіру энергиясына тәуелділігін Аррениус теңдеуі суреттейді:
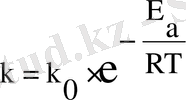
Мұндағы k 0 - экспоненциалалды көбейткіш - тұрақты шама.
Химиялық кинетика мәселерінің бірі болып эксперименттік мәліметтер бойынша k 0 және Е а мәндерін табу табылады. Мысал ретінде келесі реакция үшін осы шамалар мәндерін табу әдістемесін қарастырайық:
С 12 Н 22 О 11 + Н 2 О → С 6 Н 12 О 6 + С 6 Н 12 О
Сахароза Глюкоза Фруктоза
Бұл рекцияның кинетикасы түрлі температуралар кезінде 1, 45 моль/л концентрациялы күкірт қышқылы қатысында зерттелді. Эксперименттік мәліметтер бойынша ln k - 1/T тәуелділік графигі тұрғызылады. Аррениус теңдеуінен шығатыны - бұл сызықты тәуелділік (1 сурет) . Тура теңдеу табылып, оны Аррениустың логарифмделген теңдеуімен салыстыра отырып:
ln k = ln k
0
-
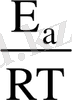 . 3
. 3
ізделінді шаманы аламыз:
E a = 12064∙R = 12064∙8, 314 = 100300 Дж/моль,
k 0 = e 36, 729 = 8, 94 ∙ 10 15
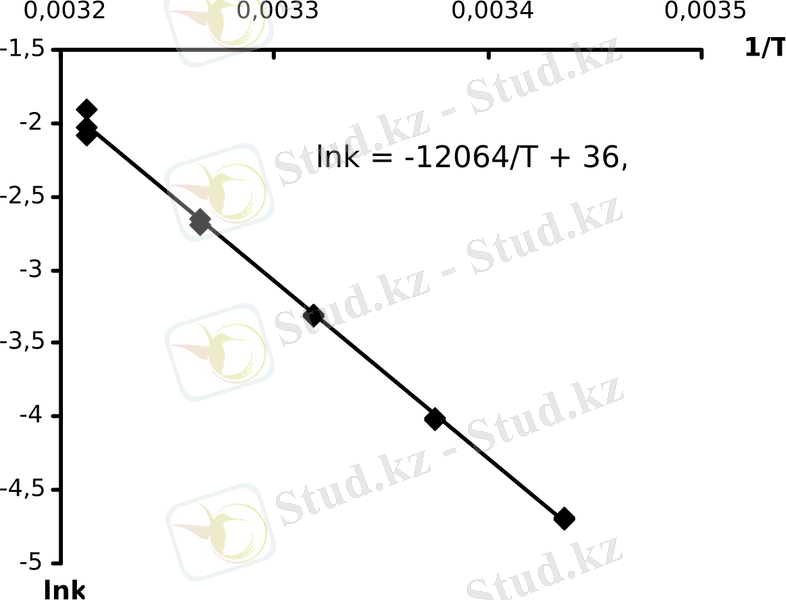
1 сурет - Аррениус теңдеуінің коэффициенттерін табу
Кейбір, әсіресе органикалық химиядағы химиялық реакциялар үшін реакция жылдамдығы, тіпті активті молекулалардың жоғары үлесі кезінде де төмен болды. Активті соқтығысулар теориясы мұны молекулалардың соқтығысу ерекшеліктерімен түсіндіреді.
3. Соқтығысар алдында молекулалар бір-біріне салыстырмалы түрде бағдарлануы тиіс.
Салыстырмалы бағдарланудың қажетті нұсқасы реакцияға алып келеді, ал қарама-қарсы жағдайда әрекеттесу болмайды. Термодинамикадан жүйедегі ретсіздікті (молекулалар қозғалысын) сипаттайтын функция белгілі - бұл энтропия. Аррениус теңдеуі теориясының үшінші қағидасына сай келесіні аламыз:
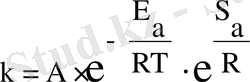
Бұл теңдеудегі S a - химиялық реакцияның активтендіру энергиясы. Активтендіру энтропиясы, активтендіру энергиясы секілді эксперименттік мәліметтерден табылады.
1. 2 Гомогенді және гетерогенді реакциялар. Вант-Гофф ережесі
Бір фаза бойында жүретін химиялық реакция гомогенді химиялық реакция деп аталады.
Фазалар бөлінісі шекарасында жүретін химиялық реакция гетерогенді химиялық реакция деп аталады.
Гомогенді реакцияларға мысал болып ертіндідегі кез-келген реакция табылады.
Гетерогенді реакцияға мысал болып қатты катализатор бетінде жүретін реакциялардың кез-келгені табылады (гетерогенді катализдік реакция) .
Аррениус теңдеуінен ерекшелігі реакция жылдамдығы константасының температураға қатаң тәуелділігін эмпирикалық сипатқа ие Вант-Гофф ережесі береді. 1884 жылы Вант-Гофф температураны 10 градусқа арттырған кезде көптеген реакциялар жылдамдығының 2-4 есе артатындығын анықтады. Бұл тәуелділік математикалық түрде келесі қатынаспен өрнектеледі:
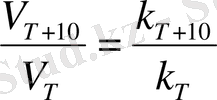 Equation. 3 = γ, (1)
Equation. 3 = γ, (1)
мұндағы: V T және k T - Т температура кезіндегі сәйкесінше реакция жылдамдығы мен оның константасы; V Т + 10 және k Т + 10 - (Т+10) кезіндегі сол шамалар, γ= 2÷4 - реакция жылдамдығының температуралық коэффициенті. Жалпы жағдайда, егер температура ∆Т = Т 2 - Т 1 градусқа өзгерсе, (1) теңдеу келесі түрге енеді:
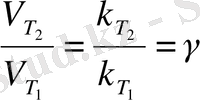 Equation. 3
∆Т/10
(2)
Equation. 3
∆Т/10
(2)
Вант-Гофф ережесін реакция бөлме температурасына жақын температура кезінде жүргізген уақытта Вант-Гофф ережесін қолдануға болады. Температураның жоғарылауымен γ кеміп, өте жоғары температуралар кезінде көптеген реакциялар үшін тіпті бірден де кем болуы мүмкін, яғни температура жоғарылауы реакция жылдамдығын арттырмай, қайта кемітуі мүмкін.
Ферменттік үрдістер, әсіресе, ақуыздардың денатурациялану үрдістері температуралық коэфффициенттердің біршама жоғары мәндерімен (7-10) сипатталады. Мұндай жағдайлар кезінде 10 0 -дегі аралық барынша кең болып, алынған коэффициенттерден соң сол үрдіс механизміндегі болған өзгерістер байқалмай қалуы мүмкін. Мұның алдын-алу үшін біршама тар температуралар аралығын (2 0 , 3 0 , 5 0 ) алып, алынған нәтижелерді төмендегі формула бойынша γ 10 шамасына келтіру ұсынылады:
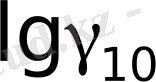 = 10
= 10
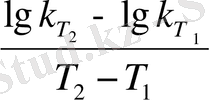 (3)
(3)
Өмірлік үрдістердің барлығы шегінен шыққанда өлім орын алатын тар температуралық аралықта жүреді. Негізінен бұл - 0 0 С-тан 45-50 0 С-қа дейінгі аралықтағы температуралар.
Биологиялық үрдістер жылдамдығының температураға тәуелділік қисығы үш нүктеге ие: минимум, оптимум және максимум. Минимумнан оптимумға дейін үрдістер қарқындылығы артады. Жануарлардағы температуралық оптимум 35-40 0 С шамасында ауытқыса, ал өсімдіктерде ол жоғары болады. Оптимумнан максимумға дейінгі аралық үрдістердің жүру жылдамдықтарының кемуімен сипатталады. Тіршіліктің температуралық шекаралары ақуыздардың денатурациялық өзгерістерімен және ферменттердің инактивтелуімен себептендіріледі.
1. 3 Катализаторлар және катализ теориясы
Катализаторлар деп химиялық реакция жылдамдығын өзгерткенімен өздерінің құрамы мен мөлшері реакция соңында өзгеріссіз қалатын заттарды айтады. Катализаторлар қатысында химиялық реакциялар жылдамдықтарының өзгерісі катализ, ал катализаторлар қатысында жүретін реакциялардың өзі катализдік деп аталады.
Катализаторлар химиялық реакциялар жылдамдығына түрліше әсер етеді: біреулері жылдамдатады - оң катализаторлар, екіншілері баяулатады - теріс катализаторлар. Катализатор қызметін реакция өнімдірінің бірі де атқаруы мүмкін, бұл жағдайда құбылыс - автокатализ деп аталады.
Егер катализатор мен әрекеттесуші заттар бірдей фазада болса, онда катализ гомогенді, ал түрлі фазада болса - гетерогенді катализ деп аталады.
Катализатор шынайы тепе-теңдікке әсер етпейді, яғни тепе-теңдік константасын және тепе-теңдік концентрациясын өзгертпейді. Ол тура және кері реакциялар жылдамдықтарын бірдей дәрежеде жылдамдатып, тек тепе-теңдіктің орнау уақытын өзгертеді.
Бөгде заттар катализаторға түрліше әсер етеді: біреулері бейтарап болса, екіншілері катализато әсерін күшейтеді; ал үшіншілері оны әлсіретеді немесе тоқтатады. Катализдік үрдістерді үдеткіштер промоторлар немесе активаторлар деп аталады. Реакция жылдамдығын төмендететін заттар басытқылар (ингибиторлар) деп аталады. Олардың бір бөлігі антиоксиданттар - органикалық заттардың тотығуын баяулататын немесе алдын-алатын, бәрінен бұрын тамақ өнімдерін бұзатын заттар болып табылады. Олар азғана мөлшерде (0, 01-0, 001%) қолданылады. Сонымен, құрамында майлары мен дәрумендері бар тамақ өнімдерінің бұзылуының алдын-алу үшін Е дәруменін, галлов қышқылының пропил және додецил эфирлерін, ионол және басқаларды қосады.
Оң катализаторлар әсері әрекеттесуші заттар жүйесіндегі активтендіру энергиясының төмендеуіне алып келеді. Катализдік реакциялар төмен активтендіру энергиясын қажет ететіндіктен, олар жоғары жылдамдықпен жүреді.
Катализаторлардың әсер ету механизмін түсіндіретін бірқатар теориялар бар. Гомогендік катализ механизмін түсіну үшін аралық қосылыстар теориясы ұсынылды. Бұл теорияның мәні, егер баяу жүретін А + В = АВ реакциясын К катализатор қатысында жүргізсе, онда катализатор бастапқы заттардың бірімен химиялық әрекеттесуге түсіп, берік емес аралық қосылыс: А + К = АК түзетіндігінен тұрады. Реакция жылдам жүреді, яғни бұл үрдістің активтендіру энергиясы аз болады. Кейін аралық АК қосылысы басқа бастапқы қосылыспен әрекеттесіп, бұл кезде катализатор босап шығады: АК + В = АВ + К. Бұл үрдістің активтендіру энергиясы да аз болғандықтан, реакция жеткілікті жылдамдықпен жүреді. Нақ осы теория көмегімен келесі реакция бойынша NO катализаторы қатысында күкіртті ангидридтің:
2SO
2
+ O
2
 2SO
3
2SO
3
немесе су буы қатысында хлорлы аммонийдің түзілуі түсіндіріледі:
NH
3
+ HCl
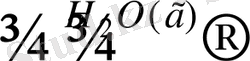 NH
4
Cl
NH
4
Cl
Кейбір реакциялар қышқылдармен және сілтілермен катализденуі мүмкін. Қышқылдар мен негіздердің протондық теориясына сай, қышқыл - бұл протонын бөліп жіберетін, ал негіз - протонды қосып алуға қабілетті қосылыс. Катализ барысында субстрат молекуласында электрондардың қайтатаралуы орын алып, активтілігі жоғары аралық қосылыстар (карбоний иондары, карбоаниондар, полярлық кешендер) түзіледі. Бұл кезде активтендіру энергиясы төмендеп, реакция жылдамдайды.
Қышқылды-негіздік катализ міндетті түрде бір молекуладан екіншісіне протонның тасымалдану сатысын қамтиды. Реакциялық ортада донорлар мен акцепторлар болуы тиіс. Егер қышқылды НА, субстратты НХ, В және А - негіз, НХН + және Х - - субстраттың иондалған формалары, ХН - реакция өнімдері деп алсақ, онда катализді келесі түрде жазуға болады:
Қышқылмен катализдену:
HX + HA ⇄ HXH + + A -
B + HXH + ⇄ BH + + XH
BH + + A - ⇄ B + HA
Негізбен катализдену:
B + HX⇄ BH + + X -
X - + HA ⇄ XH + A -
BH + + A - ⇄ B + HA
Гидроксид және сутегі иондарымен жылдамдайтын ертінділердегі гомогенді катализдік реакциялар біршама көп. Осы типтегі реакцияларға этерификация, қанттардың инверсиялану, күрделі эфирлердің сабындану және басқа да реакциялар жатады.
Күрделі эфирлердің сабындануы қышқылмен де, сілтімен де катализденеді. Соңғы жағдайда ол 2-інші реттік теңдеу бойынша жүріп, келесі теңдікпен суреттелуі мүмкін:
CH 3 COOC 2 H 5 + OH - → CH 3 COO - + C 2 H 5 OH
Гетерогендік катализ механизмін түсіндіру негізінде адсорбциялық катализ теориясы жатыр. Осы теорияға сай, әрекеттесуші заттар молекулалары активті орталықтар деп аталатын катализатор бетінде адсорбцияланады. Нәтижесінде катализатор бетінде осы заттардың жоғары концентрациясы пайда болады; бұл жекелей реакцияның жылдамдауына алып келеді. Бірақ реакция жылдамдығы артуының басты себебі болып аралық беттік қосылыстардың түзілуі салдарынан активтендіру энергиясының төмендеуі табылады.
1. 4 Ферменттер биологиялық катализаторлар ретінде
Тірі ағзалардағы химиялық үрдістер биологиялық катализаторлар - ферменттер көмегімен жүзеге асады. Қазіргі кезде белгілі ферменттер болып көпшілігі металл иондарын қамтитын ақуыздар табылады.
Ферменттер өздерінің тиімділігі бойынша химиялық катализаторлардан миллион және миллиард есе асып түседі. Реакцияның бұлайша жылдамдауы ферменттердің реакциялық жолдағы энергетикалық барьерлерді шұғыл түрде төмендетуімен байланысты. Мысалы, темір (ІІІ) ионы мен каталаза молекуласының әсерінен сутегі асқын тотығының ыдырау реакциясы үшін активтендіру энергиясы сәйкесінше 42 және 7, 1 кДж/моль, қышқылмен және уреазамен мочевинаның гидролизі үшін - сәйкесінше 103 және 28 кДж/моль болады.
Ферменттер жоғары спецификалығымен және әрекет бағыттылығымен ерекшеленеді. Сонымен, сілекей құрамында болатын амилаза молекуласы бірдей глюкозалық звенолардың үлкен санынан тұратын крахмалды оңай, әрі жылдам ыдыратады. Бірақ ол сахарозаның ыдырау үрдісін катализдемейді.
Ферменттердің катализдік әсері салыстырмалы түрде алғанда «жеңіл» жағдайларда (37 - 40 0 С температура, жоғары емес қысым мен белгілі-бір рН мәндері кезінде), орын алады, яғни әрбір фермент «оптималды технологиялық шешімдер» іздемей-ақ белгілі-бір химиялық реакцияны жүргізеді.
Ферменттер активтілігінің өзгеру салдарынан аурулар туындайды. Мысалы, ферменттік жасушалар тирозинінің меланинге айналуын катализдейтін тирозиназа ферменті активтілігінің төмендеуі нәтижесінде альбигизм ауруы пайда болады.
Ағзада түрлі ферменттер жетіспеушілігінен туындайтын ауруларды емдеудің заманауи әдістерінің бірі болып ағзаға жетіспеуші немесе өз активтілігін төмендеткен ферменттерді енгізу әдісі табылады. Дегенмен, ағзаға таза, түрлендірілмеген ферменттерді енгізу олардың жылдам бұзылуына алып келетіндіктен, қымбат тұратын осы препараттардың ауқымды мөлшері қажет. Осы мәселені шешу жолдарының бірі - ферменттердің иммобилизацияланған формаларын, яғни органикалық және бейорганикалық тасымалдағыштары бар химиялық байланыстардың алуан типтерімен байланысқан ферменттер жасау.
2 Әдістемелік бөлім
2. 1 «Химиялық реакциялар жүрісінің заңдылықтары» сабағы
Химиялық үрдістерді саналы түрде ұғыну үшін химиялық тепе-теңдік және катализ туралы түсініктің болуы ерекше маңызға ие. Бұл мәселелер тек оқушылар үшін ғана емес, сонымен қатар мұғалімдер үшін де әрқашан күрделі болып табылады. Тақырыптың оқу материалы 6 сабаққа бөлінген, мұндағы бір сабақта оқушыларды екіден артық ұғыммен таныстыруға болмайды.
Тақырыпты өту жоспары
1. Химиялық реакциялар жылдамдығы.
2. Реакциялар жылдамдығының сыртқы факторларға тәуелділігі.
3. Температураның реакция жылдамдығына әсері.
4. Катализ.
5-6. Химиялық тепе-теңдік және оның ығысуы.
Келесілерді : химиялық айналулар энергетикасын; Гесс заңын; реакция реакциялар жылдамдығының температураға, концентрацияға, әрекеттесуші заттардың жанасу аудандарына, әрекеттесуші заттар табиғатына, катализаторлар мен ингибиторлар қатысуына тәуелділігін; Вант-Гофф ережесін; Ле-Шателье қағидасын; химиялық тепе-теңдіктің ығысу шарттарын білуі тиіс.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz