Қанықпаған көмірсутектер мен ароматты туындыларының реакциялық қабілеттілігі: электрофильді қосылу мен орынбасу механизмдері, Марковников ережесі және орынбасарлардың әсері


Қанықпаған Көмірсутектердің реакцияға түсу қабілеттілігі
Жоспар:
1. Көмірсутектердің және олардың туындыларының реакцияға түсу қабілеттілігі.
2. Электрофильді қосып алу реакциялары. В. В. Марковников ережесі.
3. Қосарланған жүйелердегі электрофильді қосылу реакциясы
4. Электрофильді орын басу реакциялары.
5. Ароматты көмірсутектердің реакциялық қабілеттілігіне орынбасарлардың әсері.
Көмірсутектердің және олардың туындыларының реакцияға түсу қабілеттілігі
Реакциялық қабілеттілік, химиялық реакциялардың бағыты мен механизмі көміртегі атомдарының электрондық құрылысы мен олардың түзетін байланыстарының табиғатына тәуелді. Кез-келген реакция кезінде химиялық жүйе бір жағдайдан екінші жағдайға өтеді:
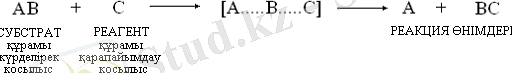
Реакция өнімдері түзілуі үшін субстрат пен реагенттегі ескі байланыстар энергия жұмсалып үзілуі қажет. Сондықтан да бастапқы заттарды активтелген комплекс арқылы реакция өнімдеріне айналдыру үшін қажетті энергия мөлшері активтендіру энергиясы деп аталады. Активтендіру энергиясы - субстрат пен реагент реакция өнімдеріне өту жолындағы энергиялық тосқауыл, ол төмен болған сайын реакцияның жүру мүмкіндігі арта түседі. Катализатор қатысында реакция сатылы жүріп, оның активтендіру энергиясы едәуір төмендейді:

Реакцияның жалпы жылдамдығы ең баяу жүретін сатысының жылдамдығымен анықталады.
Органикалық химияда реакцияларды олардың жүру бағыты және нәтижесі бойынша жіктейді. Олар: а) орын басу - S; ә) қосып алу - А; б) үзілу - Е және в) қайта топтасу реакциялары.
Сонымен қатар реакцияның механизмі бойынша радикалды және ионды реакциялар деп бөледі.
1. Радикалды реакциялар бос радикалдардың қатысумен жүреді. Бос радикалдар - жұптаспаған (дара) электроны бар атомдар немесе атомдар тобы. Олар реагенттің құрамындағы байланыстың гомолиттік үзілуі нәтижесінде пайда болады:

2. Ионды реакциялар жүру үшін реагенттің құрамындағы байланыс гетеролиттік үзіліп, зарядталған бөлшектер (иондар) пайда болады да, олар субстрат молекуласын шабуылдайды. Ондай бөлшектерді электрофилдер немесе нуклеофилдер деп атайды:
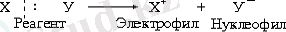
Электрофил - субстрат құрамындағы атомның бос электрон жұбымен байланысатын бөлшек. Байланыс түзуі үшін олардың бос электрондық орбитальдары болуы қажет. Электрофил ретінде оң зарядталған иондар (H + , NO 2 + , SO 3 H + т. б. ), бейтарап молекулалар (SO 3 , SOCl 2 т. б. ) бола алады.
Нуклеофил - электрон жұбыың доноры болып келетін субстрат құрамындағы оң зарядталған атоммен (әдетте көміртегі атомы) байланысатын бөлшек. Нуклеофил ретінде теріс зарядталған иондар (OH - , RO - , CN - т. б. ), бейтарап молекулалар (H 2 O, ROH, NH 3 , ROR) бола алады.
Электрофильді қосып алу реакциялары. В. В. Марковников ережесі
Алкендердің құрамында σ- және π-байланыстар бар. π-Байланысты түзетін р z -орбитальдары жазықтықтың екі жағында бүйірінен қабысқандықтан олар қозғалғыш және әлсіздеу келеді.
Алкендер мен алкиндерде қанықпаған >С=С< және -С=С- байланыстар болғандықтан олар қанығуға, яғни нуклеофилдік қасиет көрсетіп, электрофилді қосып алу реакцияларына (А Е ) түсуге тырысады.
Электрофилдердің субстрат құрамындағы электрон бұлтының тығыздығы жоғары еселік байланыстарды шабуылдауы нәтижесінде π-комплекстер түзіледі. Сонан соң олар баяу σ-комплекске өтеді де, тұрақтанады. Алкендерге тән кейбір А Е реакциялары :
- Алкендерді галогендеу (қос байланысқа сапалық реакция) .

Алкендердегі π -байланысы беріктігі аз болғандықтан жеңіл үзіледі, нәтижесінде қаныққан органикалық қосылыстар түзіледі.
Галоген сутектер мен судың симметриялы емес алкендерге қосылу реакциялары В. В. Марковников ережесіне сәйкес жүреді. Ол былай тұжырымдалады: Гидрогалогендеу және гидраттау реакцияларында сутегі атомы субстрат құрамындағы сутегі атомы көп, яғни көп гидрогенденген, көміртегі атомына қосылады:
CH 3 -CH=CH 2 +HCI H 3 C-CHCI- CH 3
Бұл қос байланыспен көршілес орынбасарлардың +І (индуктивті) әсерінен π-электрон бұлтын шеткі көміртегі атомына ығыстыру нәтижесінде сол атомда электрон бұлты тығыздығының артуымен түсіндіріледі.
Реакцияның механизмі:

Бұл реакциядағы карбкатионның тұрақтылығы радикалдардың оң индуктивтік әсерінен төмендегі бағытта өзгереді:

Дегидрогалогендеу реакциясы КОН (спирт. ) әсерінен Зайцев ережесіне сәйкес жүреді:
H 3 C-CH-CH-CH 3 CH 3 - C = CH - CH 3 +HCI
CH 3 CI CH 3
3. Гидраттау реакциясы. Реакция қышқыл қатысында жүреді (қышқылдық катализ) :
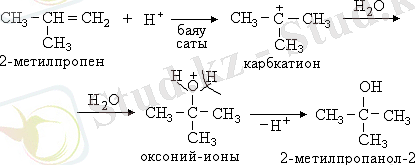
Спирттерді дегидраттау реакциясы :
CH 3 -CH 2 -OH CH 2 =CH 2 +H 2 O
4. Гидроксилдеу реакциясы (Вагнер реакциясы) - қос байланысқа сапалық реакция (КМnO 4 ерітіндісінің түссізденуі) :
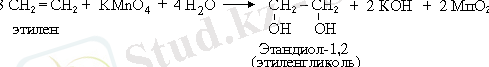
5. Алкендердің полимерлену реакциясы:
б) n CH 2 =CH 2 (-CH 2 -CH 2 -) n
этилен полиэтилен
Қосарланған жүйелердегі электрофильді қосылу реакциясы
Диенді көмірсутектерге де А Е реакциялары тән, бірақ π, π-қосарлану нәтижесінде электрофилді қосып алу реакциялары екі бағытта - 1, 4 және 1, 2- бағытында жүруі мүмкін. Мысал ретінде бутадиен-1, 3 гидрогалогендеу реакциясын қарастырайық:
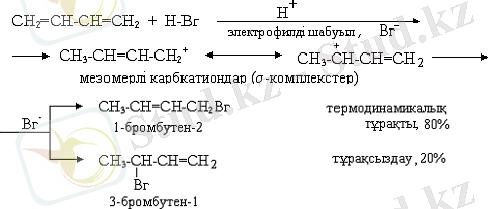
Қосарланған жүйе реакцияға түскенде электрон тығыздығы қайта таралып, тізбектің ең соңғы көміртегі атомы қанықпаған болады да, электрофилді қосып алады. Пайда болған мезомерлі карбкатиондағы оң заряд нақты бір С атомында шоғырланбаған, ол көрші π-электрон бұлтының алшақ көміртегі атомында орын алады, сондықтан да А Е реакциялары екі бағытта жүреді:

Электрофильді орын басу реакциялары
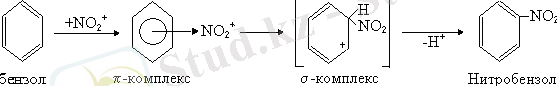
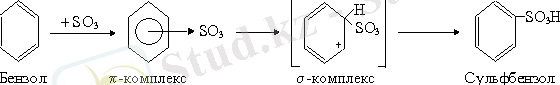
Арендер - қосарланған тұйық жүйелер. Олардың π-электрондары делокализацияланады да, молекуланың термодинамикалық тұрақтылығы жоғары болып келеді. Сондықтан арендер электрофилді орын басу S Е реакцияларына түседі. Реакция механизмі төмендегі сатылардан тұрады:
- π-Комплекcтің түзілуі.
- π-Комплекcтің σ-комплекске өтуі.
- Протонның тез үзіліп, σ-комплекстің тұрақтануы.
Бензол сақинасының тұрақтылығы жоғары болғандықтан реакцияны активтендіру үшін көп жағдайда катализатор қолданылады.
Арендерге тән кейбір S Е реакциялары:
1. Галогендеу реакциясы.

Бензол сақинасындағы 6 электрондардың екеуі ковалентті байланысып, σ-комплекс түзеді, ал қалған 4 электрон 5 көміртегі атомдарына таралып, ''+'' заряд пайда болады. Бұл циклдің ароматтылығын жояды. Оны қалпына келтіру үшін σ-комплекстен протон үзіліп шығады.
- Нитрлеу реакциясы. Нитрлеуші қоспа ретінде коцентрациялы азот және күкірт қышқылдарының қоспасы алынады:
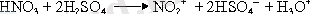
3. Сульфирлеу реакциясы. Бұл реакция да осы механизм бойынша жүреді. Сульфирлеуші агент ретінде конц. H 2 SO 4 + SO 3 қолданылады:
4. Алкилдеу реакциясы. Арендерді алкилдеу реакциясы AlCl 3 катализаторы қатысында жүреді:
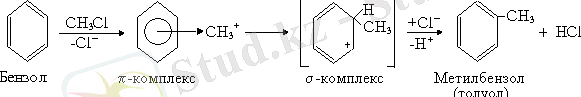
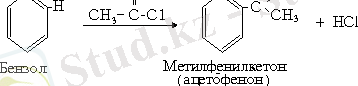
5. Ацилдеу реакциясы. Бұл реакцияның да механизмі ұқсас болғандықтан оның жалпы схемасы төмендегідей:
Реакциялық қабілеттілікке орынбасарлардың әсері
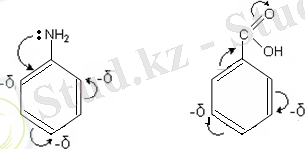
Бензол туындыларының реакциялық қабілетіне сақинамен байланысқан орынбасарлардың табиғаты әсер етеді. Бензол сақинасымен байланысқан барлық орынбасарларды екі топқа бөлуге болады:
1- ретті орынбасарлар (орто- және пара- бағыттағыштар) .
2- ретті орынбасарлар (мета- бағыттағыштар) .
Бұл орынбасарлар ароматты көмірсутектерге тән электрофилді орын басу реакцияларының жылдамдығына әсер етеді.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz