S-элементтерге шолу: ІA және ІІA топтарының салыстырмалы сипаттамасы


Реферат
«s-элементтеріне шолу. ІІА және ІА топтарының элементтеріне салыстырмалы сипаттама»
Жоспар:
- Кіріспе
- Негізгі бөлім
- IА тобының металдары
- ІІА тобының негізгі топшасының металдары
- Қорытынды
- Пайдаланылған әдебиеттер
Кіріспе
S-элементтер Д. И. Менделеевтің периодтық жүйесінде ІА, ІІА топтардың негізгі топшаларында орналасқан. ІА - топтың негізгі топшасындағы - литий, натрий, калий, рубидий, цезий және франций сілтілік металдар деп аталады, электрондық конфигурациясы - nS1. ІІА топтың негізгі топшасындағы кльций, стронций, барий және радий сілтілік жерметалдар деп аталады, электрондық конфигурациясы - nS2.
Элементтердің периодтық жүйесінің әрбір периодының басында s-ұяластарға жататын элементтер болады. Олардың сыртқы электрондық қабатында бір немесе екі s-электроннан бар. Электрондық қабаттардың саны және атомдардың радиустары да олардың атомдарының ядро заряды өскенде артады.
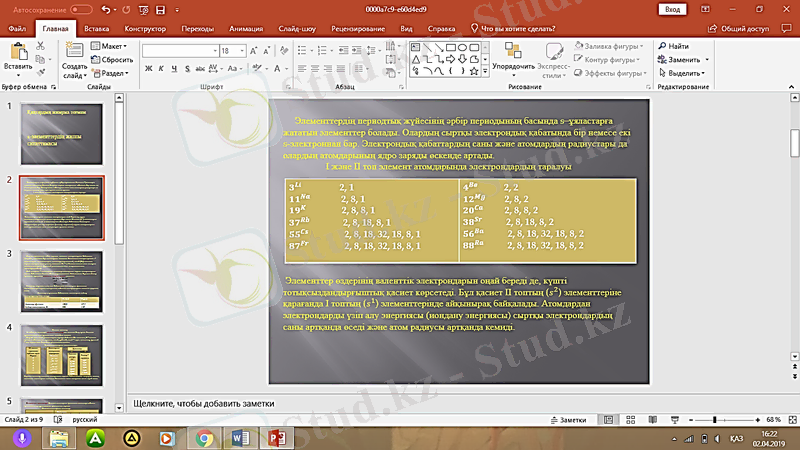
Элементтер өздерінің валенттік электрондарын оңай береді де, күшті тотықсыздандырғыштық қасиет көрсетеді. Бұл қасиет II топтың ( ) элементтеріне қарағанда I топтың ( ) элементтерінде айқынырақ байқалады. Атомдардан электрондарды үзіп алу энергиясы (иондану энергиясы) сыртқы электрондардың саны артқанда өседі және атом радиусы артқанда кемиді.
Элементтер өздерінің валенттік электрондарын оңай береді де, күшті тотықсыздандырғыштық қасиет көрсетеді. Бұл қасиет II топтың ( ) элементтеріне қарағанда I топтың ( ) элементтерінде айқынырақ байқалады. Атомдардан электрондарды үзіп алу энергиясы (иондану энергиясы) сыртқы электрондардың саны артқанда өседі және атом радиусы артқанда кемиді.
I және II топ элемент атомдарында электрондардың таралуы:
Негізгі бөлім
 IА тобының металдары
IА тобының металдары
IА тобының металдары сілтілік металдар деп аталады. Олар сумен белсенді әрекеттескенде сілті түзетіндіктен осылайша аталған.
Натрий және калий (элементтердің таралуы бойынша Na алтыншы, К - жетінші орында ) табиғатта кең таралған; литий, рубидий, цезий - сирек элементтер, франций - жер қыртысында болмайтын радиоактивті элемент.
ІА - элементтерінің сыртқы электрондық қабатында бір S1-электрон ядромен әлсіз байланысты болатындықтан, оны беріп жіберіп, күшті тотықсыздандырғыщ қасиет көрсетеді: Барлық қосылыстарында иондық байланыс түзеді және тотығу дәрежелері тұрақты +1-ге тең болады.
Сілтілік металдардың сипаттамалары
IА топтың периодтық жүйедегі орны
Период
2
3
4
5
6
7
Атомдардың электрондық формуласы
Элемент
Қасиеттері
Атомдық радиус,
0, 155
0, 189
0, 236
0, 248
0, 267
0, 280
Электр -терістілік
0, 97
0, 93
0, 91
0, 89
0, 86
= 0. 86
Ядродан қашықтау валенттік электронның ядромен байланысының әлсіреуіне әкеледі, сондықтан металдардың химиялық белсенділігі топта жоғарыдан төмен қарай өседі.
Сілтілік металдардың қасиеттері
Физикалық қасиеттері
Сілтілік металдардың физикалық қасиеттері көбінесе кристалдық тор құрылысының ерекшелігіне тәуелді.
Жай заттар
Li (қ. ) Na (қ. ) K (қ. ) Rb (қ. ) Cs (қ. )
Кристалдық тордың түрі Көлемді орталықтанған
Атомдану энергиясы, Кдж/моль 158, 9 108, 8 91, 6 82, 0 78, 0
Тығыздығы, г/ 0, 53 0, 97 0, 86 1, 53 1, 87
Қаттылығы (шартты бірлік) 0, 6 0, 5 0, 4 0, 3 0, 2
Балқу температурасы, С 179, 5 97, 7 63, 5 98, 7 28, 5
Қайнау температурасы 1340 883 776 713 690
Барлық сілтілік металдар күмістей ақ түсті (жаңадан кескен кезде) олар жұмсақ (литиден басқасы пышақпен кесіледі) . Бұл металдар жеңіл балқиды. Балқу температурасы литийден цезийге (Cs қолдың жылуынан балады) қарай төмендейді, өйткені атомдардың шамасының артуынан кристалдық тордағы металл атомдарының байланыс энергиясы кемиді.
Барлық сілтілік металдар жылу мен электр тогын жақсы өткізеді.
Химиялық қасиеттері бойынша сілтілік металдар бір -біріне өте жақын. Олар - ең күшті тотықсыздандырғыштар және басқа металдарға қарағанда белсенділігі ең жоғарылар. Олардың тотықсыздандырғыштық бнлсенділігі Li-ден Cs-ге қарағанда өседі, өйткені кристалдағы химиялық байланыстың беріктігі және атомнан электронды үзіп алып катиондар түзуге қажетті энергия кемиді.
Сілтілік металдар тікелей барлық бейметалдармен, сонымен бірге сумен, қышқылдармен әрекеттеседі. Табиғатта тек қана байланысқан түрде (хлоридтер, силикаттар, сульфаттар) кездеседі.
Сілтілік металдардың жоғары реакциялық қабілеттерін ескеріп, оларды керосиннің немесе парафин майының (сұйық қаныққан көмірсутектер) астында сақтайды.
ІІА тобының негізгі топшасының металдары
Бериллий Ве, магний Mg, кальций Ca, стронций Sr, барийBa және радий Ra периодтық жүйенің IIА тобын түзеді. Үш металл сілтілікжер металдар топшасын құрайды. Өқлай аталу себебі, олардың оксидтері алхимия кезеңінде «жер» деп аталған, ал оларды суда еріткенде сілтілер алынған.
Магний, кальций, стронций, барийді таза күйінде ағылшын химигі Г. Дэви 1808 ж., бериллийді металл түрінде 1828 ж. Неміс химигі Ф. Велер, сондай-ақ радиоактивті металл радийді 1910 ж. француз химиктері П. Кюри мен М. Кюри алған.
Бериллий - химия тарихына ғылыми пікірталастың элементі ретінде енгізелген. Д. И. Менделеев оның атомдық массасын түзетіп, периодтық заңының дұрыстығын дәлелдегені сендерге белгілі. Зерттеулер Менделеевтің болжауларының растығын дәлелдеді.
Атомдардың құрылысы және химиялық белсенділігі. Бұл топшаның барлық өкілдері s- элементтері. Жай заттары - типтік металдар. Бериллий топшасы элементтері атомдарының сыртқы деңгейінде екі электроннан бар. Оларды беріп жіберіп, қосылыстарда тұрақты +2 тотығу дәрежесін көрсетеді. Топшаның барлық металдары - күшті тотықсыздандырғыштар, бірақ сілтілік металдарға қарағанда едәуір әлсіздеу.
Элементтің атомдық нөмірі өскен сайын электрондардың берілуі жеңілдейді, сондықтан элементтердің металдық қасиеттері заңды өседі. Олар сілтілікжер металдарында анық көрінеді. Топшаның бірінші екі элементі қалған төрт металдан едәуір ерекшеленіп, басқаша жағдайда ие болады. Берилий өзінің кейбір қасиеттеріәмен алюминийге жақындайды.
Табиғатта кальций және магний ғана көп, ал қалғандары аз таралған. Радий - сирек кездесетін радиоактивті элемент.
Сілтілікжер металдар физикалық қасиеттері бойынша сілтілік металдарды еске түсіреді. Бұл топ элементтері атомдарының радиустары кішілеу және кристалдарында өзара берік байланысқан . Сондықтан олар едәуір қатты, балқу температурасы жоғары және тығыздығы үлкен. Бұл топша металдарының физикалық қасиеттері, негізінен, олардың кристалдық торы қандай құрылысты екеніне тәуелді. Бериллий және магнийдің тығыз гексагональды кристалдық торы бар, сондықтан олар қатты, иілгіштігі төмен. Кальций, стронций және барий кубтық торының типтері бойынша құрылған, сондықтан иілгіштігі басым. Бұл металдардың барлығы жеңіл металдарға жатады.
Химиялық қасиеттері. Бериллий топшасының металдаоры - химиялық белсенді элементтер. Бұл металдар тотықсыздандырғыштар ретінде екі валенттік электрондарын беріп, тотығу дәрежесі +2 иондарға айналады
Олар ауада тотығады, бұл кезде RO типті оксидтер алынады, оларға типті гидроксидтер сәйкес келеді. Гидроксидтердәің негіздік сипаты мен ерігіштігі Ве-ден Ва-ға өседі. ВеО және - екідайлық өосылыстар.
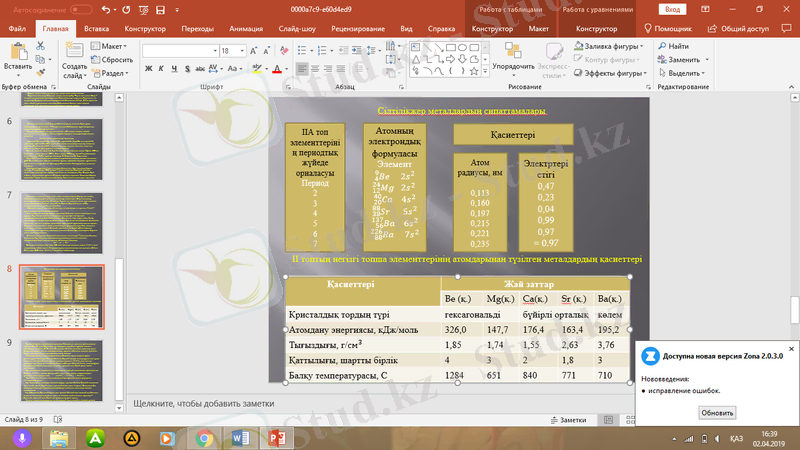 II топтың негізгі топша элементтерінің атомдарынан түзілген металдардың қасиеттері
II топтың негізгі топша элементтерінің атомдарынан түзілген металдардың қасиеттері
Бұл металдардың тотықсыздандырғыштық белсенділігі оттекпен әрекеттескенде көрінеді. Егер Ве және Mg оларды әрі тотығудан қорғайтын тұрақты оксидтік қабықшамен қапталса, Ca, Sr және Ва оттекпен белсенді қосылып, оксидтер түзеді. Сондықтан оларды сілтілік металдар сияқты, керосин қабатының астында сақтайды. Барлық металдар оттекте қыздырғанда жақсы жанады.
Металдардың тотықсыздандырғыштық қабілетінің өсуіне олардың сумен әрекеттесуінде бақылауға болады. Мәселен, берелий жоғары температурада ғана сумен тотығады, металдың бетінде түзілген металл гидроксиді оны одан әрі тотығудан қорғайтын тығыз қабықша болып табылады. Магний кәдімгі температурада баяу тотығады. Келесі металдар - кальций, стронций және барий сумен жақсы ірекеттеседі.
Бұл металдардың гидроксидінің қасиеттері де осындай заңдылықпен ерекшеленеді. Мәселен, мүлдем суда ерімейді, аздап ериді, қалған гидроксидтердің ерекшелігі мына қатарда өседі:
Бериллий, магний және сілтілікжер металдары сутекпен жалпы формуласы гидридтер түзеді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz