Беттік құбылыстар мен беттік керілу: адсорбция және сорбциялық процестердің термодинамикасы


Реферат
«Беттік құбылыстар. Беттік керілу»
Орындаған:
Қабылдаған:
Қарағанды
2018-2019 оқу жылы
Жоспар:
- Кіріспе
- Негізгі бөлімБеттік керілуБеттік керілудің температуға тәуелділігіБеттік құбылыстар және адсорбцияСорбциялық құбылыстардың жалпы сипаттамасыБеттік активті заттарГибсс теңдеуіШишковский теңдеуі. Траубе - Дюкло ережесі
- Қорытынды
- Пайдаланылған әдебиеттер
Кіріспе
Беттік керілу бетке перпендикуляр бағытта сұйық молекуласынішке қарай тартатын ішкі қысым күшінің әсерінен пайда болатын құбылыс. Ішкі қысым молекулалық әрекеттесу күштің нәтижесш-де пайда болатындықтан, оның мәні зат полюстігіне тәуелді, яғни берілген заттың полюстігі артқан сайын ішкі қысым да көбейеді. Мысалы, судың ішкі қысымы 14800 атм., бензолдікі 3800 атм. Демек, бензолдан гөрі судың полюстігі артық.
Ішкі қысым сұйықтың беткі қабатына орналасқан молекулаларды ішке тартады және сұйықтың беттік шамасын (ауданын) барынша азайтуға, кішірейтуге тырысады. Сұйықтың беттік мөлшерін азайтуға себепші болатын аралық шектің бірлік өлшеміндегі ұзындығына әсер етуші күшті беттік керілу күші немесе жай ғана беттік керілу дейді. Оның өлшем бірлігі - дин/см және бұл күш сұйық бетіне әрқашан перпендикуляр бағытталған. Сұйықтың беттік қабатын көбейту үшін ішкі қысыммен байланысқан кедергіні жеңуге бағытталған жұмыс жүрігзу керек. Мұндағы қайтымды және изотермалық процестің бірлік өлшеміндегі бетті тудыруға арналған жұмыс, осы беттін, үлесті бос энергиясына тең және ол эрг/см2-пен өлшенеді. Ал, егер эрг-дин-см екенін еске алсақ, онда бір шаршы сантиметр бетті жасауға қажетті үлесті бос энергия шамасы осы беттегі беттік керілу күшіне теңеледі екен (дин/см) . Олай болса, осы айтылғанға орай беттің үлесті бос энергиясы бет-тік керілуге тең; бұл екі шама да бір таңбамен (а) өрнектеледі. Ескерте кететін бір жай, беттік бос энергия системаның бір компоненті сұйық болғанда ғана беттік керілу күшіне теңеледі, яғни таза су, бензол, спирт, май сияқты жеке сұйықтардағы беттік бос энергияның шамасы оның беттік керілу күшіне тең екен.
Фазааралық шектің беткі қабатында бос энергияның артық болуын әр түрлі әдістер көмегімен дәлелдеуге болады. Мысалы, сұйық фазаның ішкі ортасына орналасқан молекуланың өзін қоршаған молекулалармен әрекеттесу күші орташа күшке айналады және ол күш өрісінің симметриялы болуына байланысты нөлге теңеледі. Газ бен сұйық фазаларының арасындағы шекті кабаттағы молекулалар газдан гөрі сұйық молекуласымен көбірек әрекеттесетіндіктен, ондағы тең әсерлі күш сұйыққа қарай, яғни сұйық фазаның беткі қабатына перпендикуляр бағытталады. Көлем өзгеріссіз қалатын жағдайдағы беткі қабаттың ауданын көбейту молекулааралық ішкі күшке қарсы жұмыс жүргізу кезінде фаза көлеміндегі молекулаларды беткі қабатқа шығарады. Изотермалық жағдайда жүргізілетін бұл жұмыс беткі қабаттағы бос энергияның артуына тең. Дәл осы сияқты қатты заттарды ұнтақтау ке-зінде де ондағы байланыс үзіліп, әрбір бөлшек саны артқан сайын беткі қабат та көбейеді және фазааралық беткі қабат артқандықтан, бос энергия жоғарылайды. Мұндай беткі қабат ауданына сәйкес көбейіп отыратын бос энергия туралы ойды кез келген фазааралық беткі қабаттарға пайдалануға болады.
Негізгі бөлім
Дисперсті бөлшектер мен дисперсиялық орта түрлі фазаларға жатады. Жүйе әртүрлі фазалардан тек шекаралық фазаларда молекулярлық өзара әрекеттер әр түрлі болған жағдайда болуы мүмкін. Молекулярлы өзара әрекеттесудің жалғыз жүйесі - идеалды газ. Молекулалық өзара әрекеттесудің қарқындылығы нақты газдардан қатты заттарға көшуімен бірге артады.
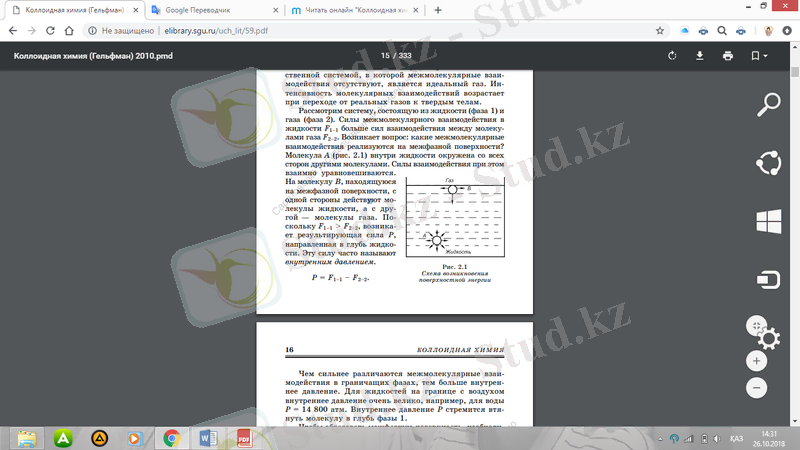 Сұйықтықтан (1-кезең) және газдан (2-кезең) тұратын жүйені қарастырамыз. Сұйықтықтағы молекулалық өзара әрекеттесу күштері газ молекулаларының өзара әрекеттесу күштерінен көп. Сұрақ туындайды: кезең аралық беткейде қандай молекула аралық байланыс жүзеге асады? Сұйықтықтың ішіндегі A молекуласы (2. 1 сур. ) басқа молекулалармен жан-жақты қоршалған. Өзара байланыс күштері өзара теңдестірілген. B молекуласының кезең аралық беткейінде бір жағынан сұйық молекулалар, ал екінші жағынан - газ молекулалары бар. Нәтижесінде күшті сұйықтыққа бағытталған Р күші пайда болады. Бұл күш жиі ішкі қысым деп аталады.
Сұйықтықтан (1-кезең) және газдан (2-кезең) тұратын жүйені қарастырамыз. Сұйықтықтағы молекулалық өзара әрекеттесу күштері газ молекулаларының өзара әрекеттесу күштерінен көп. Сұрақ туындайды: кезең аралық беткейде қандай молекула аралық байланыс жүзеге асады? Сұйықтықтың ішіндегі A молекуласы (2. 1 сур. ) басқа молекулалармен жан-жақты қоршалған. Өзара байланыс күштері өзара теңдестірілген. B молекуласының кезең аралық беткейінде бір жағынан сұйық молекулалар, ал екінші жағынан - газ молекулалары бар. Нәтижесінде күшті сұйықтыққа бағытталған Р күші пайда болады. Бұл күш жиі ішкі қысым деп аталады.
Молекула аралық өзара әрекеттесу іргелес фазаларда әртүрлі болған сайын, ішкі қысым да артады. Ауадағы сұйықтықтар үшін ішкі қысым өте жоғары, мысалы, су P = 14, 800 атм. Ішкі қысым P молекуланы 1-ші кезеңге тереңдетуге ұмтылады. Аралық бетті қалыптастыру үшін молекулалардың бір бөлігін сұйықтықтың көлемінен бетіне ауыстыру қажет. Бұл үшін ішкі қысыммен жұмыс істеу керек, оның көп болғаны сайын соғұрлым көп энергия жұмсау қажет екендігі айқын. Бұл энергия бетінде орналасқан молекулаларда шоғырланған және беткейлік энергия деп аталады.
Беттік керілу
Беткей құбылыстардың ең маңызды сипаттамалар беттік керілу болып табылады. Ол 1 аралық беткейде артық беттік энергияны сипаттайды.
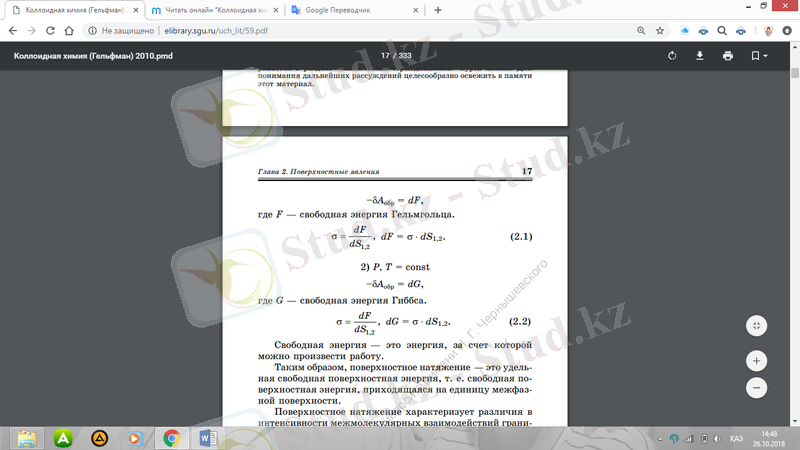
Беткі кернеу (σ) термодинамикалық қайтымды, изотермиялық жұмыстарға тең, бұл аралық беткейдің ауданын біреуіне арттыру үшін жасалуы керек.


 онда - беткей көлемнің пайда болуына жұмсалған термодинамикалық қайтымды жұмыс, себебі жүйе бойынша жұмыс жасалғандықтан, ол теріс болып саналады. Әдетте жұмыс тұрақты көлемде және температурада (V, T = const) немесе тұрақты температурада және қысым кезінде (P, T = const) орындалады. Екі нұсқаны қарастырамыз:
онда - беткей көлемнің пайда болуына жұмсалған термодинамикалық қайтымды жұмыс, себебі жүйе бойынша жұмыс жасалғандықтан, ол теріс болып саналады. Әдетте жұмыс тұрақты көлемде және температурада (V, T = const) немесе тұрақты температурада және қысым кезінде (P, T = const) орындалады. Екі нұсқаны қарастырамыз:
- V, T = const
Мұнда F- Гельмгольц бос энергиясы.
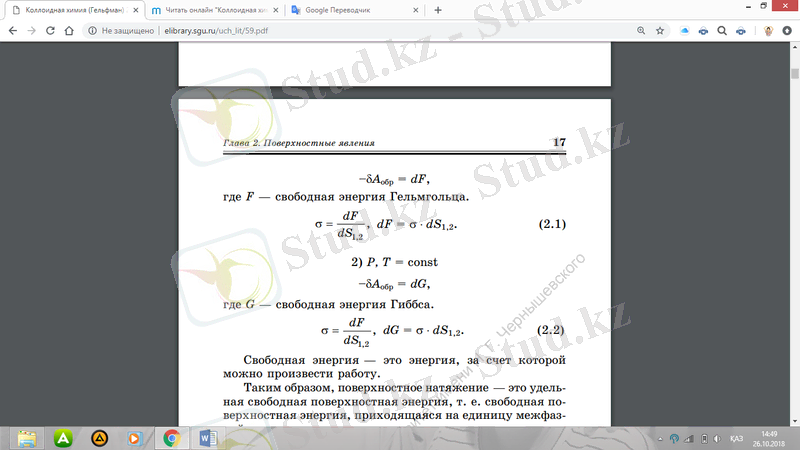
Мұнда G - Гиббс бос энергиясы
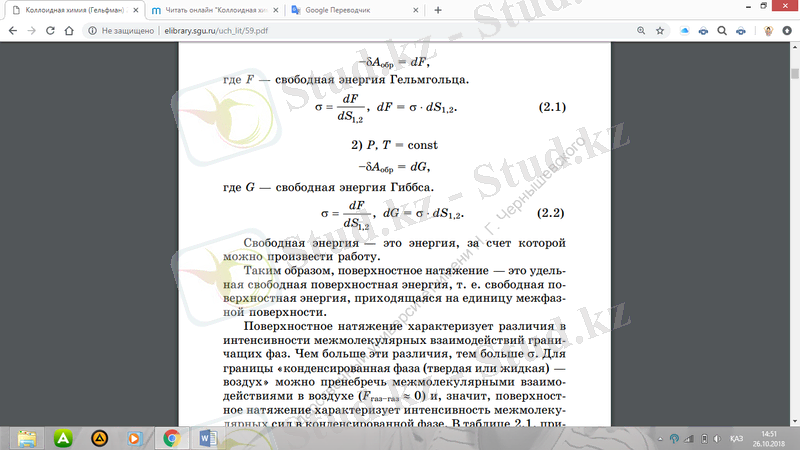
Бос энергия - соның есебінен жұмыс жасалуы мүмкін энергиясы.
Осылайша, беттік керілу - бұл бос беткей энергиясы, яғни біртұтас аралық беткейдің бос бетінің энергиясы.
Кесте 1. Ауа шекарасындағы беттік керіліс
Сұйықтық
Сынап
Қатты дене
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz