Газдың молекулалық-кинетикалық теориясының негізгі теңдеулері және идеал газдың күй теңдеулері


Реферат
«Газдың кинетикалық теориясының негізгі теңдеуі.
Идеал газдың теңдеулері»
Орындаған:
Қабылдаған:
Қарағанды
2018-2019 оқу жылы
Жоспар:
- Кіріспе
- Негізгі бөлімИдеал газГаздың - идеал газ молекуласының орташа кинетикалық энергиясының өлшемiБольцман тұрақтысы. Клайперон-Менделеевтiң күй теңдеуiГаз молекуласының еркіндік дәрежесіМаксвелл таралуыГаздағы изопроцесстер және олардың графиктерi.
- Қорытынды
- Пайдаланылған әдебиеттер
І. Кіріспе
Газдардың физикалық қасиеттерін зерттеуге статистикалық әдісті қолданады.
Молекула -кинетикалық теорияның негізгі қағидалары:
1. Барлық заттар бөлшектерден тұрады (молекулалар мен атомдардан) ;
2. Осы бөлшектер тәртіпсіз, хаостық қозғалыста болады. Бұл қозғалыс жылулық қозғалыс деп аталады;
3. Бөлшектер бір-бірімен өзара әсерлеседі.
 Зат бөлшектерінің жылулық қозғалысын қөрнекі түрде көрсететін тәжірибені ағылшын ғалымы Броун жасады. Броун микроскоптың көмегімен сұйықта қалқыған гүл тозаңдарының жылдам, тәртіпсіз қозғалысын бақылады. Осындай зат бөлшектерінің жылулық қозғалысын Броундық қозғалыс деп атайды.
Зат бөлшектерінің жылулық қозғалысын қөрнекі түрде көрсететін тәжірибені ағылшын ғалымы Броун жасады. Броун микроскоптың көмегімен сұйықта қалқыған гүл тозаңдарының жылдам, тәртіпсіз қозғалысын бақылады. Осындай зат бөлшектерінің жылулық қозғалысын Броундық қозғалыс деп атайды.
Макроскопиялық параметрлердің (қысым, көлем) микроскопиялық параметрлермен (молекулалардың массасы, жылулық қозғалыс жылдамдығы, кинетикалық энергиясы) арасындағы байланысты көрсететін өрнекті молекула-кинетикалық теорияның негізгі теңдеуі деп атайды. [1]
ІІ. Негізгі бөлім
2. 1. Идеал газ
Идеал газ деп молекулалардың өзара әсерлесуi ескерусiз аз шама болғанда айтады. Молекулалардың өзара әсерлесуi олардың соқтығысуы кезiнде серпiмдi ұрылуы түрiнде байқалады.
Газ молекулалары барлық уақытта ретсiз жылулық қозғалыста болады, оның мөлшерлiк сипаттамасын молекуланың сызықты жылдамдығының орташа квадраты, дәлiрек айтқанда, кинетикалық энергиясының орта мәнi бередi. Жеке молекулалардың жылдамдықтары бiр-бiрiнен өзгеше болуы мүмкiн, бiрақ бұл жылдамдықтардың модулiнiң орташа мәнi белгiлi бiршама. Жеке молекулалардың жылдамдықтарын v 1 , v 2 , v 3 , . . . , v N арқылы белгiлеймiз. Сонда, жылдамдықтардың квадратының орташа мәнi келесi формуламен анықталады:
,
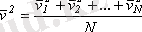
мұнда, N - газдағы молекулалардың жалпы саны. Екiншi жағынан
. Қозғалыстың бейберекеттiгi әсерiнен молекулалардың барлық бағыттарда орынауыстыруы тең мүмкiндiкте. Сондықтан, жылдамдықтың проекциясының квадраттарының орташа мәндерi өзара тең:
. Бұны ескере отырып, алатынымыз
(1. 10)
1-сурет
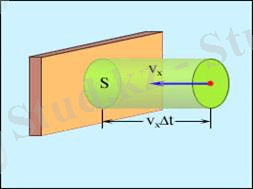
2. 2. Газдың макропараметрлерi. Tемпература және оны өлшеуЕндi идеал газдың ыдыс қабырғасына әсер ететiн күшiн табайық. Қоршаған ортаның қандайда бiр бетке әсерiнiң физикалық сипаттамасы - күш емес қысым болып есептеледi. Қысым деп бiрлiк ауданға нормаль бойымен әсер ететiн күштi айтады. Қысым p әрпiмен белгiленiп, анықтамасы бойынша мынаған тең: p=F n /S , мұнда S - бет элементiнiң ауданы, ал F n - бет элементiне перпендикуляр әсер ететiн күш шамасы (1 - сурет) .
Идеал газ жағдайында F n нормаль күштiң шамасы келесi өрнекпен анықталады:
(1. 11)
мұнда, n - газ молекуласының концентрациясы (бiрлiк көлемдегi молекулалар саны: n=N/V ), m 0 - молекула массасы.
Бұл қатынастың қорытындысы.
Газдың барлық молекулаларда v x жылдамдық мәнi бiрдей бола бермейдi, олай болса қабырғаға әсер ететiн күштiң уақыт бойынша орта мәнi v 2 x -қа емес, жылдамдықтарының орташа квадратына пропорционал:
. (1. 10) -шi формуланы ескере отырып, алатынымыз:
Анықтамасы бойынша p = F n /S . Бұдан шығатыны
(1. 12)
Егер
арқылы молекуланың iлгерлемелi қозғалысының орташа кинетикалық энергиясын белгiлесек:
, онда (1. 12) теңдеуiн басқаша түрде жазуға болады
(1. 13)
(1. 12) немесе (1. 13) қатынастар газдардың молекулалық-кинетикалық теориясының негiзгi теңдеулерi болып табылады. Олар, тiкелей өлшенетiн, макроскоптық шама - қысымды қозғалыстағы молекулаларды сипаттайтын микропараметрлармен байланыстырады. [1]
Дененiң молекулалық-кинетикалық құрылымы ескерiлмегенде макроскоптық дене күйiн сипаттайтын шамаларды макроскоптық параметрлер деп атайды.
Бұндай шамалар қатарына көлем V , қысым P , температура T және басқалар. Көлем мен қысым механикалық сипатталатын шамалар. Температура дененiң қызу дәрежесiн бередi, оның iшкi энергетикалық күйiн анықтайды.
Егер қандайда бiр оқшауланған жүйенi құрайтын денелер температурасы бастапқы уақытта әртүрлi болса, онда уақыттың келесi мезеттерiнде олар бiртiндеп теңесе бастайды да ақырында бiрдей болады, денелер арасында жылулық тепе-теңдiк орнайды.
Жүйенiң жылулық тепе-теңдiгi деп оның барлық макроскоптық параметрлерi қай уақытта да ұзақ өзгерiссiз қалуын айтады.
2-сурет
Осылайша, температура денелер жүйесiнiң жылулық тепе-теңдiк күйiн сипаттайды, атап айтқанда: өзара жылулық тепе-теңдiкте тұрған жүйенiң барлық денелерiнiң температуралары бiрдей болады . Оны өлшеу үшiн кез келген макроскоптық белгiлi шаманың температурадан тәуелдiлiгiн пайдалануға болады. Практикада дененiң жылулық кеңу қасиетi жиi қолданылады, атап айтқанда, қысым тұрақты болғанда сұйық көлемiнiң өзгеруiнiң температурадан тәуелдiлiгi. Температураны өлшейтiн прибор - термометр, осы принципте құрастырылған. Термометрдi градуирлегенде санақ басын (0 деңгейiн) мұздың еру температурасын алады. Екiншi тұрақты нүктесi (мәнi) ретiнде (100 деңгейi) қалыпты атмосфералық қысымда судың қайнау температурасы алынады (2 - сурет) .
Бұл Цельсийдiң градустер шкаласы деп аталады. 0-мен 100 нүктелерiнiң аралығын градус деп аталатын теңдей 100 бөлiкке бөлiнген (3 - сурет) . Сұйық бағанының бiр бөлiкке жылжуы (орынауыстыруы) температураның 1 градус Цельсийге өзгеруiне сәйкес келедi. Әртүрлi сұйықтардың қыздырылғанда кеңуi (ұлғаюы) бiрдей болмағандықтан, термометрлерде оған сәйкес градуирленген. [2]
3-сурет
2. 3. Температура - идеал газ молекуласының орташа кинетикалық энергиясының өлшемi2. 4. Больцман тұрақтысы. Клайперон-Менделеевтiң күй теңдеуiБарлық газдар жылу тепе-теңдiгi кезiнде температуралары бiрдей болады. Молекулалардың жылулық қозғалысы сөз болғандықтан, температураны молекулалық деңгейдегi физикалық шамалар арқылы жазу керек. Бұндай шама ретiнде молекуланың iлгерлемелi қозғалысының кинетикалық энергиясын алуға болады. Бұл жорамал үш ыдыспен жасалған тәжiрибеде толық дәлелденедi.
Тәжiрибе көрсеткендей, θ=pV/N қатынасы температурадан басқа ештеңеден тәуелдi емес, сондықтан оны Т температураның бiрден-бiр өлшемi ретiнде қарастыруға болады.
θ = kТ немесе pV/N = kT , (1. 14)
мұнда k - Больцман тұрақтысы деп аталатын пропорционалдық коэффициентi.
(1. 14) теңдiгiмен анықталатын температура терiс шама болуы мүмкiн емес. Сондықтан ол абсолюттi температура деп аталады.
Температураның абсолюттi нөлi ( Т = 0) деп молекулалық қозғалыстардың тоқтаған кезiн ( E = 0) айтады. Бұл табиғаттағы ең төмен температура. Осы анықтама негiзiнде ағылшын ғалымы У. Кельвин температураның абсолюттi шкаласы ұғымын енгiздi. Бұл шкала бойынша температура абсолюттi нөлден бастап саналады және оның бөлiктерi Цельсий шкаласының градусына тең. Абсолюттi T температура мен Цельсий шкаласы бойынша t температураның арасындағы байланыс Т = t +273 теңдiгiмен берiледi. СИ жүйесiнде абсолюттi температура кельвинмен өлшенедi және ол К әрпiмен белгiленедi. Бiр кельвин Цельсий шкаласы бойынша бiр градусқа тең (1 К =1 o С ) .
(1. 14) өрнегiн молекулалық-кинетикалық теорияның PV/N =2/3
түрiндегi негiзгi теңдеуiмен теңестiрiп
. (1. 15)
Осылайша, абсолюттi температура газ молекулаларының жылулық қозғалысының орташа кинетикалық энергиясының өлшемi болып табылады.
(1. 14) формуладан шығатыны мынадай өрнек
p = nkT . (1. 16)
Қысым мен температура бiрдей болған жағдайда барлық газдардағы молекулалар концентрациясы да бiрдей болады ( k тұрақтысы газдың қасиетiнен тәуелсiз) . Басқаша айтқанда Авогадро заңының орындалуы байқалады: көлемдерi бiрдей газдарда қысым мен температура бiрдей болған жағдайда олардағы молекулалар саны да бiрдей болады. [2]
Температура үшiн pV/N = kT түрiндегi формуланы практикада пайдалану пропорционалдық коэффициенттiң k сандық мәнiн бiлудi қажет етедi. Оны табуға болады, егер тәжiрибелерден белгiлi мәлiметтердi пайдаланса. Атап айтқанда, үш ыдыспен жасалған тәжiрибеден: V = 0. 1 м 3 көлемдi алатын сутегiнiң бiр молi үшiн, θ= pV/N шамасы температураның T 1 =273 o К мәнiнде мынаған тең θ 0 = 3. 76·10 -21 Дж , ал T 2 =373 o К болғанда - θ 100 = 5. 14·10 -21 Дж . Температураның осы мәндерiндегi айырмасын θ = kT өрнегiн пайдаланып жазсақ, шығатыны θ 100 - θ 0 = k(Т 2 - Т 1 ) немесе (5. 14 -3. 76) ·10 -21 Дж = k ·100 o К . Бұдан
k = 1. 38·10 -23 Дж/К . (1. 18)
Бұл коэффициент Больцман тұрақтысы деп аталады. Ол энергетикалық ( Дж ) өлшем бiрлiкпен анықталатын θ температураны, өлшем бiрлiгi Кельвинмен анықталатын, Т температурамен байланыстырады.
Молекулалық кинетикалық теорияның негiзгi теңдеуi p қысым, V көлем және T температура арасында байланыс орнатуға мүмкiндiк бередi. Бұндай байланысты жазатын өрнек күй теңдеуi деп аталады. Егер газ молекуласы концентрациясының өрнегiн n=N/V=mN A /VM түрiнде алса, онда p=nkT теңдiгiнен мынау шығады:
pV = mkN A T/M . (1. 19)
Больцман тұрақтысының k Авогадро санына N A көбейтiндiсiн универсал газ тұрақтысы деп атап, R әрпiмен белгiлейдi:
R = k N A = 8. 31·10 3 Дж/(кмоль·К) . (1. 20)
Бұл енгiзiлген R тұрақтыны тағы да пайдаланып кез келген массасы m үшiн идеал газ күйiнiң теңдеуiн аламыз:
pV = mRT/M . (1. 21)
Бұл Менделеев-Клапейронның күй теңдеуi деп аталады. Кейде бұл теңдеу алғашқы формасында қолданылады:
P 1 V 1 /T 1 = p 2 V 2 /T 2 = const , (1. 22)
мұндағы 1 және 2 индекстерi газдың мүмкiн болатын кез келген екi күйiнiң параметрлерiне сәйкес. [3]
2. 5. Газ молекуласының еркіндік дәрежесі
Газ молекуласының еркіндік дәрежесі деп молекуланың кеңістіктегі орнын анықтайтын тәуелсіз параметрлердің жиынтығын айтамыз. Егер кез-келген дене кеңістікте қозғалатын болса, онда осы қозғалысты тәуелсіз алты қозғалыстың жиынтығы түрінде қарастыруға болады: үш ілгерілемелі қозғалыстың (тікбұрышты координаталар жүйесінің осьтері бойымен), үш айналмалы қозғалыстың (дененің массалар центрі арқылы өтетін өзара перпендикуляр үш осьтің айналасында) жиынтығы.
Қалыпты жағдайда газ молекулаларының еркіндік дәрежесі:
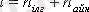
Жоғары температураларда бұл еркіндік дәрежесіне тербелмелі қозғалыстың бұл еркіндік дәрежесі қосылады.
Бір атомды газ үш бағытта ілгерілемелі қозғала алады. Сондықтан бір атомды газдың еркіндік дәрежесі
-ке тең.
Екі атомды газ үш бағытта ілгерілемелі және екі бағытта айналмалы қозғала алады (4-сурет) . Сондықтан екі атомды газдың еркіндік дәрежесі
-ке тең болады.
5 - сурет. 3-атомды газ үшін
4- сурет. 2-атомды газ үшін
Үш атомды газ үш бағытта ілгерлемелі және үш бағытта айналмалы қозғала алады (5-сурет) . Сондықтан үш атомды газдың еркіндік дәрежесі ға тең болады. [2]
2. 6. Максвелл таралуы
Ағылшын ғалымы Максвелл газ молекулаларының жылдамдық бойынша таралып орналасуын анықтайтын заңды ашты. Бұл заңдылық Максвелл таралуы деп аталды.
Максвелл ықтималдық теориясы мен математикалық статистика заңдылықтарын пайдалана отырып таралу функциясын алды.
Таралу функциясы
- дегеніміз жылдамдықтары модулі
интервалы арасында жататын газ молекулаларының үлесі болып табылады.
-функциясы газ молекулаларының жылдамдықтар бойынша таралып орналасу функциясы деп аталады. Өз кезегінде
молекулалардың жылдамдықтарының модульдері
және
аралығында жату ықтималдылығын анықтайды.
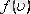
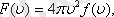
мұндағы: таралу тығыздығы,
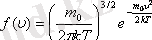
.
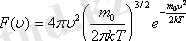
Жылдамдықтары
-ден
-ге дейінгі аралықта жататын молекулалар саны:
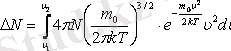
Газ молекулаларының жылдамдықтар бойынша таралу графигі келесі 6-суретте көрсетілген.
6-сурет
... жалғасымұндағы: Т 1 <Т 2 .
Газ температурасы артқан сайын графиктің максимумы үлкен жылдамдықтар жағына ығысады. Сондықтан газдарды қыздырғанда аз жылдамдықпен қозғалатын молекулалардың үлесі азаяды, ал үлкен жылдамдықпен қозғалатын молекулалардың үлесі артады.
Газдағы көпшілік молекулалар ықтимал жылдамдықтай жылдамдықпен қозғалады.
.
Молекулалардың орташа жылдамдығы -
.
Молекулалардың орташа квадраттық жылдамдығы -
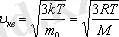
Яғни осы формулалардан
болатыны көрінеді. [2]
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz