Газдардың қатты дене бетіндегі адсорбция: теориялар, изотермалар және қолданбалар


Реферат
« Газдардың қатты дене бетіндегі адсорбциясы »
Орындаған: Сапаралиева Сулухан ТФП-24
Қабылдаған: Айтбекова Д. Е
Қарағанды
2018-2019 оқу жылы
Жоспар:
- Кіріспе
- Негізгі бөлімТұрақты температура кезіндегі газ адсорбциясының оның концентрациясына мономолекулярлы адсорбция адсорбция теориясыКаппилярлы конденсацияГаз адсорбциясының тәжірибелік қолданысы
- Қорытынды
- Пайдаланылған әдебиеттер
Кіріспе
Газдардың қатты дене бетіндегі адсорбциясы
Қатты заттардың бетінде газбен немесе бумен байланыста болғанда оң адсорбция орын алады, яғни, тепе-теңдік жағдайында газ бетінің шоғырлануы жүйенің көлеміне қарағанда жоғары болады.
Газдардың қатты дене адсорбетіндегі адсорбция ерекшеліктері
1. Қатты заттың беті сұйықтық бетіне қарағанда күрделі, гетерогенді сипатқа ие. Тіпті жылтыраған айна бетіне см-ге дейін өлшемдері бар проекциясы бар.
2. Адсорбция бүкіл бетте емес, тек белсенді орталықтарда пайда болады.
3. Адсорбция кинетикалық түрде қалпына келеді - газ адсорбциясымен қатар, оның десорбциясы жүреді. Адсорбция тепе-теңдігі өте тез орнатылады. Газ молекуласы адсорбцияланған деп саналады, егер ол белгілі бір уақыт ішінде беткей қабатында болса, адсорбция уақыты τ деп аталады. Тәжірибелі анықтау әдістері де бар. Осылайша, әйнекке сіңдірілген кадмий буы үшін τ=10 -6 -10 -12 температурасына байланысты; шыныда аргон буларының үшін 90К кезінде τ=3*10 -5 және 78К 3 кезінде τ=75*10 -5
Адсорбциялық күштердің сипатына қарай газдар мен булардың адсорбциясы физикалық және химиялық болуы мүмкін.
Жоғары температура кезінде физикалық адсорбция азаяды, себебі газ молекулаларының жылу қозғалысы қарқындылығы артып, жүйенің бүкіл көлемі бойынша бірте-бірте таратылады. Бұл адсорбция уақытының төмендеуіне, демек, адсорбцияланған зат мөлшерінің азаюына әкеледі.
Хемосорбция кезінде адсорбат молекулалары адсорбентпен химиялық қосылыстарды құрайды. Хемосорбция беткей болуы мүмкін (химиялық реакция беткей қабатында ғана орын алады) . Мысалы, алюминий бетіндегі оттегінің адсорбциясы барысында келесі реакция болады:
4Al +3O 2 = 2Al 2 O 3
соның нәтижесінде алюминий күшті оксидті пленкамен жабылады.
Хемосорбция бетіндегі реакция нәтижесінде пайда болған заттың қабаты қатты адсорбенттің көлеміне газдың енуіне кедергі келтірмейді, мысалы:
CaO (тв) +СО 2(г) = CaCO 3(тв)
Физикалық адсорбцияға қарағанда, хемосорбция кері қайтарылмайды.
Аралық жағдайларда әдетте адсорбентті заттардың үлкен бөлігі адсорбентпен әлсіз байланысқан және оның іздері мықтап жалғанған және тек ұзақ жылыту және эвакуациялау арқылы жойылуы мүмкін болған кезде пайда болады. Төмен температураларда никельдегі сутегі химиялық реакцияның төмен жылдамдығынан физикалық сіңіріледі, бірақ температура жоғарылағанда, адсорбция химиялық реакциялар түрі бойынша айқын белсендіру энергиясымен пайда болады.
4. Адсорбенттің беті жиі кеуекті болып табылады. Кеуектердің болуы капиллярлы конденсациямен бірге адсорбцияның жүруіне алып келеді.
5. Беттік процесс болып табылатын адсорбциямен қатар, газдың немесе булардың тұтас көлемімен (мысалы, металдан жасалған палладий немесе платина арқылы сутектің сіңірілуі) жұтып қоюға болады. Бұл құбылыс адсорбция деп аталады.
Қатты адсорбентте газдың адсорбциясы а сандық сипатымен көрсетеді:
моль/г
онда - қатты адсорбентте i-ші газдың сіңірілуі мөлшері; м - адсорбент массасы.
Кейде газдың орнына массасы (m) көрсетілген:
г/г
Жиі газдың көлемі қалыпты жағдайларға дейін төмендейді:
см 3 /г
Адсорбция сипатын берілген мәннің өлшемі бойынша анықтау оңай.
Қатты адсорбенттегі газ адсорбциясының мөлшері келесі факторларға байланысты:
• температура;
• үстіңгі қабаттағы будың немесе газдың концентрациясы (тепе-теңдік қысымы) ;
• қатты заттың сипаты;
• газдың сипаты.
Негізгі бөлім
Тұрақты температура кезіндегі газ адсорбциясының оның концентрациясына тәуелділігі
Газ адсорбциясы сипатталуы мүмкін:
1. Адсорбирлеген заттардың мөлшерінің температураның тұрақты тепе-теңдік р қысымынан тәуелділігі. а = f (p) қисықтары адсорбциялық изобар деп аталады. Жоғарыда айтылғандай, физикалық адсорбция кезінде температураның жоғарылауы кезінде адсорбция төмендейді: d / dT <0.
2. Адсорбцияланған зат мөлшерінің тұрақты температурада тепе-теңдік қысымына тәуелділігі. T = const кезінде a = f (p) графиктері адсорбциялық изотермалар деп аталады. Изотерма адсорбцияны зерттеуде шешуші рөл атқарады, сондықтан біз бұл қисықтарды қарастырамыз.
1-суретте температурада физикалық адсорбцияның типтік изотермалары көрсетілген.
Изотермалардың үш бөлімі бар. Бастапқы дерлік І тікелей аймақ төмен қысымдар кезінде адсорбция қысымға пропорционалды екенін көрсетеді. Бұл адсорбенттің беті іс жүзінде еркін болған жағдайға сәйкес келеді. III көлденең қима жоғары қысымда адсорбция іс жүзінде қысымнан тәуелсіз екенін көрсетеді. Бұл оның беткейі адсорбтивпен толтырылғандығына байланысты. II қисықтың аралық бөлігі беттің ішінара толтырылуына сәйкес келеді.
Жоғарыда көрсетілген температураға байланысты адсорбцияға әсер ету туралы 1-суретте көрсетілген жоғарғы қисық, төменгі температураға сәйкес - төменгіден жоғары тұр.
Адсорбцияның аналитикалық сипаттамасы үшін Фрейндлих эмпирикалық теңдеуді жасады:
1-сурет. Екі температура кезіндегі адсорбция изотермасы
- Т1температурасы кезіндегі изотерма
- Т2температурасы кезіндегі изотерма
a=b*p 1/n
мұндағы b және 1 / n - газ мен температура сипаттамасына және жүйеде тепе-теңдік газ қысымына тәуелді емес тұрақты.
Фрейндлих теңдеуі - параболалық теңдеу. Ол барлық изотерманы емес, оның қисық сызықты бөлімін сипаттау үшін қолданылуы мүмкін. I сызықтық сегмент үшін, тұрақты 1 / n бірге тең болуы керек.
Сонда Фрейндлих теңдеуі мына түрді алады:
a=b*p
Осылайша, төмен газ қысымындағы адсорбцияның мөлшері қысымға тікелей пропорционалды (Генри заңы) .
III көлденең қиманы сипаттау үшін тұрақты 1 / н нөлге тең болуы керек. Сонда a=b*p 0 =b.
Осылайша, Фрейндлих теңдеуі изотерманың қисық бөлігіне ғана жарамды.
ln a - ln p координаттарында бұл бастапқыдан өтпейтін түзу сызықтың теңдеуі (2-сурет) . Қисық бұрыштың тангенесі 1 / н құрайды, ал ординат осінде кесілген сегмент ln b. Фрейндлих теңдеуі тәжірибелік нәтижелерді өңдеу кезінде жиі қолданылады.
2-сурет. Логарифмдік концентрациядағы адсорбция изотремасы
Негізгі Гиббс теңдеуі қатты адсорбенттерде адсорбцияны сипаттау үшін де орынды екенін ескеру керек, бірақ бұл теңдеудің практикалық қолданылуы күрделі, өйткені "қатты зат-газ" беткейінде беттік кернеуді тікелей өлшеу мүмкін емес.
Ленгюмордың мономолекулярлы адсорбция теориясы
Біз осы теорияны сұйықтық бетіндегі ерігіштігі адсорбциясына қатысты қарастырдық. Мономолекулярлы газ адсорбциясының қатты адсорбентіне арналған теориясын әзірлеу кезінде И. Ленгмюр келесі болжамдардан тұрды:
- адсорбция бөлек адсорбциондық орталықтарда локализацияланған (молекулалар беті бойынша қозғалмайды), олардың әрқайсысы тек бір газ молекуласымен өзара әрекеттеседі; нәтижесінде мономолекулалық қабат қалыптасады;
- адсорбциондық орталықтар энергетикалық балама болып табылады - адсорбенттің бетіэквипотенциалды;
- адсорбирлеген молекулалар бір-бірімен өзара байланыспайды;
- қатты адсорбенттегі газ реакцияретінде қарастырылуы мүмкін, оның теңдеуі келесідей жазылуы мүмкін:
газ молекуласы+белсенді орталық ↔︎ адсорбционды комплекс
Газ концентрациясының (қысымының) артуымен тепе-теңдік адсорбциялық кешеннің қалыптасуына ауысады, ал еркін белсенді орталықтар кішірек болады.
Адсорбцияның тепе-теңдік тұрақтысы:

 мұнда, - кешеннің бетіндегі концентрациясы, с
В
- газ концентрациясы.
мұнда, - кешеннің бетіндегі концентрациясы, с
В
- газ концентрациясы.
4-сурет. Сатылық адсорбция изотермасы
5-сурет. Адсорбцияның S тәрізді изотермасы
Мономолекулярлық адсорбция теориясын қолданып, сатылы адсорбцияны сипаттауға болады, оның изотермасы 4-суретте көрсетілген. Изотерманың табиғаты адсорбент бетінде белсенді орталықтар топтары бар екендігін түсіндіреді, олардың адсорбциялық белсенділігіне күрт айырмашылығы бар. Осылайша, I сатысы белсенді орталықтар толтырылуына, ІІ кезеңге - келесі белсенді орталықтарды толтыру үшін және т. б.
Ленгмюр теңдеуі тек заттың адсорбциясы мономолекулалық қабаттың қалыптасуымен бірге жүрсе ғана қолданыла алады. Бұл жағдай химиялық жіктеу кезінде және газдардың физикалық адсорбциясы кезінде төмен қысымдар мен сыни температуралардан (адсорбенттің бетіндегі конденсация болмағанда) физикалық түрде қанағаттандырылады.
Тәжірибе көрсеткендей, 1 мен 2-суретте көрсетілген адсорбциялық изотермалармен бірге, S-тәрізді изотермалар бар, онда қысым осіне параллель орналасқан және адсорбент бетінің адсорбционды молекулалармен қаныққанына сәйкес келетін аймақ жоқ. Мұндай изотермалардың формасы 5-суретте көрсетілген. Осы изотермалардың табиғатын түсіндіру қажеттілігіне байланысты басқа теорияларға қажеттілік туындайды.

Бұл теңдеу Ленгмюрдің мономолекулалық адсорбциясының изотермалық теңдеуі деп аталады.
Полимолекулярлы адсорбция теориясы
5- суреттегі A нүктесінде изотерма жоғары көтеріледі, адсорбтивтің адсорбентпен байланыстыру молекулалық қабат қалыптасқаннан кейін тоқтамайтынын көрсетеді.
Мұны түсіндіру үшін 1915 жылы Поляни полимолекулярлық адсорбция теориясын ұсынды, ол да потенциалды деп аталды.
Поляни теориясының негізгі ережелері:
1) адсорбция таза физикалық күштерге байланысты;
2) адсорбенттің бетінде белсенді орталықтар жоқ, адсорбциялық күштер беткейге жақын жерде әрекет етеді және осы беткейдің жанында үздіксіз күш өрісін құрайды;
3) адсорбциялық күштер жеке адсорбциялық молекулалардың мөлшерінен асатын салыстырмалы түрде үлкен қашықтықта әрекет етеді, сондықтан адсорбент молекулалары толтырылған адсорбенттің бетіне жақын адсорбция көлемі туралы айтуға болады;
4) адсорбциялық күштердің әсері бетінің қашықтығымен азаяды және кейбір қашықтықта нөлге тең болады;
5) адсорбенттің беті арқылы берілген молекуланы тарту адсорбция кеңістігінде басқа молекулалардың болуына байланысты емес;
6) адсорбциялық күштер температураға тәуелді емес және температураның өзгеруімен адсорбция көлемі өзгермейді;
7) адсорбциялық өрістің әсерінен адсорбат молекулаларының бірнеше қабатының пайда болу мүмкіндігі пайда болады. Бірінші адсорбция қабаты үлкен тартымдылық пен қысуды бастан кешеді; онда газ тәрізді өнімдер сұйықтыққа конденсацияланады. Келесі қабаттардың ауырлығы қоршаған ортаға тығыздығы азайғанша төмендейді.
Полянадағы полимолекулалық адсорбция теориясы кеуекті адсорбенттерге адсорбцияны сипаттауға және S-тәрізді изотерманың табиғатын сапалы түрде түсіндіруге мүмкіндік береді. Алайда, бұл теория бұл изотерманы сипаттайтын теңдеудің пайда болуына алып келмеді.
Брунаэр, Эммет және Теллер булардың адсорбциясына арналған теория әзірледі. Бұл теория авторлардың атауларының бастапқы әріптеріне сәйкес БЭТ теориясы деп аталады.
Бұл теория мынадай ұсыныстарды негізге алады:
1) адсорбенттің бетінде энергетикалық баламалы белсенді орталықтар саны бар.
2) бірінші қабаттың әрбір молекуласы әрі қарай адсорбциялаудың белсенді орталығы болып табылады, бұл екінші, үшінші және т. б. қабаттар қалыптастыруға әкеледі. Бұл жағдайда кейінгі қабаттардың құрылысы бірінші толмаған жағдайда мүмкін болады;
3) бір қабаттағы көршілес адсорбцияланған молекулалардың өзара әрекеті ескерілмейді;
4) кейінгі қабаттардағы статистикалық күйлердегі адсорбциялық молекулалар сұйық молекулаларға ұқсас және бірінші қабат молекулаларынан ерекшеленеді. Осылайша адсорбцияланған саты адсорбент кешендерінің жиынтығы ретінде ұсынылуы мүмкін - молекулалық тізбектер, адсорбенттің бетімен тікелей байланысты бірінші қабат молекулаларынан бастап. Бұл жағдайда тізбектер бір-бірімен өзара әрекеттеседі.
6-сурет. БЭТ теориясы бойынша полимолекулярлы адсорбция теориясы
Брюнауэр, Эмметт және Теллер теориясы бойынша полимолекулалық адсорбция схемасы 6-суретте көрсетілген.
Осылайша, БЭТ теориясы адсорбент бетіндегі белсенді орталықтарының болуына негізделген. Бұл Ленгюмер теориясымен ұқсастығы. Алайда, Поляни теориясындай, бұл бірнеше адсорбциялық қабаттарды қалыптастыруға мүмкіндік береді.
 Брунауэр, Эммет және Теллер буларының адсорбциялық изотермалары үшін келесі теңдеуді:
Брунауэр, Эммет және Теллер буларының адсорбциялық изотермалары үшін келесі теңдеуді:
бұл теңдеуде: p s - берілген температураның бу қысымы, p/p s салыстырмалы бу қысымы.
Теңдеу БЭТ мультимолекулярлық адсорбция теңдеуі деп аталады.
Каппилярлы конденсация
Капиллярлы конденсация - қатты заттардың кеуектеріндегі будың конденсациясы.
Бұл құбылыс заттардың буларына тән және адсорбент ішіндегі кіші тесіктердің болуына байланысты. Мұндай терістіктерде булар қысымның төмендеген кезде, сұйықтықтың тегіс бетінің үстінен қаныққан булардың қысымынан бірдей температурада конденсацияланады.
Капиллярлық күштермен ұсталатын сұйықтықтың мөлшері Кельвин (Томсон) теңдеуіне сәйкес сұйылтылған будың интерфейсінің қисықтық радиусына байланысты:
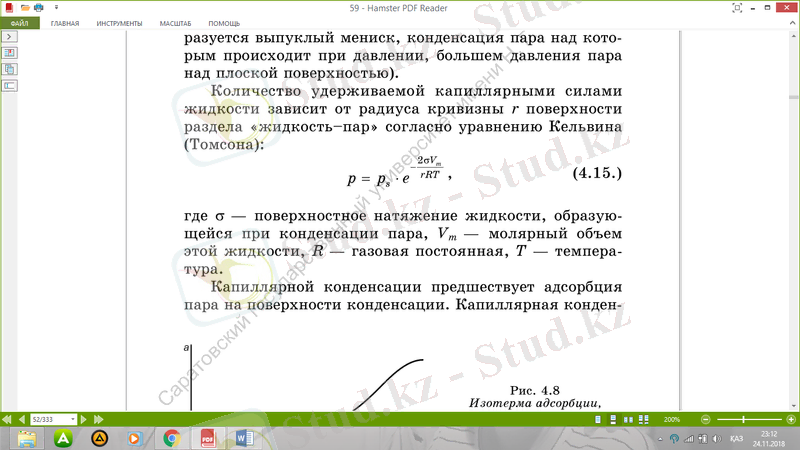
мұнда ϭ - булардың конденсациясы кезінде пайда болған сұйықтықтың беттік кернеуі болып табылады, бұл сұйықтың молярлық көлемі, R - газдың тұрақтысы, T - температура.
Адсорбция капиллярлық конденсациямен күрделенген жағдайларда адсорбция изотермасы бұрын берілгендерден ерекшеленеді. Ол 7-суретте көрсетілген
7-сурет. Каппилярлы конденсациямен жүретін адсорбция изотермасы
Капилляциялық конденсация кеуекті сорбенттер арқылы булардың қозғалуына арналған. Ол кептіру процестерінде, топырақтың, құрылыс және басқа да материалдардың ылғалды сақталуында маңызды рөл атқарады.
Газ адсорбциясының адсорбент қасиетіне тәуелділігі
Қатты адсорбенттердегі газдардың адсорбциясының ерекшеліктері адсорбент бетінің күйі адсорбцияның осы түрінде шешуші екенін көрсетеді.
Барлық адсорбенттер негізгі екі топқа бөлінеді:
1) тегіс беті бар адсорбенттер (кеуекті емес адсорбенттер) ;
2) кеуекті адсорбенттер.
Кеуекті емес адсорбенттер
Кеуекті емес адсорбенттердегі адсорбция, негізінен тәуелді:
- адсорбенттің адсорбцияға жақындығына. Бұл жақындығы күшті болған сайын, нақты байланыстарды қалыптастыру үрдісі айқынырақ. Графитталған көміртекті қара түсті полярлы емес, сондықтан полярлы емес органикалық қосылыстар оған қатты сіңіріледі. Полярлық заттар ион кристалдарының бетінде жақсы сіңіріледі (полярлы адсорбент) . Оксидтердің бетінде сутек байланыстарын құруға қабілетті гидроксил топтары бар, сондықтан олар суды, спирттерді, аминдерді және т. б қатаң ұстайды;
- адсорбенттің дисперсиясынан. Бөлшектердің өлшемі кішірек болса, оның нақты беті соғұрлым үлкен екенін есте сақтаңыз. Өнеркәсіпте, 1 г субстанция үшін жүздеген шаршы метрді құрайтын нақты беті бар, өте жоғары дисперсті ұнтақтар алынады, бірақ олардың жеңіл экссудациясы арқасында олар көбінесе полимерлер, лактар және жағармай материалдары үшін толтырғыш ретінде пайдаланылады.
Ең кеуекті емес адсорбенттерді ескеріңіз: графитталған көміртегі қара тотықтары, ақ қара көмір, аэросил.
Кеуекті адсорбенттер
Кеуекті денелер - ішкі беттік қабаттың болуына әкеліп соғатын кеуектер болып табылатын қатты заттар.
Кеуекті денелерге, сондай-ақ кеуекті емес заттарға арналған адсорбция адсорбент пен адсорбция арасындағы жеткілікті жақындығын талап етеді. Сонымен қатар, бұған байланысты:
- тері мөлшеріне;
- кеуектілігіне.
Кеуек мөлшеріне байланысты кеуекті адсорбенттер бөлінеді
а) транспорттық арналардың рөлін орындайтын макро-кеуекті
б) өтпелі кеуекті (капиллярлы кеуекті) 1, 5-100 нм диапазонында 10-500 аралығында. Бұл тесіктердің қабырғаларында төмен қысым кезінде полимолекулярлы булану адсорбциясы пайда болады, бұл қысымның жоғарылауы капиллярлы конденсациямен аяқталады. Өнеркәсіптік адсорбенттердің құрамына силикагельдер, алюминий гелдері, алюминийлік кремний гелдері жатады.
в) 500-1000 диапазонында 0, 5-1, 5 нм диапазонында микрокеуекті (адсорбирленген молекулалардың мөлшеріне сәйкес келетін кеуектің мөлшері) . Тері тесіктерінің қарсы қабырғалары бір-біріне өте жақын, олардың күштік өрісі үстіңгі қабаттасып, кеуектің көлемінде адсорбция пайда болады. Оларға цеолит және белсенді көмірсулар кіреді.
Кеуектілігі (П) - бұл кеуекті көлемінің жалпы дене көлеміне қатынасы:

кеуектілік дененің бірлігіне қарай кеуектердің көлемін анықтайды, яғни оның құрамындағы бос орындардың үлесі.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz