Биологиялық ерітінділердің электрокинетикалық қасиеттері: электрофорез, электроосмос және медицинадағы қолданылуы



«Астана Медицина Университеті» АҚ
СӨЖ
Тақырыбы: Биологиялық ерітінділердің электрокинетикалық қасиеттері. Элетрофорез. Электроосмос. Медицинадағы электрофоретикалық зерттеу әдістері.
Орындаған: Естаева Айдана Айбыновна
Тобы: 134
Факультеті: Жалпы Медицина
Қабылдаған: Таухихова Мадина Болатовна
Нұр-Сұлтан 2019
Мазмұны:
- 1. Кіріспе1. 1. Жалпы ерітінділер туралы түсінік. Ерітінділер қасиеттері.
Дисперісті жүйе туралы түсінік.
- 2. Негізгі бөлім2. 1. Биологиялық ерітінділердің электрокинетикалық қасиеттері2. 2. Элетрофорез2. 3. Электроосмос
- 3. Қорытынды
3. 1. Медицинадағы электрофоретикалық зерттеу әдістері
1. Кіріспе
1. 1. Жалпы ерітінділер туралы түсінік. Ерітінділер қасиеттері .
Диспресті жүйе туралы түсінік .
Ерітінді - екі не одан көп компонентерден ( құрамына кіретін заттар) тұратын гомогенді жүйе. Ерітінділер сұйық, қатты, газ тәріздес болады. Ең маңызды ерітінділер -сұйық ерітінділер, олар газ, сұйық, қатты заттардың сұйықтағы ерітіндісі. Адам, жануарлар, өсімдіктер ерітіндісіз өмір сүре алмайды (ас қорыту - көректік заттар ерітіндіге айналады; қан, лимфа - ерітінді) . Химиялық процестермен байланысты өндіріс салаларының барлығы ерітіндіні пайдаланады. Ерітінді еріген зат пен еріткіштен тұрады . Еріткіш еріген заттан көп болады. Көбінесе еріткіш ретінде су алынады. Ерітінділердегі бөлшектердің мөлшеріне қарай ерітінділер жүзгін ( суспензия, эмульсия) , бөлшек мөлшері (радиустары) - 10-5 - 10-3 см; коллоидты ерітінділер -10-7 - 10-5 см; шын(нағыз), молекулалық ерітінділер -10-8 - 10-7 см аралығында болады. Нағыз ерітінділерде таралып жүрген зат жеке молекулаларға не жеке иондарға дейін ұсақталады. Олар өте тұрақты, ұзақ уақыт дисперстік фаза мен дисперсиялық ортаға ыдырамайды. Біз нағыз сулы ерітінделерді қарастырамыз. Ерітінділердің қасиеттері ерітіндіні құрайтын компоненттердің концентрациясына тәуелді болады. Концентрация -еріген заттың ерітіндідегі мөлшерін көрсетеді. Егер ерітіндінің концентрациясын сандық мөлшермен көрсетпесе, оларды қанықпаған, қаныққан, аса қанық, сұйық, қою, концентрленген деп бөледі. Қанықпаған ерітінді - еріген заттың жаңа мөлшерін әлі еріте алатын ерітінді. Қанық ерітінді - белгілі бір температурада затты одан әрі еріте алмайтын ерітінді. Аса қанық ерітінді - сол температурадағы ерігіштігіне сәйкес еруге тиісті мөлшерден артық затты еріген күйде ұстай алатын ерітінді. Аса қанық ерітінді тұрақсыз, еріген заттың аз мөлшерін ғана ерітіндіге салса, артық еріген зат тез кристалданады. Сұйық ерітінді - еріген зат аз ерітінді. Қою ерітінді - еріген зат көп ерітінді Концентрленген ерітінді - өте қою ерітінділер. Ерітіндідегі еріген заттың мөлшерінөлшемсіз бірлікпен - үлес не пайызбен, не өлшемді шамамен - концентрациялармен көрсетеді: Массалық үлес ( С) - еріген заттың массасының ерітіндінің жалпы массасына қатынасы; Мольдік үлес ( Ni ) -еріген заттың ( не еріткіштің) мөлшерінің ерітіндідегі барлық заттар мөлшерлерінің қосындысына қатынасы, егер n1 және n2 - еріткіш пен еріген зат мөлшері болса ( тек бір ғана зат еріген болса) , онда
N2 = n2 /(n1 + n2) ;
N1 = n1 / ( n1 + n2 )
мұндағы N2 және N1 еріген зат пен еріткіштің мольдік үлесі. Молярлы концентрация ( См) не молярлылық ( М) - еріген заттың мөлшерінің ерітінді көлеміне қатынасы, моль/л Моляльды концентрация не моляльдылық ( m ) -ерігензаттың мөлшерінің еріткіш массасына қатынасы,
моль / кг ( Н2 О)
Эквиваленттің молярлы концентрациясы, Сн ( нормальность) - еріген заттың эквивалентінің санының ерітінде көлеміне қатынасы, моль / л.
Дереккөзі: https://www. qazbrand. info/all/1474/eritindiler-eritindiler-koncentrac/
Ерігіштік. Қаныққан ерітіндідегі еріген заттың шамасы - ерігіштік деп аталады. Заттардың ерігіштігі еритін зат пен еріткіштің табиғатына, температураға, ал газдар үшін қысымға да тәуелді болады. Қатты және сұйық заттың ерігіштігін ерігіштік коэффициентімен (К) көрсетеді, яғни 100 г еріткіште қанық ерітінді түзгенге дейін ери алатын заттың массасы. Газдардың ерігіштігін абсорбция , ол - еріткіштің бір көлемінде қанық ерітінді түзілгенге дейін еритін газдың көлемі көрсетеді. Генри заңыбойынша тұрақты температурада сұйықтың берілген көлемінде еріген газ массасы сол газдың парциал қысымына тура пропорционал. Оның математикалық өрнегі :
с = k × P,
мұндағы с - газдың ерігіштігі, моль/л; Р - газдың парциал қысымы, атм; k - пропорционалдық коэффициент, не Генри коэффициенті, моль/л×атм. Генри заңынан газдың еритін көлемі (яғни абсорбция коэффициенті) сол (берілген) температурада газдың парциал қысымына тәуелді емес екендігін көруге болады. [1]
Газдар қоспасының еруі Дальтон заңына бағынады: қоспадағы әр газдың ерігіштігі оның парциал қысымына тура пропорционал. Қатты заттардың суда еруі көбінесе эндотермиялық процесс, себебі көп жағдайда гидратация кезінде кристалдық торларды бұзуға жұмсалатын энергиядан аз энергия бөлінеді. Осы екі шаманың қатынасы ерудің жалпы жылу эффектісін ( ± Q) анықтайды. Егер Q мәні оң болса, қатты заттардың ерігіштігі температураны көтергенде, азаяды, теріс болғанда - артады. Ерігіштіктің температураға тәуелділігін график түрінде бейнелесе - ерігіштік қисығытұрғызылады, одан заттарды қайта кристалдап тазалағанда алынған заттың шығымын не жоғалтылған мөлшерін анықтайды. [1]
Дисперісті жүйе туралы түсінік:
Ағылшын химигі Томос Грим (1860 ж) желім, желатин, альбумин және крахмал сияқты заттар, кәдімгі ерітінділерден пергамент немесе колладийден дайындалған жарғақтан өту қаблеті бойынша өзгеше болатындығын табады. Егер колладиден жасалған шағын дорба ішекке қант пен желім ерітіндісін салып, осы дорбашаны ағынды суға салса, дорбаша қабырғасынан қант ерітіндісі жеңіл өтеді де желім дорбашада қалып қояды. Мұндай әдісті диализ (сүзу) дейді. Өтпей қалатын заттарды гректің « коllа» - «желім» деген сөзіне баламалап коллоидтар деп атайды. Томос Грим дисперстік жүйенің қасиетін зерттейтін коллоидты химияның негізгі қалаушы.
Шын ерітінділер- гомогенді жүйелер, ондағы бөлшектер ион, атом және молекула 5 км жоғары өлшемінде болады. Жүйедегі бөлшек өлшемдерін бірнеше ондаған есе үлкейткенде гетерогенді жүйеге айналады. Мұндай жүйелерді дисперістік ( ұсақ, майдалық) жүйелер дейді, ол екі фазадан тұрады: дисперісті орта және дисперісті фаза (дисперісті ортада аса ұнтақталған бөлшектер) .
Дисперіістік жүйенің маңызды сипаттамасы дисперістік дәрежесі, яғни дисперістік фаза бөлшектерінің орташа өлшемі. Барлық жүйелер дисперістік дәрежесі бойынша бөлінеді .
1. Молекулалы- дисперісті, ондағы зат бөлшек тері ион, атом, молекула түріне жүреді .
Бұл шын ерітінділер.
2. Дисперісті немесе ірі дисперісті жүйелер, ондағы бөлшектер өлшемі 10 -6 м дейін, олар турақсыздану және уақыт өткен сайын дисперістік фазаға дисперістік ортаға бөлінеді:
3. Жоғары дисперісті немесе коллоидты жүйелер ондағы бөлшектердің орташа диаметрі 10 -6 -10 -9 м аралығында, бұлар едәуір тұрақты.
Дисперістік орта мен дисперістік фазаның агрегаттық күйіне байланысты дисперістік жүйе түрлері болады.
Дисперістік жүйелер арасындағы коллоидтық ерітінділердің (зольдердің) орны ерекше-ол дисперістік орташа сұйық жоғары жүйе коллоидтық бөлшектерді мелцилла дейді.
Мелцилла құрылысын аса суйық күміс нитраты мен калий йодиді ерітінділерді әрекеттескенде амияктың, күміс йодідінің коллоидты ерітіндісі түзілуі мысалында қарастырайық:
Аg NO 3 +KI= Ag I + KNO 3
Ag + + NO - 3+ K + + I - = Ag I+ K + + NO - 3
Ерімейтін күміс йодиді коллоидты бөлшектің ядросын- күміс йодиды микрокристалын түзеді және ол AgI көптеген m молекуласынан тұрады:
m (AgI ) - коллоидты бөлшектің ядросы.
Ядроның бөлшек қабығына ерітіндіде бар иондарының бірі берілген жағдайда, не күміс иондарының, не йод иондарының біреуі адсор бцияланады. Егер коллоидты ерітінді калий йодиді артық кезінде алынса, онда ядро йод иондар адсорбцияланады. Олар ядроның торын толықтыра аяқтап, адсорбциялық қабат түзік және ядроға өз зарядын беріп, оны теріс зарядтайды:
m [Ag I] nI -
Ядро бетіне адсорбцияланып, оған тиісті заряд беретін иондарды потенциал анықтаушы иондар деп атайды. Сондай-ақ ерітіндіде потенциал анықтаушы иондарға таңбасы бойынша кері болатын иондар да бар, оларды қарсы иондар деп атайды . Біздің мысалдағы иондар, ол калий катиондары К+, оны адсорбциялық қабаттағы потенциал анықтаушы иондары электростатикалық таратады. Қарсы иондардың К + белгілі бөлімі адсорбциялық қабатқа енеді. Ядро мен адсорбциялық қабатты гранула
( түйір) деп атайды.
{m [Ag I] n I - (n x) K + } X -
Ядро адсорбциялық қабат
Гранула
Қарсы иондардың қалған бөлшектері иондардың диффузиялық қабатын құрайды. Адсорбциялық және диффузиялық қабаттармен бірге ядро электр бейторапты бөлшекті - мицелонны құрайды:
{ m [Ag I] nI - (n-x) K + } x- XK +
Гранула Диффузиялық қабат
Мицелла
Коллоидты ерітінділерге (зольдерге) электрометті қосқанда түйір заряды, бұл бөлшектердің жабысуына әкеледі. Осылайша колоидтық бөлшектердің үлкен агрегатқа айналуын үю ( коагуляция) да.
Үю нәтіжесінде бөлшектер не салмақтық күш әсерінен түнбаға түсуі мүмкін ( бұл процесті седиментация дейді) . Не жартылай қатты сертімді массаға ( гель не сіркер) айналуы мүмкін.
Коллоиидты ерітінділер организмдердің тіршілігінде үлкен рөл атқарады және әртүрлі технологиялық процестерде кезінен қолданылады : сабын қайнатуда, қағаз тоқыма өнеркәсібінде, дәрі-дәрмек және т. б өндірістерде.
Дисперсті деп газ, сұйық не қатты ортада тіркелкі таралған көптелген ұсақ бөлшектерден тұратын жүйелерді айтады. Дисперісті жүйелерге, мұнан басқа, түтікшелі- кеуек денелер ( топырақ, тау жыныстары, катализаторлар) да жатады. Дисперісті сөзі латынның «dispezsus» - ұнтақталған, майдаланған сөзінен туындайды. . Кез-келген заттың майдалану дәрежесін дисперістілік ( Д ) шамасымен сипаттаймыз. [2]
Д= 1 ; ( см -1 )
а
Демек дисперістілік-ұнтақталған бөлшектің диаметрінің немесе көлденең қимасының ұзындығының (а) кері шамасымен анықталады. Бөлшектің дисперістілігі артқан сайын оның меншікті беттік ауданы ( S меншік) да артады. Барлық дисперісті жүйелерге тән негізге екі белгі бар: жоғары дисперістілік ( майдалану) және гетерогенділік.
Дисперісті жүйелердің гетерогенділігі мынадан көрінеді: олар өзара ерімейтін кем дегенде екі фазадан тұрады.
1. Дисперісті фаза -ұнтақталған ұсақ бөлшектер.
2. Дисперісті орта- дисперісті орта, фаза бөлшектерін кіркелкі таратушы газ, суйық, не қатты зат.
Дисперісті жүйелерді әртүрлі белгілеріне байланысты жіктейміз.
А) Бөлшек өлшеміне байланысты жіктеу. Бөлшектердің ұнтақталу дәрежесіне байланысты дисперісті жүйелерді 3 топқа бөлеміз:
1. Ірі дисперісті жүйелер ( жүзінділер, супензия, эмульсия, ұнтақтар) бөлшектер радиустары 10 -2 - 10 -5 см
2. Коллоидтық- дисперісті жүйелер ( зальдар), бөлшектер радиустары 10 -5 -10 -7 см.
3. Момпулалық- иондық ерітінділер, бөлшектер радиустары 10 -8 -10 -10 см
Адам қанының этритроциттері (0, 7 10 -7 см ), ішек таяқшалары (0, 3 10 -7 см), тұмау вирусы (1 10 -7 м), алтын залы ( 1 10 -8 м), колоидты- диперісті жүйелерге жатады.
Дисперістілік жүйесінің негізгі қасиеттеріне ( кинетикалық, оптикалық, каталиттік) қатты әсер етеді. [2]
2. Негізгі бөлім
2. 1. Биологиялық ерітінділердің электрокинетикалық қасиеттері
Электрокинетикалық құбылыстар деп- электр тоғы қатысатын, екі фазадан салыстырмалы қозғалуы кезінде гетерогенді жүйелерде пайда болатын процестерді айтады.
Мұны 1807 жылы Ф. Ф. Рейсс ашқан.
Электрокинетикалық құбылыстардың себебі-ҚЭҚ болуы және грануланың диффузиялық қабатқа қатысты оңай ығысуы. Электр өрісі әсер еткенде мицелла адсорбциялық және диффузиялық қабаттар шекарасында ( бұл шекара жылжу қабаты деп атайды) екіге бөлінеді: гранула бір плюске қарай қозғалады( электрофорез) , диффузиялық қабат иондары екінші плюске өзімен бірге гидратты қабықшаны ілестіре қозғалады
Электрокинетикалық қасиеттер мыналар
1. Электрофорез- сыртқы электр өрісі әсерінен дисперістік фазаның зарядталған бөлшектерінің дисперісті ортаға қатысты қозғалуы.
2. Электроосмос - дисперісті ортаның дисперісті фазаға қатысты сыртқы электр өрісінің әсерінен қозғалуы.
3. Сұйықтықты қысым арқылы түтікшелі жүйеге еңгізсек онда оның ұштарында потенциалдар айырымы түзіледі, ол ағу потенциалы деп аталады.
4. Коллоидты бөлшектер сұйық ортада шөккенде сұйықтықтың жоғарғы және төменгі қабатттары арасында потенциалдар айырымы түзіледі, оны шөгу (седиментация) потенциалы деп атайды.
Ағу потенциалы электроосмосқа, ал шөгу потенциалы электрофорезға кері құбылыс.
Өткізу әдістемесіне байланысты электрофорез қозғалмалы шекаралы қабаттағы (тиземиустың бос электрофорезі) және зондты электрофорез (қағаз, желім т. б сияқты тасымалдағыштарды қолдану) деп бөлінеді.
Ақсылдар, бактериялар, вирустар заряды бар, сандықтан буферлы ерітіндіде электр өрісінде қозғалады, қозғалу жылдамдығы бөлшек радиусына және зарядына тәуелді.
Сондықтан электрофорез медицина мен биологияда кеңінен қолданылады. Электрофорез көмегімен макромолекулалар қоспасының (мысалы, қанның сары суының ақсылы, жұлын сұйықтығы, несеп. т. б. ) бөлінуі және талдауы бақылауда қолданылады, себебі қан сары суының ақсылдарының әр түрлі патологиялық жағдайларда сол ауруға тән күрт өзгерістер байқалады. Дәрілік заттардың электрофорезі электротерапия тәсілі ретінде көптеген ауруларда емдеуде бұрыннан қолданып келеді (мысалы, күйік жараларды, атеросклероз, ревматизм, жүйке-психикалық ауруларды т. б) жарақаттанбаған тері арқылы дәрілік затты енгізу оның науқас ағзасына ұзақ әсерінен қамтамасыз етеді.
Электрофоретикалық әдіспен ақсылдардың изоэлектрлік нүктесін анықтайды.
Быз қатысындағы (мысалы, натрий додецилсульфаты) ақсылдардың молекулалық массасын табу үшін қолданады. [2]
2. 1. Электрофорез
Адам денесіне бекітілген электродтар арқылы, оның ағзасына емдік мақсатта күші мен кернеуі төмен тұрақты тоқпен әсер етуді гальванизация деп, ал электр тогы көмегімен дәрілік заттарды адам терісі арқылы ішкі мүшелерге жеткізуді электрофорез деп атайды. Шын мәнінде, көп жағдайларда осы екі әдіс бір мезгілде жүргізіледі. Адам терісінің электрлік кедергісінің өте жоғары болуы себепті, адам ағзасына ток негізінен май мен тері бездері, жасуша аралық кеңестік арқылы енеді. Ток эпидермис пен тері асты май қабатынан өткен соң одан ары жасуша аралық бос кеңестік қан мен лимфа тамырлары бойымен, нерв және бұлшық ет қабықтары арқылы тарап, электродтар орналасқан аралықтағы ойша сызылған түзуден көп ауытқиды. Осы құбылыс нәтижесінде ұлпаларда иондық асимметрия қалыптасады., яғни катодта К+, Na+,
анодта Ca 2+, Mg2+ иондарының концентрациясының басымдығы орнайды, нәтижесінде катод қоздырушы, ал анод электроды тежеуші әсер етеді. Сонымен қатар ұлпадағы байланысқан иондардың біраз бөлігінің еркін күйге көшуіне байланысты олардың белсенділігі артады, соның арқасында ұлпаның физиологиялық белсенділігі артады, яғни гальванизацияның ынталандырушы қабілетінің сыры осы болып табылады, сондай-ақ электроосмос құбылысы да байқалады. Осы аталған құбылыстар ол өз кезегінде жасушыдағы құбылыстарға, ондағы биофизикалық, биохимиялық және физиологиялық процестердің жүру жылдамдығына әсер етеді. [2]
2. 3. Элетроосмос
Ұсақ саңылаулы денеде сұйықтық бағытталған ауыспалылығы потенциалдардың қосымша тіркелген айырым әрекеті астында электроосмоспен аталады. Қарап шығамыз, мысалы, капиллярда электроосмотическое электролит сырғанауы немесе мембрана уақыттарында. Анықтық үшін қабыл аламыз, не беттерге жағымсыз иондарды сорылып алынған, бекітілген, ал беті бойлай бағытталған дұрыс иондар ДЭС диффузды бөлім Е сыртқы даласын қалыптастырады. Электро статикалық күш, ДЭС диффузды бөлім кез келген өз бетімен элементіне жұмыс істейтін, беті бойлай мына элементті қозғалыс деп атайды. Қуат тығыздығы сондықтан ДЭС ф диффузды бөлімдері (х) х бетіне дейін ара қашықтықтың тәуелділігінде алмастырады сұйық электролит жайылып қойылған қабаттары әр түрлі жылдамдықтармен әрекеттенеді. Стационарлық күй-жағдайға (өзгермейтін уақыттардың ағым жылдамдықтары), қабаттан әр қандай ара қашықтағы, сұйықтық қабаттарының әр түрлі жылдамдығы әсерінен пайда болатын сұйықтықтың жапысқақтық қарсылық күшімен, сұйықтықтың кез-келген қабатындағы электростатикалық күштер бір-бірін компенсациялаған жағдайда қол жеткен болады.
Диэлектрикалық енуі
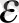 болатын және тұрақты жапысқақты
болатын және тұрақты жапысқақты
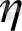 сұйықтықтың жылдамдығын сипаттайтын гидродинамикалық теңдеу нақты шешімін тапқан. Шешімдің нәтижесі ағым жылдамдығының тең бөлінуі болып табылады.
сұйықтықтың жылдамдығын сипаттайтын гидродинамикалық теңдеу нақты шешімін тапқан. Шешімдің нәтижесі ағым жылдамдығының тең бөлінуі болып табылады.
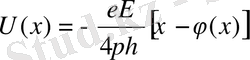 (1)
(1)
Мұнда
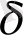
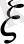 - сырт қабаттан ара қашықтағы сүйықтықтың жылдамдығы о ге айланатын жағдайдағы электрлік потенциалдың мәні
- сырт қабаттан ара қашықтағы сүйықтықтың жылдамдығы о ге айланатын жағдайдағы электрлік потенциалдың мәні
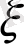
Сурет1 .
Сырт қабатыдан улкен ара қаштықта Ф(х) 0 және ағымдың жылдамдығы диффузиялық бөлімнен шетте болған жағдайда ДЭС тұрақты болады.
U s =
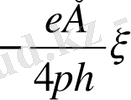 (2)
(2)
Бұл тұрақты мөлшер электроосмотикалық сырғану жылдамдығы деп айтылады.
Екі есе электрлік қабатта потенциал таратуы беттің х-ара қашықтықтығы. Мынау сырғанау электроосмотикалық тұрақты мөлшер жылдамдықпен аталады. Сондай ат енгізілген болатын себебі ДЭС жуандықтарына арналған, электролитпен капиллярлардың аз мөлшерлері көп немесе дисперсиялық фаза қатты кішкентай бөлшектерінің U s , жылдамдығымен қатты бетті бойлай сұйықтыққа сырғанау сияқты ағым көрінеді. Параметр дзета - потенциалмен аталады, электр кинетикалық құбылыстардың негізгі қасиеттері болып саналады. Нақты жуйелерде, жабысқақтық және сұйықтықтың диэлектрлік өткізгіштігі қатты бетке дейін ара қашықтыққа тәуелді болады. Осындай жағдайларда да электроосмотикалық сырғану жылдамдығынада (2) өрнек сияқты сипаттауға болады. [2] Бірақ, параметрының интерпретациясы күрделене барады, бұның себебі ол ДЭС тың диффузия бөліміндегі электростатикалық потенциалдың таралуы туралы ақпаратты өзінде алып жүріп қалмай, сұйықтық құрылымдық ерекшеліктерімен сұйықтықтың қабаттармен шектес жеріндегі реологиялық әрекеттері туралы ақпаратты да береді. -потенциал интерпретациясының күрделі болуына қарамай, ол суюқ коллоид жүйелерінің негізгі қасиеттерінің бірі болып қала береді.
Түсіндірулер -потенциал қиындығына байқаусыз, ол сұйық коллоид жүйелердің өте маңызды мінездемелерінен біреудің келеді. Оның мағынасы және өзгерту мінез-құлығы электролит параметрлерінің түрлендіруі жанында, әртүрлі заттардың беттеріне адсорбцияның және бетпен ІІ. т. шектес қабаттардың құрылымы туралы, ерітінді компоненттерінің әрекеттестік ерекшеліктерінде соттауға рұқсат етеді, бет қуатында және д. т. сонымен қатар, айтылу (1) жылдамдыққа арналған сырғанау өз бетімен геометрия капиллярларына арналған әділ шарт жанында, не ДЭС жуандығы капилляр радиусымен салыстыруда аз.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz