Фосфордың таралуы, аллотропиялық түрлері, физико-химиялық қасиеттері және маңызды қосылыстары


Мазмұны:
Кіріспе. 1
І Фосфордың жалпы сипаттамасы
1. 1. Фосфордың тарауы. 2
1. 2. Фосфордың аллотропиялық түр өзгерістері. 4
1. 3. Фосфордың физикалық - химиялық қасиеттері. ………. 7
1. 4. Фосфордың алынуы және қолданылуы. 9
ІІ Фосфордың маңызды қосылыстары. 14
2. 1. Фосфор қышқылдары. 16
2. 2. Фосфор тыңайтқыштары . . . 23
2. 3. Фосфор оксидтері . . . 32
Қорытынды35
Пайдаланылған әдебиеттер . . . 36
Фосфор VA топ элементі.
Оның электрондық формуласы: 15 Р 1s 2 2s 2 2р 6 3s 2 2p 3 .
Графиктік формуласы:
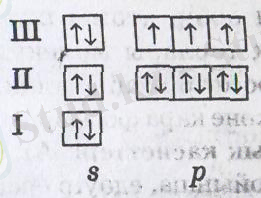
Фосфор - азотқа ұқсас, бірақ азот атомымен салыстырғанда фосфор атомының өлшемі үлкен және иондану энергиясы аз. Бұл азотқа қарағанда фосфордың бейметалдық қасиеттері әлсіз екенін білдіреді. Сондықтан фосфорда -3 тотығу дәрежесі сирек, +5 тотығу дәрежесі жиі кездеседі.
Табиғатта таралуы. Бұл едәуір көп таралған элемент, оның жер кыртысындағы мөлшері 0, 12%. Фосфор белсенді, табиғатта бос күйінде кездеспейді, тек қосылыстар құрамында болады. Қосылыстарының ең маңыздысы кальций фосфаты-апатит минералы. Алатиттің бірнеше түрі белгілі. Ең көп таралғаны фторапатит ЗСа 3 (Р0 4 ) 2 · СаҒ 2 Апатиттің бір түр өзгерісі шөгінді тау жыныстары - фосфориттерді түзеді. Фосфор, сонымен бірге әр түрлі қосылыстар түрінде белокты заттардың құрамына кіреді. Ми ұлпасындағы фосфордың мөлшері 0, 38%, бұлшық етте - 0, 27%. Фосфор сүйекте, адамдардың және жануарлардың қанының құрамында, өсімдікте болады. Ересек адамның организмінде 1 кг-ға жақын фосфор болады.
Фосфорға өте бай кен орындары Қазақстанда да бар. XX ғасырдың 30-жылдарының басында Ақтөбе облысында ірі фосфорит кен орны табылған. Онда қышқылдармен және негіздермен фосфориттің жалпы қоры жүздеген миллион тоннаға жететін ондаған кен орындары бар.
І Фосфордың жалпы сипаттамасы
1. 1. Фосфордың тарауы
1938-1940 жылдары Жамбыл облысында Қаратау бассейні ашылды. Бассейінде 26 кен орны бар. Бассейннің басты бес кен орындарында (Жаңатас, Ақсай, Шолақтау, Көкжон, Көксу) бүкіл қордың 90%-ке жуық мөлшері шоғырланған. Бассейннің ең бай шикізатында 28-34% Р 2 0 5 бар. Қаратау фосфорит қабатының қалыңдығы 10-12 м, ал кейбір орындарда 30 м-ге дейін жетеді. Оңтүстік Қазақстанда Аят және Лисаковск кен орындарындағы қоңыр тас көмірдің құрамында фосфордың едәуір қоры бар. Фосфор жер қыртысында әжептәуір мөлшерде болады, бірақ өте тотыққыш болғандықтан, дербес күйінде кездеспейді. Қосылыстарының маңыздысы фосфорит деген минерал, оның негізі фосфор қышқылының кальций тұзы - Саз(Р0 4 ) 2 Фосфорит әр жерлерде кен түрінде кездеседі. Совет Одағында фосфорит Жамбыл қаласының жанындағы Қаратау өңірінде, Ақтөбе маңында т. б., жерлерде бар. Қаратау жер жүзіндегі фосфоритке өте бай жердің бірі, әрі сапасы өте жоғары. Фосфордың табиғи қосылысының тағы бір маңыздысы апатит деген минерал, оның негізі
Са 5 Х (РО) 2 не Са 3 (Р0 4 ) 2 ·2СаХ 2 ,
мұндағы Х = Ғ кейде С1 - не ОН - . Совет Одағында апатиттың өте көп жерін, 1926 жылы акад. А. Е. Ферсман мен Л. Н. Лабунцов, Кола түбегінен, Хибинск деген жерден тапқан.
Фосфор өте маңызды элемент, өйткені ол өсімдікпен жануарлардың да белоктарының құрамына кіреді; өсімдік дәнінің, жануарлардың - сүт, қан, ми және нерв талшықтарының құрамында болады. Онымен қатар сүйектері құрамында Са 3 (Р0 4 ) 2 түрінде болады.
Тарихынан. XVII ғасырдың алхимигі Геннинг Бранд (Германи Гамбург, 1669) жастық элексирін іздеу талабында адам несебін көп етіп жинап, қайнатып суалтып, құрғатып құм және ағаш көмірін араластырып, ауа қатынастырмай өте күшті қыздырып, ақтығында бір қызық зат алады, онысы қараңғыда жарқырайды, ыстық суға тастаса «бу» шығарады, ол буы ауада тұтанып кетеді т. б. Бұл жаңа зат көп жұртты қызықтырды. Бранд өзінің бұрынғы саудагер көпестігіне тартып осындай тәжірибелер көрсеткені үшін ақы алды, жаңа заттың болмашы мөлшерін көп алтынға сатты. Біраз уакыт өткен соң Бранд фосфорды жасау құпиясын Дрезден химигі Крафтқа сатады ол да қала-қаланы аралап Брандтың кәсібімен көп ақша жинайды. Мұнан II жыл кейін Боиль (Англия) фосфор алудың әдісін табады, ол да одан пайда шығармақ болыпты, бірақ мақсатына жете алмай қайтыс болады. Боильдың ассистенті Гауаквиц жеке ғалымдарға, ғылыми мекемелерге фосфорды сатып көп байлық жинап алады.
1743 жылы химик А. Марграф фосфор алудың оңай әдісін тауып, оны жариялайды, содан бастап «фосфор саудасы» тыйылады «фос» грек тілінде жарық, «феро»- әкелем деген сөздер. Фосфор қараңғыда жарқырайтындығынан «жарык әкелуші»- фосфор деп аталған.
Алу жолы . Фосфорды бос күйде алу үшін фосфоритті құм және көмірмен араластырып электр пеште (1-сурет) 1500°-қа дейін қыздырады, онда болатын реакциялардың жалпы теңдігі былай жазылады:
Ca 3 (P0 4 ) 2 + 3Si0 2 + 5C = 3CaSi03 + 5CO + 2P.
ΔН°= 1359, 8 кДж/моль
Бөлініп шыққан фосфор буы салқындатылып, қатты күйге аударылған фосфор, судың астына жиналады.
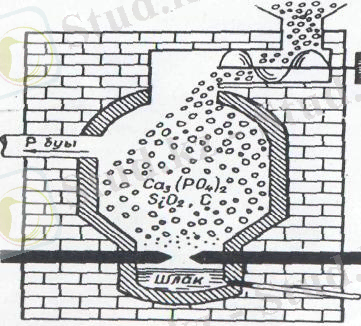
1-сурет. Фосфор алынатын электр пештің схемасы.
1. 2. Фосфордың аллотропиялық түр өзгерістері
Фосфордың екі аллотропиялық түрі бар: ақ және қара фосфор, алайда олардың арасында - күлгін, қызыл түрлері бар.
Фосфордың атомдары Р 2 , Р 4 , не Р 2 ∞ полимерлі молекула болып бірігеді.
Р 2 молекулалары N 2 сияқты құрылған, бірақ 1000° С жоғары температурада ғана тұрақты, 2000° С артық температурада атомға ажырайды. 1000° төмем жағдайда Р 4 молекулалары тұрақты, олар тетраэдр тәрізді болады (2-сурет) .
Ақ фосфор (d - модификация) фосфор буын тез салқындатқанда түзіледі, қатты кристалдық зат, меншікті салмағы
1, 82°, t 6 ° С = 44, 1, / к ° С = 275
сұйық бу күйінде 1000°-қа дейін молекуласы Р 4 одан жоғары температурада Р 2 айналады.
Ақ фосфор таза күйінде түссіз болады, бірақ сатудағы ақ фосфор сарғылт тартқан балауыз тәрізді болып келеді. Төмен температурада морт сынғыш, 15°-тан жоғары жұмсап, пышақпен оңай кесіледі. Ауада оңай тотығады, әрі қараңғыда жарық шығарады, сәл қыздырса, мысалы үйкесе болғаны, жанып кетеді, жанғанда көн жылу бөліп шығарады. Фосфор ауада тотыға келіп, шыққан жылудың әсерінен өзінен-өзі жануы да мүмкін. Ақ фосфорды тотығудан сақтау үшін су астында сақтайды: суда ол ерімейді, көміртек дисульфидінде, бензолда ериді.
Ақ фосфор - өте күшті у, өзіне тән исі болады.
Ақ фосфорды 280-340°-қа дейін ауаның қатысынсыз қыздырса, аллотропиялық екінші түрі - қызыл фосфорға айналады. Ақ фосфорды ұзақ сақтаса, жарықтың әсерінен біртіндеп, өте баяу қызыл фосфорға айналады, сатудағы ақ фосфордың сарғылт болуы осыдан.
Р 4 молекуласында валенттік бұрыш 60°, яғни р электрондардың әдетте түзетін бұрышынан көп кіші. Сондықтан Р - Р байланысы оңай үзіледі. Ақ фосфордың актив болуы, сақтағанда полимерлі молекулаға айналуы да осыдан.
Қызыл фосфор, ақ фосфордан өзгеше оны балкытуға болмайды, қыздырса, бірден буға айналады (416°), буын жинап салқындатса, ақ фосфорға айналады; ауада өте баяу тотығады, қараңғыда жарық шығармайды. 260°-қа дейін қыздырғанда ғана жанады, күкіртті көміртегінде де, бензолда да ерімейді, улы емес. Меншікті салмағы 2, 20. Қызыл фосфордың молекуласы ақ фосфордың күрделі полимері деп есептеледі.
Қызыл фосфор ешбір еріткіште ерімейтін болғандықтан, оның молекулалық салмағы анықталған жоқ. Ерімейтіндіктің бір себебі макромолекулалар, өте қомақты үлкен болғандықтан ерітіндіге көше алмайды, екінші себебі макромолекуладағы атомдарды біріктіріп тұрған валенттікті үзуге еріткіштің шамасы келмейді.
Қара фосфорды алу үшін ақ фосфорды 200°-та және 1, 2 · 10 10 Па қыздырады. Соңғы кезде қысымсыз сынап катализаторының жәрдемімен алатын болды. Қара фосфорда атомдар коваленттік байланыс арқылы алты бұрыш жасайды. (2-сурет) Олардан макромолекула түзіледі. Қара фосфор графитқа ұқсайды, р = 2, 7, шала өткізгіш.
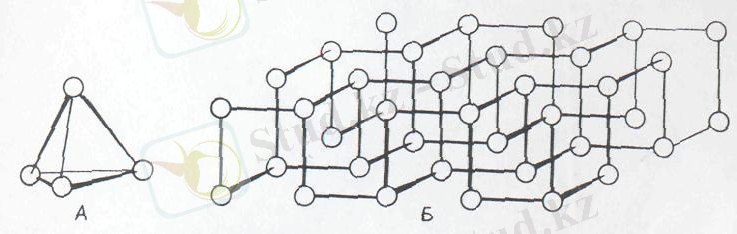
2-сурет. А -ақ фосфордың, Р 4 Б - қара фосфордың құрылымы.
X и м и я л ы қ қасиеті жағынан фосфор өте реакцияласқыш элемент, көпшілік заттармен тікелей қосылысады, әрі көп мөлшерде жылу бөліп шығарады. Оттек, галогендер, күкірт және бірсыпыра металдармен өте оңай қосылысады.
Осы арада айта кететін бір мәселе жай заттардың активтігі олардың құрылымына өте тәуелді. Айталық азоттың электр-терістігі (3, 04) фосфордан (2, 19) жоғары, бірақ азотқа қарағанда ақ фосфор анағұрлым активті. Азот тотығу үшін 3000° қызу керек, ал ақ фосфор кәдімгі температурада тұтанып кетеді. Бұлай болу себебі азоттың молекуласы берік, оның атомдары үш байланыспен (N=N) біріккен, ал Р 4 молекуласында (2-сурет, А) атомдар бір байланыспен ғана ілініскен. Мұндағы Р = р байланыс энергиясының шамасы бар болғаны 200 кДж/моль.
Қолданылуы. Фосфор көп мөлшерде шырпы өндірісінде қолданылады. Ақ фосфор жанғанда будақ-будақ қалың қабатты ақ түтін (фосфор (V) оксиді) түзіледі, сондықтан оны «түтін шымылдығын» жасау үшін снаряд, бомбаларға салады. Зиянкес жәндіктерге қарсы дәрі жасауға фосфор-органикалық препараттар синтезіне қолданылады.
1. 3. Фосфордың физикалық-химиялық қасиеттері
Физикалық қасиеттері . Азотпен салыстырғанда фосфор элементінің бейметалдық қасиеттерінің кемуі, түзетін жай заттардың қасиеттеріне әсер етеді. Мәселен, азоттан ерекшелігі фосфордың бірнеше I аллотропиялық түр өзгерісі бар: ақ қызыл, қара және т. б. Олармен бұрын танысқансыңдар.
Фосфордың аллотропиялық түр өзгерістерінің қасиеттері, олардың құрылысымен түсіндіріледі. Ақ фосфордың құрылысы, толығырақ зерттелген. Оның молекуалалық кристалдық торы бар. Ақ фосфордың молекуласы төрт атомды және дұрыс үш қырлы пирамида тәріздес. Фосфордың әрбір атомы пирамиданың төбелерінде орналасқан. Кристалдық торлары молекулалық типке жататын басқа заттар сияқты ақ фосфор жеңіл балқиды және ұшқыш. Қызыл және қара фосфорды қатты қыздырғанда бірден буланады.
Химиялық қасиеттері . Ақ фосфор қызыл фосфордан химиялық қасиеттері бойынша, едәуір ерекшеленеді. Мәселен, ақ фосфор ауада жеңіл тотығады және өздігінен тұтанады, тек оны су астында сақтайды. Қызыл фосфор ауада тұтанбайды, бірақ 240°С-тан жоғары қыздырғанда тұтанады. Ақ фосфор тотыққанда қараңғыда жарық шығарады - химиялық знергияның тікелей жарық энергиясына айналуы жүреді. Сұйық және еріген күйінде, сондай-ақ 800°С-тан төмен температурада, бу күйінде фосфор Р 4 молекуласынан тұрады. 800°С-тан жоғары температурада қыздырғанда, -молекула диссоциацияланады:
Р 4
Соңғысы 2000°С-тан жоғары температурада атомдарға ыдырайды. Осылай фосфор атомдары Р 2 , Р 4 молекулаларына және полимерлі затқа бірігеді.
Фосфор көптеген жай заттармен - оттекпен, галогендермен, күкіртпен және кейбір металдармен, қышқылдармен, негіздермен тотықтырғыш және тотықсыздандырғыш қасиеттер көрсетіп қосылады. Мысалы:
2 Р + 3 S = P 2 S 3
2 P + 3 Cl 2
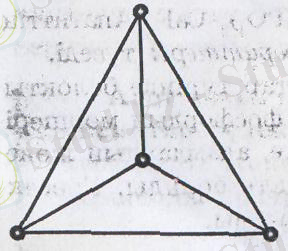
3-сурет. Ақ фосфор молекуласының құрылысы
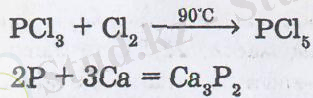
Қызыл фосфорға қарағанда ақ фосформен реакция жеңіл жүреді. фосфордың металдармен қосылысы фосфидтер деп аталады, олар суда жеңіл айырылып, сарымсақ иісті, өте улы тұрақсыз газ фосфин РН 3 түзеді:
Са 3 Р 2 + 6 Н 2 0 = 3 Са(ОН) 2 + 2 РН 8
3 РНз + 4 К 2 Сr 2 0 7 + 16 H 2 S0 4 = 3 Н 3 Р0 4 + 4Сг 2 (S0 4 ) + + 4 K 2 S0 4 + 16 H 2 0
Фосфордың қолданылуы . Фосфордың көп мөлшері әр түрлі зиянды насекомдарға қарсы қолданылатын хлорофос, тиофос сияқты пестицидтер дайындауға жұмсалады. Қызыл фосфор негізінен сіріңкенің бүйір жағында болатын қоңырқай қоспаның құрамына кіреді. Жанғыш снарядтар мен бомбаларды, түтін шымылдығын түзетін гранатаны ақ фосформен толтырады. Фосфордың жартысына жуығы қазіргі кезде синтетикалық жуғыш заттар жасауға қолданылады.
- Фосфордың алынуы мен қолданылуы
Химиялық активтілігі азотқа қарағанда жоғары болғандықтан фосфор табиғатта бос күйде кездеспейді. Ол жер қыртысында 200-ге жуық минералдар түзеді, солардың ішінде практикалық маңыздыларына кальций фосфаттары -фосфорит (Са 3 (Р0 4 ) 2 , апатит Са 3 (Р0 4 ) 2 Са (FC1) 2 , жатады. Фосфор барлық тірі организмдердің - өсімдіктің, жануардың, адамның белогының құрамына кіреді. Мысалы, ересек адамның қаңқасында 600 г, еттерінде 56 г, миында 5 г фосфор болады. Академик А. Е. Ферсман фосфорды "тіршілік және ой элементі" деп атады.
Біздің елімізде фосфор кендерінің бай қоры бар. Фосфориттың аса көп мөлшері Қаратауда ашылды.
Фосфорды арнаулы пештерде өте жоғары температурада фосфориттен иемесе апатиттен алады. Ол үшін пешке фосфорит, құм және көмір қоспасын салып өртейді. Осы процесс кезінде фосфорит құммен әрекеттесіп кальций силикаты түріндегі шлак түзеді:
Са 3 (Р0 4 ) 2 + 3 Si0 2 = 3 CaSi0 3 + Р 2 0 5
Реакциянның екінші сатысында фосфор (V) оксиді көмірмен тотықсызданып фосфорға айналады:
Бұл екі сатыны біріктіріп реакцияның жиынтық теңдеуін жазамыз:
Са 3 (РО
Фосфор бірнеше аллотропиялық түр өзгерістер түзеді, оларға ақ, қызыл және қара фосфор жатады. Ақ фосфор қызыл фосфорды тез суытудың нәтижесінде түзіледі, ол өте улы, ауада өздігінен жанады. Ақ фосфорды суда ерімейді оны су астында сақтайды. Оның молекуласы төрт атомнан тұрады.
Қызыл фосфор қызғылт қоңыр түрлі болады, ақ фосфор ауа қатыстырмай қыздыру арқылы алынады. Ол усыз, ауада өздігінен тұтанбайтын тұрақты зат.
Қара фосфор ақ фосфорды 200°С температурада (12 000 атм қысымда) қыздыру арқылы алынады.
Фосфор химиялық қасиеттері жағынан өте актив элементтердің қатарына жатады. Химиялық қосылыстарда фосфор 3-, 3+, 5+ тотығу дәрежелерін көрсетеді.
Фосфор күшті металл еместермен әрекеттесіп оңай тотығады, мысалы ол оттегімен әрекеттесіп оксидтер, хлормен әрекеттесіп хлоридтер түзеді:
4 Р + 3 0 2 = 2 Р 2 0 3 ; 4 Р + 5 02 = 2 Р 2 0 5
2 Р + 3 С1 2 = 2 РСІз; 2 Р + 5 С1 2 = 2 РС1 5
Фосфор тотықтырғыш қышқылдармен, пассив металдардың иондарымен әрекеттесіп ортофосфор қышқылына айналады:
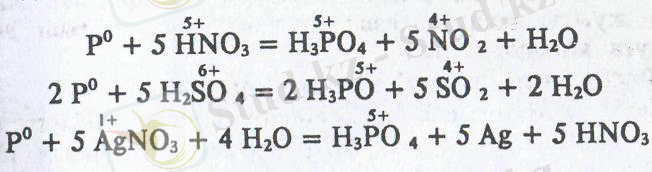
Фосфор сілтілермен әрекеттесіп диспропорцияланады
4 Р° + 3 NaOH + 3 Н
2
0 = 3 NaH
2
P
 2
+ Р
2
+ Р
Реакция нәтижесінде натрий гипофосфиты және фосфин түзіледі.
Фосфор тотықтырғыш ретінде металдармен әрекеттесіп фосфидтер деп аталатын заттар түзеді, мысалы,
3 Са + 2 Р = Са 3 Р 2
Фосфидтер сумен немесе қышқылдармен әрекеттесіп фосфордың сутегімен қосылысын фосфинді түзеді:
Са 3 Р 2 + 3 H 2 S0 4 = 3 CaS0 4 + 2 РН 3
Фосфин түссіз, улы, суда жақсы еритін газ. Ол өзінің химиялық қасиеттері жағынан аммиакқа ұқсас, суда еріткенде фосфорий гидроксидің, сілтіде еріткенде фосфорий тұзын түзеді.
РН 3 + Н 3 О = РН 4 ОН
РН 3 + HC1 = РН 4 С1
Фосфин күшті қатарына жататындықтан, қыздырғанда ауада жанып кетеді, күшті тотықтырғыштардың әсерінен фосфор қышқылына дейін тотығады, мысалы:
2 РНз + 4О 2 = Р 2 0 5 = 3 Н 2 0
Фосфордың сутекпен және галогенмен қосылыстары.
Фосфордың сутекпен екі қосылысы бар: РН 3 (газ), Р 2 Н 2 (сұйық) .
Фосфор сутекпен нашар қосылады:
2Р + ЗН 2
Бұл реакцияны 350°- және 2-10 7 Па қысымда жүргізгенде де РНз шығымы болғаны 2%.
Сондыктан фосфорсутекті не фосфинді РНз алу үшін кальций фосфоридін тұз қышқылымен, тіпті сумей әрекеттейді:
Са 3 Р 2 4-6НСІ =ЗСаСІ 2 + 2РН 3
Са 3 Р 2 + 6Н 2 0 = ЗСа(ОН) 2 + 2РНз
Бұл реакция аммиак алынатын реакцияға ұқсас. РН 3 басқа жолмен ақ фосфорды сілтілік ортада (50% ерітінді) реакцияластырса да түзіледі:
Р
4
+ 3ОН + ЗН
2
0
 РН
3
+ 3КН
2
Р0
2
РН
3
+ 3КН
2
Р0
2
2Р 4 + 3Ва(ОН) 2 + 6Н 2 0
Газ түріндегі фосфин - түссіз, сарымсақ иісті, улы зат; күшті тотықсыздандырғыш, ауада 150 градуста өзінен-өзі оталады. Құрылымы NН 3 сияқты, пирамида тәрізді
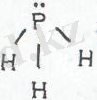
РНз-тің бөлінбеген қос электронды бұлты нашар гибридтанғандықтан оның электрон донорлық қасиеті NH 3 қарағанда әлсіздеу, сондықтан фосфин аммиак сияқты емес, қосып алу реакцияларына бейімділігі кем, фосфоний РН 4 тұздары кейбір қышқылдарда ғана (НСlO 4 , НСІ, HBr, HI) болады, әрі өздері тұрақсыз. Фосфин суда ерігенмен қосылыс түзбейді. Фосфин да фосфоний туындылары да - күшті тотықсыздандырғыш, РН 3 150°С өздігінен тұтанады.
Р 2 0 4 - дифосфин, гидразинның аналогы
түссіз сұйықтық фосфидтардың гидролизінде РН 3 -пен қабат түзіледі. Күшті тотықсыздандырғыш, ауада өздігінен тұтанады. Фосфидтер. Фосфор қыздырғанда барлық металдармен дерлік қосылысып фосфидтер түзеді. Металдың қасиетіне қарай фосфидтер әр түрлі болады. Айталық, s - элементтердің фосфидтері - Э 3 Р2 - иондық-коваленттік қосылыстар, олар тұз тәрізді. Олар суда оңай ыдырайды:
Mg 3 P 2 +6H 2 0 = 3Mg(OH) 2 + 2PH,
d - элементтердің фосфидтері - ЭР, ЭР 2 , Э 3 Р сұр не қара түсті болады, металдық жылтыры бар, электр өткізгіш келеді. Химиялық активтігі нашар.
Фосфор галогендердің барлығымен өте жақсы қосылысады, олардың ішінде маңыздысы хлормен түзген қосылыстары.
Фосфор трихлориді РСІз алу үшін көп етіп алып балқытқан фосфордың үстімен хлор жібереді, сонда фосфор солғын сары түсті жалынмен жанып:
2Р + ЗСІ 2 = 2РСІз ДН°= -644, 3 кДж/моль
фосфор трихлоридін түзеді. Бұл түссіз сұйық t K = 75, 3° ылғалды ауада «түтінденеді», сумен өте жақсы реакцияласады (гидролизденеді) :
РС1 3 +ЗН 2 0 = Н 3 РОз+ЗНСІ
Фосфор трихлориді - фосфорлы қышқылдың х л о р а и г и д р и д і екенін көреміз.
Фосфор трихлоридіне көп мөлшерде хлор жіберсе, ол түссіз кристалдарға айналады:
РС1з + CI 2
Фосфор пентахлориді - фосфор қышқылының хлор ангидриді, гидролиз реакциясы екі сатыда өтеді:
РСІ5 + Н 2 0 = РОС1 3 +2НСІ
РОС1 3 + ЗН 2 0 = Н 3 Р0 4 + ЗНС1
РОСІ з - фосфор оксо-трихлориді түссіз сұйықтық. PCl 3 PCl 5 РОСІ 3 бұлар түрлі органикалық заттар синтезінде пайдаланылады.
ІІ Фосфордың маңызды қосылыстары
Фосфордың оттекті қосылыстары.
Фосфордың үш оксиді бар: Р 2 О 3 , P 2 O 4 , P 2 О 5 .
Дифосфор триоксиді - Р 2 О 3 фосфор баяу тотыққанда, немесе оттек жеткіліксіз болғанда түзілетін, ақ түсті кристалдық зат t б = 23, 8°, t К =175, 4°С. Төмен температурада полимерленіп Р 4 О 6 түзеді. Суық сумен қосылып фосфорлы қышқыл Н 3 РО 3 түзеді, жылы сумен реакцияласқанда, фосфорлы қышқылдың термиялық айрылуында түзілетін заттар шығады
(4Н 3 РО 3
Р 2 0 3 ауада 50-60°С өздігінен тотығып, 70°С тұтанып, екеуінде де Р 2 О 5 айналады. Р 2 0 3 ак фосфордың өзіндей улы.
Дифосфор триоксидтің кристалы, Р 2 О 3 молекулаларынан түзілген молекулалық тордан тұрады. Р 4 0 6 молекуласы, Р0 3 -тің төрт пирамидасынан тұрады, ол пирамидалар ортақ оттек атомдары арқылы қосылысқан (3-сурет) . Р 2 О 3 -тің тағы бір модификациям полимерлік қосылыстар, мұның екеуі де күшті тотықсыздандырғыштық қасиеті бар заттар.
Дифосфор тетраоксиді Р 2 О 4 , түссіз, жылтыр кристалдық зат. Бұл оксидті, N 2 O 4 сияқты, аралас ангидрид деп қарауға болады, өйткені сумен реакцияласқанда:
Р 2 04 + ЗН 2 0 = Н 3 Р0 4 + Н 3 РО 3
фосфор және фосфорлы қышқылдар түзеді.
Дифосфор пентаоксиді Р 2 О 5 фосфор ауада, не оттек ішінде жанғанда ақ қар сияқты көп көлем алатын масса болып түзіледі, t б = 563°С.
Фосфор (V) оксиді сумен өте шабыт қосылады, суды тіпті басқа заттан тартып алып та қосылады, сондықтан мұны су тартып алғыш зат ретінде де қолданады. Фосфор (V) оксиді бу күйінің өзінде де Р 4 О 10 молекулаларынан тұрады. Р 4 О 10 молекуласы, Р0 4 -тің төрт тетраэдрынан құралған, оның әр қайсысы көрші жатқан үшеуімен ортақ оттек атомдары арқылы қосылысқан. (128-сурет) .
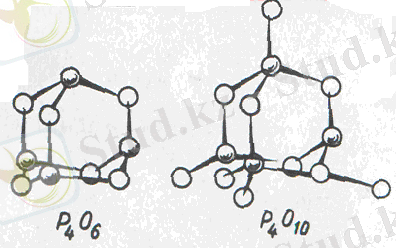
- сурет Фосфор оксидтері Р 4 О 6 және Р 4 О 10 құрылымы (штрихталғаны -Р, штрихталмағаны -О)
Қатты Р 2 О 5 бірнеше модификациясы бар, айырмашылықтары Р0 4 тетраэдрларының орналасуында (ромб сияқты, шыны тәрізді) бұлардың барлығы Р 2 0 5 полимерлері.
2. 1. Фосфор қышқылдары
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz