Физикалық және коллоидтық химия: жоғары оқу орындарына арналған оқу құралы


Ә. Қ. ҚОҚАНБАЕВ
Ф И З И К А Л Ы Қ
және
К О Л Л О И Д Т Ы Қ
Х И М И Я
Оқу құралы
АЛМАТЫ 2010
ББК 24. 6
Қ 61
Баспаға әл-Фараби атындағы Қазақ ұлттық университеті
химия факультетінің Ғылыми кеңесі ұсынған
Пікір жазғандар:
химия ғылымдарының докторы, профессор Қ. Б. Ержанов;
химия ғылымдарының докторы, профессор Д. Х. Қамысбаев ;
химия ғылымдарының докторы, профессор Ж. Ә Әбілов.
Қоқанбаев Ә. Қ.
Қ 61 Физикалық және коллоидтық химия: оқу құралы. - Алматы: «Ғибрат» баспа үйі, 2010. - 324 б.
ISBN
Оқу құралы екі бөлімнен - физикалық химия және коллоидтық химия - тұрады. Бірінші бөлімде заттардың агрегаттық күйлері, химиялық термодинамика, химиялық және фазалық тепе-теңдіктер; ерітінділер мен электролиттердің қасиеттері; сулы ерітінділердегі иондық тепе-теңдіктер; электродтық процестер; химиялық кинетика мен катализ сияқты физикалық химияның негізгі тараулары қарастырылған.
Екінші бөлімде коллоидтық жүйелердің алыну және тазарту әдістері, коллоидтық жүйелердің жалпы қасиеттері, беттік құбылыстар және адсорбция; коллоидтық жүйелердің тұрақтылығы мен коагуляциясы, макро- және микрогетерогендік жүйелер және лиофильдік коллоидтық жүйелер туралы жазылған.
Оқу құралы мемлекеттік университеттердің химия мен химиялық технологиядан басқа мамандықтарының студенттері мен оқытушыларына арналған.
Қ
© Ә. Қ. Қоқанбаев, 2010
ISBN © «Ғибрат» баспа үйі, 2010
Бұл еңбегімді Қазақ Мемлекеттік университетінің
химия факультетінде алғаш рет (1958 ж. ) қазақ бөлімін ашуға
ат салысқан, оның студенттеріне қазақ тілінде дәріс беріп,
оларға арнап оқулықтар, оқу құралдары мен сөздіктер жазған
ұстаздарым: Бірімжанов Батырбек Ахметұлы,
Молдағалиев Хайрулла Досжанұлы,
Омаров Сәтбек Тоғанбекұлының
рухтарына бағыштаймын.
Автор
Алғы сөз
1996 жылы «Білім» баспасынан Қазақстан Республикасы Білім Министірлігі жоғары оқу орындарының студенттеріне арналған оқу құралы ретінде бекіткен «Физикалық химияның қысқаша курсы» атты оқу құралын шығарған едік. Бүгінде ол библиографиялық тапшылыққа айналды. Оның үстіне еліміздің көпшілік ЖОО-да физикалық және коллоидтық химия бір пән ретінде оқытылады. Осыларды ескеріп, бұрынғы оқу құралын толықтырып, оған коллоидтық химияның қарастыратын материалдарды қосып, осы оқу құралын ЖОО-ның «050710- Материалтану және жаңа материалдардың технологиясы» мамандығының студенттеріне арнап, олардың оқу жоспарына сәйкес етіп жазып отырмыз. Кітапты жазу кезінде дәріс беру кезінде қарастырылған орыс тіліндегі оқулықтар мен оқу құралдары пайдаланылды (пайдаланған әдебиеттерді қараңыз) . Кітаптың шығуына бұрын өзіміз шығарған «Коллоидтық химия терминдерінің орысша-қазақша, қазақша-орысша сөздіктері», «Коллоидтық химия терминдері мен сөз тіркестерінің түсіндірме сөздігі», «Коллоидтық жүйелердің жалпы қасиеттері», «Сорбциялық құбылыстар», «Коллоидтық жүйелердің тұрақтылығы және құрылым түзуі», «Коллоидтық беттік-активтік заттар» сияқты сөздіктер мен оқу құралдарымыздың да үлкен көмегі тиді.
Бұл кітап ұлттық университеттің физика факультетінің«050710- Материалтану және жаңа материалдардың технологиясы» мамандығының студенттеріне арналғанына қарамастан, оны педогогикалық, медициналық, технологиялық, ауыл-шарушылық ЖОО-ның студенттері де пайдалана алу мақсатын көздеп жаздық. Оқу құралы туралы ой-пікірлеріңіз бен ұсыныстарыңызды автор ризашылығымен қабылдап, оларды алдағы уақытта осы пән бойынша шығатын оқулығында ескеретін болады. Ұсыныстарыңызды автордың атына мына мекен-жайға жіберулеріңізге болады: Алматы қаласы Қарасай батыр көшесі 95 а үй, әл-Фараби атындағы Қазақ ұлттық университетінің химия факультетінің деканаты.
автор: Ә. Қоқанбаев - әл-Фараби атындағы
ҚазҰУ профессоры
БІРІНШІ БӨЛІМ
ФИЗИКАЛЫҚ ХИМИЯ
БІРІНШІ БӨЛІМГЕ КІРІСПЕ
Физикалық химия - химия мен физиканың арасындағы аралық ғылым. Ол химиялық реакциялардың, олармен қоса жүретін физикалық құбылыстардың заңдылықтарын зерттейді. Соңғы кездерде физикалық химия, биохимия, биофизика, геохимия, геофизика т. б. сияқты аралық ғылымдар тез дамып, көптеген қызықты ғылыми және іс-тәжірибелік мәліметтер жинақталуда.
Физикалық химия заттың құрылысын, химиялық процестердің жүйедегі тепе-теңдік жағдайы мен олардың бір күйден екінші күйге ауысу мүмкіндігін, химиялық реакция жылдамдығының уақытқа байланысты өзгеруін, электрлік және химиялық энергиялардың өзара ауысу заңдылықтары сияқты мәселелерді қарастырады.
Физикалық химия тұжырымдаған заңдылықтар мен оның әдістері ғылымның барлық салаларында дерлік қолданылады. Ол физикалық химияның жалпы ғылымдық мәнін көрсетеді.
Физикалық химия заттардың құрамы мен қасиеттерінің арасындағы байланыстарды зерттей отырып, әр түрлі физикалық-химиялық талдау әдістерін жасады. Олар болса әдеттегі химиялық талдауды жылдан жылға ығыстыруда.
Физикалық химияда теориялық та, тәжірибелік те әдістер қолданылады. Тәжірибе мәліметтерін талдауда және химиялық реакциялар мәліметтерін жинақтап қорытуда теориялық физиканың үш түрлі: термодинамикалық, статистикалық және кванттық-механикалық тәсілдері қолданылады.
Термодинамикалық тәсіл әр түрлі энергияның өзара байланысы мен түрленулерін тұжырымдайтын термодинамикалық заңдарға негізделген. Бұл тәсіл заттардың түрленуі кезіндегі энергияларды есептеуде, химиялық тепе-теңдікті есептеуде қолданылады.
Статистикалық тәсіл заттардың макроскопиялық қасиеттерін молекулалардың микроскопиялық қасиеттерімен байланыстыратын заттардың молекулалық табиғаты туралы ілімге негізделген. Бұл мақсатпен көбінде ықтималдылық теориясы қолданылады.
Кванттық-механикалық тәсіл энергияның ауысуы тек белгілі бір мөлшерде (квант күйінде) болады деген тұжырымға негізделеді. Бұл тәсіл жылусыйымдылығын зерттеуде, атом құрылысының сандық теориясын жасауда, спектр туралы ілімде, фотоэлектрлік құбылыстарды түсіндіруде және т. б. өте тиімді.
Қазіргі кезде физикалық-химияның заңдылықтары мен әдістері қолданылмайтын ғылым мен тәжірибе алмасудың бірде-бір саласы жоқ десе де болады.
Енді кітаптың бірінші бөлімінің мазмұнына қысқаша тоқталайық. Ол физикалық химияның дамуына қысқаша шолудан және 8 тараудан тұрады.
Бірінші тарауда - заттардың агрегаттық күйлері (газ, сұйық, қатты денелер), олардың қасиеттері мен жалпы сипаттамалары жазылған.
Екінші тарау - химиялық термодинамика деп аталады. Онда энергия түрленуі туралы, химиялық процестердің жылу эффектісі жөнінде жазылған. Мұнда көптеген оқулықтардағы сияқты тек термодинамиканың бірінші, екінші заңдары ғана емес, оған қоса термодинамиканьң нөлінші, үшінші заңдары да көрсетілген.
Үшінші тарау - химиялық және фазалық тепе-теңдіктер. Мұнда термодинамиканың, көмегімен химиялық және фазалық тепе-теңдіктер түсіндіріліп, химиялық тепе-теңдіктің заңдылығы, әр түрлі факторлардың тепе-теңдікке тигізер әсерлері жазылған, Гибсс жасаған фазалар ережесі мен термиялық талдау көрсетілген.
Төртінші тарауда - ертінділерге жалпы сипаттама беріліп, сұйытылған ерітінділердің, қасиеттерін көрсететін заңдылықтар, газдың, қатты дененің, сұйықтықтың сұйықтықта еру жағдайы, ерітінділердің, коллигативтік қасиеттері жазылған.
Бесінші тарауда («Ионика») электролит ерітінділерінің ерекшеліктері мен электролиттік диссоциация теориясы, әлсіз және күшті электролиттер қасиеттері мен электрөткізгіштіктері, алтыншы тарауда - сулы ерітіндінің иондық тепе-теңдіктері, сутектік және буферлік қоспалар қарастырылған.
Жетінші тарау - («Электродика») электрод пен ерітінді жанасу бетіндегі электрохимиялық реакциялардың механизмі мен кинетикасын және электр қозғаушы күштің пайда болуы мен оны анықтау тәсілдерін, электродтардың түрлерін қарастырады.
Сегізінші тарау - «Химиялық кинетика және катализ» деп аталады. Онда химиялық реакциялардың жылдамдықтарының әр түрлі факторларға тәуелділігі түсіндірілген. Реакция түрлері мен олардың молекулалығы және реттілігі, оларды анықтау жолдары, катализдің түрлері, оның ішінде ферменттілік катализ де осы тарауда қарастырылды.
Кітаптағы сурет пен кестелердің реттік нөмірі екі цифрмен берілген, алғашқысы - тараудың, ал екіншісі сол тараудың ішіндегі сурет пен кестенің реттік нөмірін көрсетеді. Түсінікке оңай болу үшін формулалар тек бір цифрмен ғана нөмірленді.
ФИЗИКАЛЫҚ ХИМИЯНЫҢ ДАМУЫНА ҚЫСҚАША ШОЛУ
Физикалық химия ғылыми пән ретінде алғаш рет XVIII ғасырдың орта шенінде пайда болды. Оның негізін орыстың атақты ғалымы М. В. Ломоносов (1711 -1765) қалады. Ол физикалық химияньң бағдарламасын жасап, одан студенттерге аптасына 4 сағаттан дәріс берді (1751 ж. ) және әр түрлі тәжірибелер көрсетті. Оның “Нақтылы физикалық химияға кіріспе” деген еңбегінде физикалық химияға мынадай анықтама берілген еді: “Физикалық химия- физиканың тұжырымдары мен тәжірибелерінің негізінде аралас денелерде химиялық түрлену кезінде болатын нәрселерді түсіндіретін ғылым”.
М. В. Ломоносовтан кейін 1860 ж. орыстың атақты ғалымдарының бірі Н. Н. Бекетов (1825-1911) Харьков университетінде “Физикалық және химиялық құбылыстардың өзара қарым-қатынастары” курсын оқып, оны 1865 жылы “Физикалық химия” деп атады.
Н. Н. Бекетов алғаш рет металдардың тотықсыздандырғыштық қасиеттерін тексеріп, алюминий мен магнийдің тотықсыздандырғыш қасиеттерінің жоғары екенін көрсетті. Ол металдардьң химиялық активтілік қатарын анықтап, оны “ығыстыру қатары” деп атады.
Кейінірек Ресейдің басқа да университеттерінде физикалық химия оқытыла бастады: Казанда Ф. М. Флавицкий (1874 ж. ), Юрьевте (қазіргі Тарту қаласы) В. Оствальд (1880 ж. ), Мәскеуде Н. А. Каблуков (1886 ж. ) осы пәннен дәріс берді. Ресейде физикалық химиядан алғашқы оқулықты 1876 ж. Н. Н. Любавин (1845-1918) жазды, оған физикалық, химиядан сол кезде жинақталған материалдар енді. Кейінірек (1904-1914) ол толықтырылып, “Техникалық химия” деген атпен 6 томдық еңбек болып басылып шықты.
1887 ж. тұңғыш рет Лейпциг университетінің физикалық химия кафедрасы ашылып, физикалық химиядан ғылыми журнал шыға бастады. Оларды ұйымдастырған В. Оствальд болатын. Осы уақыттан бастан физикалық химия дербес ғылым және оқу пәні ретінде қалыптасты.
Физикалық химияның әр түрлі тараулары дамып, көптеген мағлұматтар жинақталды. Мысалы, газдардың адсорбциясы (1774 ж. Швецияда К. Шееле, 1774 ж. Францияда Ф. Фонтан), ертінділердің адсорбциясы (1785 ж. Ресейде Т. Е. Ловиц), катализ туралы түсініктердің қалыптасуы және каталитикалық реакциялардың ашылуы (XIX ғасырдың басында Англияда Г. Дэви және Л. Тенар, Швецияда И. Берцелиус), гальваникалық элементтің ашылуы, электролиздің ашылуы (XVIII ғасырдың аяғы XIX ғасырдың басы Италияда Л. Гальвани, А. Вольта, Ресейде В, В. Гротгус, Англияда Г, Дэви, М. Фарадей), химиялық реакциялардың жылуларын зерттеу (1779-1784 ж. Францияда А. Лавуазье, П. Лаплас, 1836-1840 ж. Ресейде Г. Гесс), термодинамиканың бірінші, екінші заңдарының ашылуы (XIX ғасырдың орта шенінде Германияда Р. Майер, Г. Гельмгольц, Р. Клаузиус, Францияда С. Карно, Англияда Дж. Джоуль, В. Томсон), химиялық тепе-теңдіктердің термодинамикасы (Норвегияда К. Гульберг пен П. Вааге, АҚШ-та Гиббс) т. б. зерттелді.
Міне осылай XIX ғасырдың аяғына таман физикалық химияның негізгі үш бөлімі: химиялық термодинамика, химиялық кинетика және электрхимия қалыптасты.
Бүкіл химияның, оның ішінде физикалық химияның дамуында 1869 ж. Д. И. Менделеевтің периодтық заңды ашуы ерекше маңызға ие болды. Ол ерітінділердің “Сольваттық теориясын” жасап, сұйықтықтың қайнау кезіндегі дағдарыс температурасын (1867) анықтады.
А. М. Бутлеров жасаған химиялық құрылыс теориясы да химиялық байланыстар мен заттардың химиялық құрылысын түсіндіруде үлкен әсерін тигізді.
Ресейде Д. В. Коновалов (1856-1929 ж. ) “Ерітінділер буының серпімділігі туралы” деген диссертациясында (1884 ж. ) жасалған тұжырымдар қазіргі кезде “Коновалов заңдары” деген атпен белгілі.
Ерітінділерді зерттеуде И. А. Каблуков (1857 - 1942 ж. ) пен В. Ф. Алексеевтің (1852 - 1918 ж. ) еңбектерінің маңызы зор.
В. Ф. Лугинин (1834 - 19. 11) Мәскеудегі университетте термохимиялық лабораторияның негізін салса, Н. А. Шилов (1872 - 1930) тізбекті реакциялардың кинетикасын зерттеді, ал Л. В. Писаржевский (1874 - 1934) тотығу-тотықсыздану реакцияларының алғашқы қалаушылардың бірі болды.
ХIХ ғасырдың аяғы мен XX ғасырдың басындағы жалпы жаратылыстануда, оның ішінде физикадағы табыстар физикалық химияның дамуына үлкен әсерін тигізді.
Химиялық реакцияларды жүйелі түрде зерттеудің арқасында Я. Вант - Гофф кинетикалық заңдылықтардың математикалық өрнегін жасады.
Н. А. Меншуткин химиялық реакциялардың кинетикасын зерттей отырып, еріткіш табиғатының маңызын көрсетті. С. Аррениус химиялық реакция жылдамдығының температураға байланыстылығын анықтап берді.
Сол кездерде сұйық ерітінділердің сандық теориясы жасала бастады. 1887ж. С. Аррениус электролиттердің ерітіндісін зерттей отырып, “Электролиттік диссоциация теориясын” жасады, ал П. Дебай мен Э. Гюккельдің еңбектерінде одан әрі дамытылып, күшті электролит ерітінділерінің теориясы жасалды.
XIX ғасырда физикалық химия өте жылдам дамыды, яғни атомның құрылысын ашу, кванттық теория, электроника мен электрондық есептеу машиналарын пайдалану, жаңа тәсілдер ашу және бұрынғы белгілі тәжірибелік тәсілдерді (рентгендік талдау, спектралдық, масс - спектрометрия, электронография, магниттік және т. б. ) жетілдіру себеп болды. Бұл жаңалықтар нәтижесінде химиялық реакциялардың кинетикасы одан әрі дамып, физикалық химияның жаңа салалары (заттың құрылыс туралы ілім, фотохимия, радиациялық химия және т. б. ) пайда бола бастады. XX ғасырдың орта шенінде қайтымсыз процестердің термодинамикасы күшті дамыды.
Физикалық химияның, дамуына үлкен үлес қосқан атақты орыс ғалымдары В. А. Кистяковский, Н. А. Изгарышев, А. Н. Фрумкин, Н. Н. Семенов, П. А. Ребиндер және т. б. еңбектерін атап айтқан жөн.
Физикалық химияның Қазақстанда дамуына Қазақ мемлекеттік университетінің, Қазақстан Республикасының Ұлттық Ғылым академиясының (ҚР ҰҒА) ашылуы зор әсер етті.
Қазақ мемлекеттік университетіндегі химия факультетінде және ҚР ҰҒА химия, катализ және электрохимия, металлургия және кен байыту институттарында көптеген ғалымдар физикалық химия саласында үлкен табыстарға жетті.
Академик М. И. Усанович ерітінділердің сандық теориясын қорыта келе анамольды электр өткізгіштік кездейсоқ құбылыс емес, заңдылық екенін анықтады. Оствальдтың сұйылту заңын кез келген ерітінділерге қолдану қате екенін дәлелдеді. Қышқылдар мен негіздердің жалпы теориясын ұсынып, химиялық реакция құрамы жағынан тепе-теңдік концентрациясына тәуелді болған жағдайда ғана идеал ерітінділер заңына бағынатынын анықтады.
Академик Д. В. Сокольский катализаторлар активтігін, энергия мөлшерін, реагент молекулаларының катализатор бетінде байланысу сипатын, электрохимиялық потенциалды өлшеу арқылы катализатор бетіндегі барлық өзгерістерді анықтау әдістерін тапты, гидрогендеу катализаторының тиімділігін арттыру теориясын ұсынды.
Академик З. М. Молдахметов - конденсацияланған жүйелердің физика-химиялық қасиеттерін тербелмелі спектроскопия, ядромагниттік резонанс, молекулалық люминесценция әдістерімен зерттеп, түрлі сыртқы әсерлерге байланысты молекулалардың ішкі магниттік әрекеттесуінің өзгерістерін түсіндірді.
Академик М. Т. Козловский металдардың сынап фазасында өзара әрекеттесуін электрохимиялық әдістермен зерттеу теориясын негіздеді, жаңа ғылыми бағыт - амальгамалар химиясының практикалық және теориялық негізін ұсынды.
Академик Е. А. Букетов халькогендер мен халькогенидтердің термодинамикасын және кинетикасын зерттеу арқылы олардың химиялық және технологиялық мәнін түсіндірді.
ҚР ҰҒА мүше-корреспонденті Б. А. Бірімжанов Қазақстан жеріндегі сулардың тұз құрамын зерттеп, табиғи суларда тұздар түзілуінің физика-химиялық негіздерін ашты.
ҚР ҰҒА мүше-корреспонденті Е. А. Мамбетказиев электродтық процестердің кинетикасына орта әсерінің заңдылықтарын ашты.
Профессор Х. Қ. Оспанов жаңа термодинамикалық функцияны енгізудің арқасында (орталық атомдық Гиббс энергиясы) алғашқы гетерогенді процестерде (қатты заттар мен ерітінділердің арасында) термодинамика мен кинетика заңдарының арасындағы байланысты тәжірибе арқылы дәлелдеді.
1992 ж. «Жану процестерінің химиялық негіздерін іргелі зерттеу» атты ғылыми жұмыстарынң циклі үшін Қазақстан Республикасының Ғылым және техника саласы бойынша Мемлекеттік сыйлықтың иегерлері болған, профессорлар Г. И. Ксандопуло, Б. Я. Колесников, З. А. Мансуров, А. Ә. Сағындықовтар кәдімгі жалындарда төменгі температуралық жалыналдындағы аймақтар болатынын анықтады.
Олардың жасаған теориялық түсініктері жану процесін пайдаланатын көмірсутектік шикізаттардың пиролизін иницирлеу, жалындарда мақсатты өнімдерді синтездеу, газ және конденсирленген жүйелердегі жануды тежеу, іштен жанатын двигательдердің жұмысын оңтайландыру, жер қойнауқабатындағы жануды реттеу сияқты бірқатар жаңа технологияларды ұсынуға мүмкіндік берді.
Профессор Д. Қ. Қамысбаев комплекстүзілу процесінің термодинамикасын жүйелі зерттеудің нәтижесінде ауыспалы металдардың комплекстерәінің термодинамикалық сипаттамаларын анықтап, оларды талдау арқылы бірқатар термодинамикалық шамаларды (реакция энтропиясының стандарттық өзгеруі
Профессор А. С. Малалилов материя құрылысын зерттеу арқылы кванттық теорияны одан әрі дамытты.
І-тарау
ЗАТТАРДЫҢ АГРЕГАТТЫҚ КҮЙЛЕРІ
1 Заттардың агрегаттық күйлерінің сипаттамасы
Заттар сыртқы ортаға байланысты (температура және қысым) төрт түрлі: газ, сұйық, қатты және плазма агрегаттық күйде бола алады.
Физикалық және коллоидтық химия плазмалық күйді қарастырмайды. өйткені плазмалық күйде зат молекулалары температурасы 5000 °С жоғары зарядталған иондар және электрондар түзіп, диссоциацияланады. Бұл күйдегі заттардың электрөткізгіштігі және соған байланысты басқа да қасиеттері өзгеше болады.
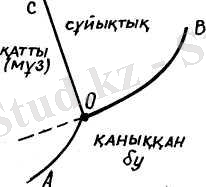
Заттың бір агрегаттық күйден екінші күйге ауысуы агрегаттық түрлену деп аталады. Көптеген заттар белгілі бір температура мен қысымда бірден үш күйде бола алады. Мысалы суды алып қарасақ, ол бу, сұйық және мұз күйінде болады. 1. 1-суретте су күйінің диаграммасы көрсетілген. Диаграммадағы қисықтардан екі агрегаттық аймақтың шекарасын көреміз. ОА қисығы - мұз бетіндегі қаныққан будың өзгеруін, ОВ қисығы сұйық су бетіндегі қаныққан будың өзгеруін, ал ОС қисығы қысымға байланысты мұздың балқу (еру) температурасының өзгеруін көрсетеді. Диаграммадағы О нүктесі үштік нүкте деп аталады. Осы нүктеге сәйкес келетін жүйеде белгілі температура мен қысымда бір уақытта әрі бу, әрі сұйық су, әрі мұз күйде болады.
Кейбір заттар тек бір, екі ғана күйге ұшырайды. Мысалы, нафталин, йод, кшәндер қатты күйден бірден буға айналады. Мәселен, кальций карбонаты сұйық күйінде де, газ күйінде де алынбайды. Өйткені ол қыздырғанда кальций оксиді мен көміртек (IV) оксидіне ыдырайды. Крахмал, белокты да газ күйінде алуға болмайды.
 Заттардың осы үш күйі - олардың айырмашылығы, молекулаларының өзара арақашықтығы мен әрекеттесу дәрежесіне байланысты болады. Газ күйіндегі заттардың атомдары мен молекулалары бір-бірінен өте алшақта болатындықтан, олардың молекулааралық күштері өте әлсіз. Газ күйіндегі заттар кез келген көлемде бола алады. Сондықтан, оларды жоғары қысыммен қыса отырып, сұйық немесе қатты күйге айналдыруға болады. Кейбір заттардың газ күйінде жеке молекула емес, екі, үш бөлшектен тұратын жиынтық түрінде де болуы мүмкін.
Заттардың осы үш күйі - олардың айырмашылығы, молекулаларының өзара арақашықтығы мен әрекеттесу дәрежесіне байланысты болады. Газ күйіндегі заттардың атомдары мен молекулалары бір-бірінен өте алшақта болатындықтан, олардың молекулааралық күштері өте әлсіз. Газ күйіндегі заттар кез келген көлемде бола алады. Сондықтан, оларды жоғары қысыммен қыса отырып, сұйық немесе қатты күйге айналдыруға болады. Кейбір заттардың газ күйінде жеке молекула емес, екі, үш бөлшектен тұратын жиынтық түрінде де болуы мүмкін.
Сұйық күйіндегі заттар молекулаларының әрекеттесу күші (газдарға қарағанда) көбірек болады. Сондықтан, сұйықтық молекулалары бір-бірінен тәуелсіз қозғалу қабілетін жоғалтып, бірінен-бірі өте қашықтықта болмайды. Сұйық күйіндегі дене көлемі аз, тек өзінің пішінін ғана өзгертетін болады. Сұйықтықтардың осындай қасиеті техникада көтергіш, тежегіш қондырғыларда т. б. мақсаттар үшін жиі қолданылады.
Қатты денелерде атомдар, молекулалар немесе иондар арасы өте жақын және олардың тебілу күштері тартылу күштерімен шамалас болады. Осы атомдар (молекулар мен иондар) белгілі бір тәртіппен араласып кристалдық тор түзеді.
Заттардың бір агрегаттық күйден екінші бір агрегаттық күйге ауысуы жүйе энергиясының өзгеруімен жүреді. Мысалы, балқу, булану кездерінде жылу сіңіріліп, ал конденсациялану және кристалдану кездерінде жылу бөлініп шығатын болады. Қатты және сұйық жүйелерді заттардың конденсацияланған күйлері дейді. Зат қатты күйден сұйық күйге ауысқанда, сұйық күйден газ күйіне ауысуына қарағанда, энергия аз жұмсалады. Ендеше балқу жылуы оның булану жылуынан әрқашанда аз болады.
2 ГАЗДАР
2. 1 Газдардың заңдары
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz