Коллоидты жүйелер: теория, беткі құбылыстар және зертханалық әдістер


Мазмұны
Алғы сөз . . . 3
І тарау
КОЛЛОИДТЫ ЖҮЙЕ . . . 4
§1. Коллоидты жүйе туралы түсінік . . . 4
§2. Меншікті бет . . . 11
§3. Дисперсті жүйенің жіктелуі . . . 13
ІІ тарау
БЕТТІК ҚҰБЫЛЫСТАР МЕН АДСОРБЦИЯ . . . 16
§1. Беттік керілу . . . 16
§2. Фазаның жанасу шегіндегі бос энергия . . . 17
§3. Адсорбциялық құбылыстың жалпы сипаттамасы . . . 19
§4. Катты дене газ шегіндегі адсорбция . . . 21
§5. Адсорбция изотермасы . . . 25
§6. Сұйық - газ жанасу шегіндегі адсорбция . . . 28
§7. Қатты дене - сұйық жанасу шегіндегі адсорбция . . . 32
§8. Адсорбция түрлері мен теориясы . . . 35
III тарау
МОЛЕКУЛА - КИНЕТИКАЛЫҚ ҚАСИЕТТЕР . . . 39
§1 Броундық қозғалыс . . . 39
§2 Диффузия және флуктуация . . . 41
§3 Осмос қысымы . . . 42
§4Седиментация . . . 43
IV тарау
КОЛЛОИДТЫ СИСТЕМАЛАРДЫ АЛУ ЖӘНЕ ТАЗАЛАУ… . . . 57
§1 Коллоидты - дисперсті системаларды алу . . . 57
§2 Коллоидты системаларды тазарту . . . 61
V тарау
КОАГУЛЯЦИЯ ЖӘНЕ ТҰРАҚТАНДЫРУ . . . 63
§ 1 Коллоидты ерітінділердің коагуляциясы . . . 63
§2 Ұю кинетикасы . . . 65
§3 Коллоидтардың тұрақтылығы . . . 67
§4 Ұюдың түрлері . . . 70
VI тарау
ҚҰРЫЛЫМДАНУ ЖӘНЕ МИКРОГЕТЕРОГЕНДІ ЖҮЙЕ . . . 73
§1 Құрылымдану және реология . . . 73
§2Суспензиялар . . . 77
§3 Эмульсиялар . . . 78
§4 Көбіктер . . . 83
§5 Аэрозольдер . . . 87
§6 Ұнтақтар . . . 91
VII тарау
КОЛЛОИДТЫ БАЗ . . . 93
§1 Коллоидты БАЗ түрлері . . . 93
§2 Коллоидты БАЗ ерітінділерінің қасиеттері . . . 95
§3 Тұрақтандыру және солюбилизация . . . 97
§4 Коллоидты ерітінділер . . . 99
§ 5 Коллоидты ерітінділердің оптикалық қасиеттері . . . 139
§ 6 Коллоидты ерітінділердің тұтқырлығы . . . 150
VIII тарау
ЛАБОРАТОРИЯЛЫҚ ЖҰМЫСТАР . . . 156
№1 Сұйықтың толық беттік энергиясын анықтау . . . 156
№2 Қатты дене - ерітінді арасындағы адсорбция . . . 158
№3 Қатты дене мен электролит емес қос ерітінді арасындағы адсорбцияны зерттеу . . . 159
№4Қатты адсорбенттегі ерітіндіден БАЗ адсорбциясын зерттеу . . . 161
№5 БАЗ беткі қабат белсенділігіне олардың молекулалық құрылыс әсерін зерттеу. Адсорбциялық қабат өлшемін анықтау . . . 162
№6 Коллоидты жүйе. Коллоидты жүйені алу . . . 164
№7 Дисперсті жүйе . . . 166
№8 Темір гидроксиді гидролизінің ұюы мен тұрақтануын зерттеу . . . 169
№9 Зольдерді пептизация әдісімен алу және тазалау . . . 171
№10 БАЗ ерітінділеріндегі мицелла түзілуін зерттеу . . . 172
№11 Амфотерлік полиэлектролиттің изоэлектрлік нүктесін анықтау . . . 174
№12 ЖМҚ молекулалық салмағын анықтау . . . 176
№13 Жоғары молекулалық заттың ісінуі . . . 178
№14 Эмульсиялар . . . 179
№15 Эмульсияны алып, қасиетін зерттеу. Ісіну . . . 181
№16 Зольдерді алу және олардың кейбір қасиеттері . . . 185
№17 Коллоидты ерітінділерді гидролиз әдісімен алу . . . 187
№18 Коллоидты ерітінділерді алудың ерекшеліктері және алмастыру әдісі . . . 188
№19 Коллоидты ерітінділерді алудың пептизация әдісі . . . 188
№20 Коллоидты системалардың тұрақтылығы және коагуляциясы . . . 189
№21 Көбіктердің қасиеттері және оларды алу . . . 193
№22 Аэрозольдардың түзілуі . . . 194
№23 Хроматографиялық адсорбция . . . 197
№24 Гиббс адсорбцияның изотермі . . . 200
№25 Иониттердің алмасу қабілетін үйрену . . . 202
№26 Суспензияның седиментациялық анализі . . . 202
№27 Гельдер . . . 204
№28 Конденсациялау әдісі. Күкірт . . . 207
№29. Коллоидты ерітінділерді алуға әсер ететін заттардың концентрациясы . . . 207
№30 Гидрофильді зольдер алу және олардың кейбір қасиеттері . . . 208
№31 Коллоидты ерітінділерді тазалау . . . 209
№32 Зольдерді диализдеу . . . 212
№33 Коллоидты системалардық оптикалық қасиеттері . . . 213
№34 Тұтқырлық . . . 215
№35 Капиллярлы вискозиметр көмегімен тұтқырлықты анықтау . . . 218
№36 Тұтқырлық ортада шариктің түсуі . . . 220
Коллоидтық химия бойынша ұсынылатын лабораториялық жұмыстар . . .
тізімі . . . 222
Тест тапсырмалары . . . 224
Қосымша кестелер . . . 249
Бақылау сұрақтары . . . 259
Типтік бағдарлама бойынша қаралатын тақырыптар . . . 261
Семинар сабақтардың тақырыптары . . . 264
Студенттердің оқытушы қатысуымен орындауға ұсынылған өзіндік жұмыстардың тақырыптары . . . 264
Студенттердің өзіндік жұмыстарына арналған тақырыптар . . . 265
Студенттердің өзіндік жұмыстарына сұрақтар . . . 265
Студенттердің өздігінен дайындалатын тақырыптары . . . 271
Әдебиеттер мен ақпарат алу көздерінің тізімі . . . 273
Мазмұны . . . 275
КОЛЛОИДТЫ ЖҮЙЕ
Коллоидты жүйе туралы түсінік
Коллоидты жүйе туралы зерттеулерді итальян оқымыстысы Ф Сельми 1845 жылы жүргізді. Ол белгілі көлемдегі суда таралған күкірт, хлорлы күміс, берлин көкшіл бояуы сияқты жүйелерді зерттеді. Ол басқа мысалы ас тұзы ерітіндісіне қарағанда бұл ерітінділердің бөлшектерінің үлкен ірілеу екенін байқады. Ал 1861 жылы Томас Грэм коллоидты химияның дамуы үшін өте маңызды зерттеулер жүргізіп, дисперсті жүйені диффузия жылдамдығына қарап, жақсы және нашар еритін диффузияланушы деп екі класқа бөлді. Оларды крисаллоидтар және коллоидтар деп атады. Т. Грэм кристаллоид пен коллоидты бір-бірінен бөліп алу әдісін ашты және бұл әдісті диализ деп атады. Бір зат өте майда түрде /дисперсті фаза/ басқа бір зат / дисперсті ортада/ көлемінде біріңғай таралса, ол жүйені дисперстік жүйе дейді.
Дисперстік фаза мөлшеріне орай ірі және майда дисперсті жүйе болады. Егер бөлшекткрдің мөлшері 10 -3 -10 -5 см болса, оларды ірі дисперстік жүйе дейді. Оларға суспензиялар (қ/с), эмулсиялар (с/с) және көбіктер жатады. Дисперсті фазаның бөлшектерінің мөлшері 10 -5 -10 -7 см болса, майда дисперстік жүйе дейді. Оларды коллоид ерітінділер немесе зольдер дейді. Зольдерді диспергирлеу (майдалау) және конденсациялау/ұлғайту/ әдістерімен алады. Екі жағдайда да дисперстік фаза дисперстік ортада ерімеуі тиіс. Зольдің құрамында дисперстік фазаның бөлшектері үлкен агрегаттарға бірікпеуі үшін арнайы зат- стабилизатор қосады. Золь арқылы /суспензия мен эмульсия арқылы да/ сәуле өткізгенде жарқыраған конус байқалады. Оны Тиндаль конусы дейді. Бұл дисперсті жүйенің гетерогенділігін көрсетеді және дисперсті фаза бөлшектерінің сәулені шағылыстыруынан болады. Зольдің дисперстік фаза бөлшектерінің мөлшерлері өте кішілігіне /10 -5 -10 -7 см/ қарамастан, олардың құрылымы өте күрделі. Кальций карбонатының судағы золін мысал ретінде алайық. Ол үшін мына реакцияны пайдаланамыз:
СаСl 2 + Na 2 CO 3 = CaCО 3 + 2NaCl (1)
Стабилизатор ретінде кальций хлоридін аламыз- оны артық мөлшерде қосамыз.
СаСl 2 → Са 2+ + 2Сl - (2)
Судағы ерімейтін кальций карбонаты, CaCО 3 молекулалары бір-біріне жабысып, болашақ бөлшек ядросын құра бастайды, алайда артық иондардың адсорбциясы нәтижесінде ядроның әрі қарай өсуі тоқтайды. Мынадай ереже есте қалу керек: кез келген қатты заттың бетіне кристалл торды толтыра алатын, яғни сол беттік қабатпен ортақ атомдық топтары бар иондар алдымен адсорбцияланады. Біздің мысалда беттік қабатқа Са 2+ не CО 3 2- иондары адсорбцияланады, алайда артық мөлшерде тек Са 2+ ионы бар. Сондықтан Са 2+ ионы беттік қабатқа адсорбцияланады. Ядро бетіне адсорбцияланатын иондар потенциал көрсеткіш деп аталады. Потенциал- көрсеткіш иондар ядроға жақсы тартылады да, өзіне қарама- қарсы зарядты/ бізде-Сl - / тартылады, оларды қарсы иондар деп атайды. Қарсы иондардың біразы бетінде жақсы ұсталады, ал басқа бөлігі диффузия нәтижесінде диффузиялық қабатта орналасады .
{[/m CaCО 3 / • n Са 2+ • 2/ n -х/ Сl -- ] 2х+ •2х Сl -- } 0
ядро адсорбциялық қабаты диффузиялық қабаты
түйіршік (гранула)
мицелла
демек, адсорбциялық және диффузиялық қабаттарды артық мөлшерде алынған электролиттер, яғни стабилизатор иондарын құрады. Сол сияқты күміс нитратын мысал ретінде аламыз, және де АgNO 3 артық алынғандағы AgI мицелласының түзілуін көреміз.
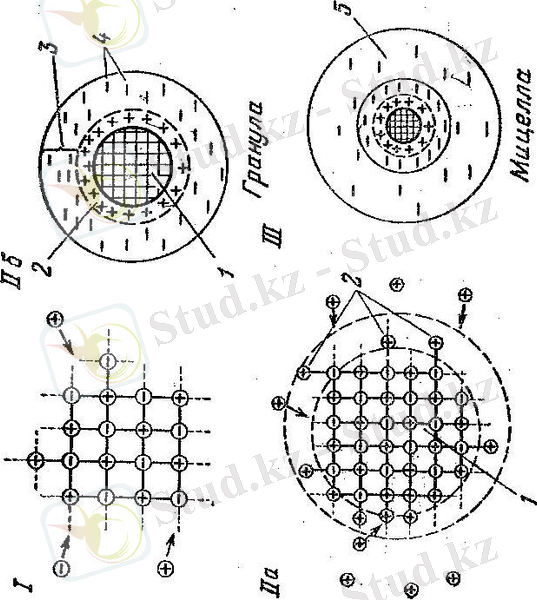
1- СУРЕТ
Адсорбциялық қабатпен ядроны коллоид бөлшек немесе гранула дейді . Түйіршік пен диффузиялық қабат қосылып мицелла түзеді. Әрқашан n >х болғандықтан коллоид бөлшектің заряды болады. Біздің мысалда оң заряд. Егер кальций карбонаты, CaCО 3 золін даярлау кезінде артық мөлшерде натрий карбонаты, Na 2 CO 3 ерітіндісі алынса, мицелла құрамы мынадай болады:
Na 2 CO 3 →2Na + + CO 3 2- (3)
{[/m CaCО 3 / • n СО 3 2- • 2/ n -х/ Na + ] 2х- •2х Na + } 0
колоид бөлшектерде бірдей электр зарядының, гидрат қабатының және белгілі / броундық/ қозғалыстың болуы зольдің тұрақтылығын көрсетеді. Зольдің тұрақтылығын белгілі бір жағдайда ғана сақталады. Жағдай өзгерген кезде коллоид бөлшектердің бірігуі нәтижесінде золь бөлінеді. Осындай коллоид бөлшектердің үлкен бөлшектерге айналуын коагуляция деп атайды. Коагуляция жүрген сайын золь тұманданып, коллоид бөлшектер тұнбаға түсе бастайды. Коллоид бөлшектердің тұнбаға түсу процесі седиментация деп аталады. Алайда, практикада осы екі процесті/ үлкею мен тұну/ жай коагуляция дейміз. Әр түрлі электролиттерде, араластыру, сілку, өте қатты қыздыру не суыту, центрифугалау арқылы коагуляция тудыруға болады. Барлық жағдайда коагуляцияның себебі бөлшектердің дисперстік ортамен байланысының әлсіреуі болып табылады. Золь тұрақтылығының басты себебі электр заряды бір аттас иондардың болуы, олар иондардың бірігуіне кедергі келтіреді. Сондықтан коагуляциялау әдістері осы зарядтарды компенсациялауға, яғни электролит қосуға негізделген. Зольге электролит қосқанда ерітіндідегі иондардың жалпы концентрациясы артады, соған орай мицелланың көпшілігі диффузиялық қабаттан адсобциялық қабатқа өтеді, соған орай бөлшектің заряды төмендейді. Электрлік тебіліс күштері төмендеп, бөлшектер бір- бірімен бірігіп үлкен бөлшектерге айналады. Сонымен, золь агрегаттық, содан соң кинетикалық тұрақтылығын жояды /үлкен бөлшектер тұнбаға түсе бастайды/. Тұнбаны коагулянт дейді. Коагуляцияны электролиттің коллоид бөлшек зарядына қарсы заряды бар ионы тудырады. Иондар заряды өскен сайын оның коагуляциялық қабілеті артады. Коагуляцияны электролит қоспасымен іске асыруға немесе қарсы заряды бар екі зольдің өзара коагуляциясы арқылы жүргізуге болады. Сольват қабығы шамалы лиофобтық зольдерді коагуляциялау жеңілірек. Олардың тұнбалары ұнтақ не сулы қабыршықтар болады. Лиофильдік зольдерді коагуляциялау қиын және көбінесе қоймалжың тұнба түзеді. Кейде барлық золь тығыз массаға гельге айналады. Жаңадан түзілген гельдер қайтадан зольге айнала алады. Бұл процесті пептизация, ал тудыратын затты пептизатор дейді. Пептизаторлар/ көбінесе электролиттер/ бөлшектің бетіне адсорбцияланып, олардың бір- біріне әсерін әлсіретеді, соның нәтижесінде агрегаттар ыдырап, гель зольге айналады.
гель→золь ( пептизация)
золь→гель ( гельдің түзілуі)
Золь арқылы (суспензия мен эмульсия арқылы да) сәуле өткізгенде жарқырыған конус байқалады. Оны Тиндаль конусы дейді. Бұл дисперсті жүйенің гетерогенділігін көрсетеді және дисперсті фаза бөлшектерінің сәулені шағылыстыруынан болады. Зольдің дисперстік фазасы бөлшектерінің мөлшерлері өте кішілігіне (10 -5 -10 -7 см ) қарамастан, олардың құрылымы өте күрделі. Кальций карбонатының судағы золін мысал ретінде алайық. Ол үшін мына реакцияны пайдаланамыз :
CaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl ( 4 )
Стабилизатор ретінде кальции хлоридін аламыз, оны артық мөлшерде қосамыз.
CaCl 2 → Ca 2+ + 2Cl - (5)
Мицелла құрамы мынадай болады:
Νa 2 CO 3 → 2Na + + CO 3 2- (6)
mCaCO 3 •CO 3 •2(n-x) Na + ] •2xNa+ 0
Коллоид бөлшектерде бірдей электр зарядының, гидрат қабатының және белгілі қозғалыстың болуы зольдің тұрақтылығын көрсетеді. Зольдің тұрақтылығын белгілі бір жағдайда ғана сақталады, ал жағдай өзгерген кезде коллоид бөлшектердің айналуын коагуляция дейді . Коагуляция жүрген сайын золь тұманданып, коллоид бөлшектер тұнбаға түсе бастайды.
Коллоид бөлшектердің тұнбаға түсу процесі седиментация деп аталады. Әр түрлі электролиттерде, араластыру арқылы ұйытуға болады.
Суспензия- қатты дисперстік фазаның сұйық дисперстік ортада таралған микрогетерогенді жүйе. Ондағы қатты бөлшектердің өлшемі 0, 1 мкм<10мкм.
Көбіктер-дисперсті фазасы газ, ал дисперсті ортасы сұйық болса сұйық көбік , ал дисперсті ортасы қатты зат болса қатты көбік деп аталады.
Сонымен, зерттеулерді итальян оқымыстысы Ф. Сельми 1845 жылы жүргізгені белгілі. Ол белгілі көлемдегі суда таралған хлорлы күміс, күкірт, берлин көкшіл бояуы сияқты жүйелерді зерттеген. Осы заттардың суда ерімейтіні және олардың белгілі бір жағдайларда шөгінді түрінде бөлінетіні мәлім. Алайда Сельми алған жүйелер сырт көрінісі, мөлдірлігі жағынан судағы ас тұзы мен мыс купоросының нағыз ерітінділері сияқты болып көрінетін. Бұл аса төменгі концентрациядағы көрініс еді. Сонда да Сельми хлорлы күміс, күкірт, берлин көкшіл бояуы мен су жүйелеріндегі бөлшектердің судағы ас тұзы және мыс купоросының бөлшектеріндей майда емес, олардан гөрі ірілеу екенін болжады.
Сельми тәжірибесін қайталаған Н. Нэгели хлорлы күміс, күкірт, берлин көкшіл бояуына өздеріндей суда ерімейтін заттарды қосып, нағыз ерітінділер қатарын көбейтіп салыстырады. Нағыз ерітінділердегі әр молекула жеке-жеке жүрсе, хлорлы күміс, күкірттердің бірнеше молекуласы бірігіп, агрегат түрінде болғандықтан ірілеу болады және олар өз салмағын көтере алмай шөгінді түрінде тұнбаға түседі деген пікір айтады. Нэгели мұндай көп молекуладан тұратын агрегаттарды басқа жекеленген молекуладан ажырата білу мақсатымен оны «мицелла» деп, ал мицелласы бар жүйені «зольдер» деп атауды ұсынды. Сонда мицелла дегеніміз бірнеше молекуланың топтасқан жиынтығы да, золь осы мицелланың ерітіндісі екен. Бұл екі термин де ғылыми әдебиет пен оқулықтарға берік енген.
1857жылы М. Фарадей белгілі көлемдегі суда біркелкі таралған алтын золінен тұратын жүйені зерттейді. Мұндай жүйені ертедегі алхимиктер судағы алтын тұзының ерітінділерін тотықсыздандыру арқылы алып, «алтын сусыны» немесе «алтын су» деп атаған. Ал Фарадей болса, алтын золінің оптикалық қасиеттерін зерттегенде, онда алтын өте ұсақ жекеленген күйінде жүретінін анықтады.
1861жылы Томас Грэм коллоидты химияның дамуы үшін өте маңызды роль атқаратын зерттеулер жүргізді. Ол барлық заттарды диффузия жылдамдығына қарай жақсы және нашар диффузияланушы деп екі классқа бөлді. Жақсы диффузияланушыларды кристаллоидтар, ал нашар диффузияланушыларды коллоидтар деп атады. Сол сияқты Т. Грэм кристаллоид пен коллоидты бір-бірінен бөліп алу әдісін ашты және ол бұл әдісті диализ деп атады. Бұл әдісте табиғатта кездесетін кейбір жарғақ сияқты заттардан әзірленген жұқа пленканың өзі арқылы нағыз ерітіндіні өткізіп, коллоидты ерітінділерді сүзгіден өткізбей алып қалатын қасиеті пайдаланылған. Мысалы, Грэм өз тәжірибелерінде өгіз қуығының қабығын пайдаланып, оны ас тұзы мыс сульфаты сияқты нағыз ерітінділерге батырғанда, не оның ішіне әлгі ерітінділерді құйғанда, одан ерітіндідегі иондар ешбір кедергісіз өте берген. Ал, бұл тәжірибені коллоидты ерітінділермен, мысалы сол кезде жақсы белгілі хлорлы күміс, күкірт, берлин осылайша Грэм коллоидты заттарды шектейтін және оны бөліп сипаттайтын мүмкіндікті анықтады.
Т. Грэм диффузияны зерттеп, диализді қолданды және құрамында органикалық заттары бар жүйелермен жұмыс істеді. Желатин, пектин, казеин, гуммиарабиктің диффузия жылдамдығы нашар, әрі диализ кезінде жарғақты мембранадан өтпейді. Олар кезінде желім жасауға жұмсалатын, сондықтан да Т. Грэм латынның colla (желім) сөзі негізінде ғылым тіліне коллоид сөзін енгізді. ХХ ғасырдың басында Р. Зигмонди, Ж. Перрен, Т. Сведберг және басқа да ғалымдар жүргізген зерттеу жұмыстары коллоидты жүйе қасиетіне онда таралған зат бөлшектерінің көлем өлшемі айтарлықтай әсер ететінін көрсетті. Бөлшек шамасы броундық қозғалыстың интенсивтілігін, салмақ әсерінен олардың шөгу қабілетін және коллоидты жүйенің оптикалық қасиетін анықтайды.
Коллоидты жүйелерді толық сипаттау үшін, оның қасиеті тек бөлшек өлшеміне ғана функционалды тәуелділікте болады деген пікірдің жеткіліксіздігін Н. П. Песков 1917 жылы көрсетті. Ол- бөлшек өлшемін өзгеріссіз сақтай алатын коллоидты жүйенің қабілетін анықтайтын факторларды ескергенде ғана мүмкін болатын жай. Бөлшек өлшемі олардың бір-біріне жабысып, бірігуі нәтижесінде өзгереді және осы құбылысты коагуляция немесе ұю дейді. Ұю процесіне қарсы тұратын қабілеттілік агрегаттық тұрақтылық болады.
Коллоидты химияда фаза, жүйе, гомогенді және гетерогенді жүйелер сияқты физхимиядағы түсініктер қолданылады. Дисперсті ортаны еріткішпен, ал дисперсті фазаны еріген затпен, дисперсті жүйені ерітіндімен салыстыруға болады.
Коллоидты химия қазір ғылыми-техникалық прогресте маңызды роль атқарады. Коллоидты химиялық процестер болмаса, радиоэлектронды, тамақ және жеңіл өнеркәсіптегі, құрылыс материалдарды, медициналық дәрі-дәрмектерді өңдіру және онымен байланысты технологиялық операцияларды жүзеге асыру мүмкін емес. Коллоидты химиядағы алғаш зерттелген ғылыми жұмыстар мен әдістер қазір биохимия, биотехнология және биофизика секілді ғылым салаларында кеңінен қолданылуда. Коллоидты химияны оқу, оны білу ғылым мен техниканың көп саласындағы мамандар үшін өте қажет және маңызды.
Коллоид күйінің ерекшелігі. 1. Барлық коллоидты ерітінділердің сәуле шашырату қабілеті болады (мұны опалесценциялау дейді) . Бұл құбылысты тәжірибе жүзінде жасап көруге болады. Ол үшін сәуле жолына линза қойып, одан шыққан сәулені коллоидты ерітінді арқылы жіберсе, одан опалесценцияны көруге болады. Мұны Тиндаль конусы дейді.
2. Нағыз ерітінділермен салыстырғанда коллоидты ерітінділердегі диффузия жылдамдығы төмен.
3. Коллоидты ерітінділердің осмостық қысымы аз, кейде оларды байқау да қиын. Демек, коллоидты ерітінділердегі диффузия жылдамдығы мен осмостық қысымының төмен болуы ондағы еріген зат бөлшегінің нағыз ерітіндімен салыстырғанда ірі екендігін көрсетеді. Расында да коллоидты ерітіндідегі бөлшек ірі болған сайын оның диффузия кезіндегі қозғалысы қиындап, жылдамдығы төмендейді, өйткені бөлшек іріленген сайын кедергі де арта түседі. Сондай-ақ ондағы бөлшек өлшемі осмостық қысымға әсер етеді. Берілген бірдей көлем мен тығыздықтағы екі ерітіндінің қайсысында бөлшек ірілеу болса, сонда бөлшек саны аз болады. Ал осмостық қысым концентрацияға, яғни бөлшек санына тікелей тәуелді.
4. Коллоидты ерітінділер диализге бейім, яғни онымен ерітіндіде бірге еріген төменгі молекулалы заттарды жартылай өткізетін жарғақты пленкалар көмегімен тазартуға болады. Мұндайда төменгі молекулалы заттар (нағыз ерітінділер) жарғақ арқылы өтеді де, коллоидты ерітінділер қалып қояды.
5. Нағыз ерітінділер өте тұрақты, ал коллоидты ерітінділер тұрақсыз. Олай болса, коллоидты бөлшектер болмашы ғана сыртқы әсер салдарынан коагуляцияланады.
6. Коллоидты ерітінділер, әдетте, электрофорез құбылысына бейім. Бұл құбылыс электр өрісіндегі коллоидты бөлшекті оң, не теріс электродқа тасымалдаумен сипатталады.
Бірнеше ондаған жылдар бойы жүргізілген зерттеу жұмыстарының нәтижесін топтастырып, тұжырымдап қарағанда, заттардың коллоидты күйі дегеніміз, ол молекула емес, көптеген молекуладан жинақталған жекеленген агрегат түрінде жүретін аса майда ұнтақталған, яғни жоғары дисперстелген жүзгінді (дисперсті) түрі екен. Осы айтылғанды коллоидты жүйедегі коллоидты күйдің анықтамасы ретінде қабылдай отырып, коллоидты жүйенің кәдімгі, яғни нағыз ерітіндіден өзгешелігін көрсететін негізгі пікірлерді тұжырымдауға болады. Коллоидты бөлшектер көптеген молекулалардан тұратындықтан да оларға фазадағы термодинамика заңдылықтарын қолдануға болады. Кәдімгі ерітіндімен салыстырғанда коллоидты ерітінді екі фазадан тұратын гетерогенді жүйе екен. Әр коллоидты ерітінді гетерогенді жүйе болғандықтан, оның басты шарты бір фазадағы заттың екінші фазадағы затта ерімеуі немесе нашар еруі.
Коллоидты химиядағы басты проблемалардың бірі - агрегаттық тұрақсыздық. Бөлшектердің тұрақсыз болуының негізгі себептері термодинамикалық және кинетикалық тұрғыдан түсіндіріледі. Коллоидты жүйедегі агрегаттық тұрақсыздық жүйедегі фазааралық жанасу бетке шоғырланған энергияның оң және айтарлықтай үлкен мәнде болуына байланысты екен. Ол бос энергияға тең болғандықтан, мұндай жүйелердің бәрі де тұрақсыз екені термодинамикадан белгілі. Бұл жайт коллоидты жүйелердің ұюына, коагуляциялануына әкеледі. Мұндайда бөлшектер бір-біріне жанасып, бірігеді және фазааралық беткі қабат азайып, жүйедегі бос энергия кемиді. Коллоидты жүйенің күйін термодинамикалық тұрғыдан өте қарапайым әдіспен талқылауға болады. Әйтсе де мұндай талқылау агрегаттық тұрақсыздықтың негізгі түпкі мәнін ашпайды. Сол сияқты термодинамика жүйедегі бос энергия мен жүйенің тұрақсыз күйде қанша уақыт болатынын және олардың арасындағы байланысты көрсетпейді. Сондықтан да коллоидтық жүйенің агрегаттық күйі жайлы мәлімет толық және нақтылы болу үшін термодинамикалық талқылау физикалық кинетикамен толықтырылады.
Кинетикалық тұрғыдан коллоидты немесе микрогетерогенді жүйенің күйі ондағы жекеленген бөлшектер арасындағы әсер етуші күштердің қатысымен анықталады. Мұндай күштерге бөлшектердің тартылыс күші және коагуляцияға кедергі болатын тебіліс күші жатады. Кейде тартылу күшін ілініс күші деп те айтады. Бұл күш пен молекулааралық күштің тегі бірдей. Бөлшектер бір- біріне жақындағанда олардың арасындағы күштің мәні артады. Жүйеде кездесетін электролит иондарының фазааралық беткі қабатқа таңдамалы адсорбциялануы нәтижесінде пайда болатын электр күштері де тебіліс күші бола алады. Сондықтан да коллоидты жүйенің салыстырмалы тұрақтылығы бөлшектердің өзара жақындай түсуіне қарсы тұра алатын тебіліс күшінің жеткілікті не артық болуымен анықталады. Бұл көптеген коллоидты жүйенің тұрақсыздығына қайшы келе бермейді, өйткені бөлшектер бір-біріне өте жақындаған сәтте ондағы тартылыс күші тебіліс күшінен артық болады және жекеленген екі бөлшекке энергетикалық тұрғыдан агрегат құрастыру тиімді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz