Элемент тұжырымдамасы және электролиттегі орнын басу реакциялары: электродтық потенциал және гальвани элементінің электр қозғаушы күші


Жоспар:
І. Кіріспе
1. «Элемент» туралы жалпы түсінік 2
ІІ. Негізгі бөлім
1. Электролит ерітінділеріндегі орнын басу реакциялары 3
2. Электродтық потенциал. Гальвани элементі туралы түсінік 4
3. Гальвани элементінің электр қозғаушы күші 9
ІІІ. Қорытынды 11
ІV. Пайдаланылған әдебиеттер 12
Кіріспе
«Элемент» туралы жалпы түсінік
Грек философиясы натурфилософиялық тұрғыда болған, адамға тікелей әсер ететін дүниені түсіндіруге тырысқан.
Илиада мен Одиссеяда күллі дүние мұхиттан, судан жаралған деген пікірге кездесеміз. Грек философиясының негізгі элементтер - су, ауа, от және жер деуі, дүниенің негізгі материялық екендігін мойындаудан шыққан. Бірақ Аристотель бұл төрт элементке, метариялық емес, бесінші элемент - квинтэссенция - эфирді қосқан және оны ең бастысы деп санаған.
Орта ғасырларды, әсіресе Европада, Аристотельдің элемент жайындағы ілімі кең тарады, ол 200 жылға жақын уақыт үстемдік етіп, алхимиктердің металдарды трансмутациялау (жай металды алтынға айналдыру) жұмыстарына теориялық негіз болды. Алхимия дәуірінде Аристлотельдің элементтеріне тағы үш элемент қосылды: сынап - металдық қасиеттің, күкірт - жанғыштық пен бейметалдық қасиеттің, тұз - ерігіштік қасиеттің иелері. Кейбір алхимиктер - спирт, май, флегма сияқтыларды да элементтер санына қосуды ұсынды.
XVII орта шенінде химиялық өзгерістер жайында мәлімет көбейген сайын, элемент деген түсінікке ойша емес, эксперимент қорытындысына сүйеніп ғылыми анықтама беру керек деген пікірлер туды. Химияға «элемент» деген сөзді енгізіп, оған жаңа түсінік берген Р. Бойль (1661 жылы «Химик скептик» деген кітабында) . Бойльдің пікірінше, элемент дейтініміз қарапайым, өзінен басқа еш затпен қослмаған, басқа барлық заттарды түзетін, күрделі заттар айырылғанда ақтығында шығатын зат. Бұл анықтама дұрыс болғанымен, ол кездегі эксперимент жасаудық дәрежесі төмен болғандықтан, қай заттардыэлементтер қатарына жатқызу керек екендігі анықталмады. Айталық ол кезде бір тәжірибеде болып жатқан химиялық процестің айрылу не қосылу реакциясы екенін айта алмайтын кез еді, мысалы, Бойль алтын, мыс, сынап, күкірт сияқты заттардың элемент не элемент емес екеніне көз жеткізе алмаған, ал суды элемент деп санаған. XVIIІ ғасырда, химиялық тәжірибеде таразы тиісті орын алып, анализ бен синтез деген түсініктер ажырап, сапалық анализбен қатар, сандық анализ жасау күшейген кезде, элемент деген түсінікке Бойльдің берген анықтамасын дәлелдйтін эксперименталдық материалдар көбейді. Сөйтіп, бұрын күмәнді болып жүрген біраз заттар элемент қатарына кірді, жаңадан - сутек, оттек, азот, хлор сияқты газ түріндегі элементтер табылды. Бұл жөнінде Лавуазье бірқатар еңбек сіңірді. Ол сол уақытта белгілі элементтердің (жай заттардың) тізімін жасады. Лавуазьенің заманында элемент пен жай зат деген түсініктерді ажыратпайтын. Лавуазье 1789 жылы жасаған химиялық элементтердің бірінші тізімінде 33 заттың аты бар. Ол тізімде жарық, жылу сияқты элемент еместер болды, әк, глинозем, кремнезем сияқты оксидтер және радикалдар да кірді, нақты элементтер 23 қана еді.
Химия тарихында ерекше табысты ғасыр, химияның теориялық негіздері - атом-молекулалық теория және элементтердің периодтық системасы ашылған - XІX ғасырда химияда элемент жайындағы білім аса көбейді. Ескі заманнан және
орта ғасырлардан белгілі заттардың қайсысы химиялық элемент екендігі анықталды.
Химиялық элементтердің саны көбейген сайын, олар жайындағы білім көбейіп, оларды бір тәртіпке келтіріп жинақтау керек бола берді. Элементтердің қасиеттерін салыстырып ерте уақыттан -ақ металл және бейметалл деп екіге бөлетін.
Электролит ерітінділердегі орнын басу реакциялары
Электролит ерітінділерінде жүретін әрекеттесулердің бір тобы орнын басу реакцияларына жатады. Оған мысал ретінде металдардың қышқылдармен әрекеттесуін алайық:
0 +1 +2 0
Zn+2HCl=ZnCl 2 +H 2
иондық түрі:
Zn+2H · =Zn+H 2
Теңдеуден көрініп тұрғандай, мырыш атомы өзінің сыртқы қабатындағы валенттік 2 электронын сутектің оң ионына беріп тотығады. Сутектің оң ионы өзіне жетімсіз электронын қосып алып тотықсызданады. Мұндағы Zn - тотықсыздандырғыш, H · - тотықтырғыш қызмет атқарып тұр.
Металл атомдарының электронын оңай беруі оларды сипаттайтын негізгі қасиетіне жатады. Металдық қасиеті айқын көрінетін элементтер күшті тотықсыздандырғыштар қатарына жатады. Бірақ металдардың электронын беру қабілеті әрқайсысында әр түрлі болыр келеді. Ол неғұрлым өз электронын оңай берсе, соғұрлым активті, яғни басқа заттармен қуатты түрде әрекеттесе алады.
Демек, металдардың өзара активтігін айыра білсек, олардың қаншалықты қуатты тотықсыздандырғыш екенін де бағалаймыз. Металдардың салыстырмалы активтігін тұздар ерітісіндегі екінші бір металл атомын ығыстырып шығару қабілетіне сай, яғни орнын басу реакциясына орай білуге болады. Мысалы мырыш таяқшасын қорғасынның ерімтал тұздарының бірі - қорғасын нитратының ерітіндісіне салайық. Бұдан мырыш таяқшаның аздап еріп, ерітіндіден қорғасынның бөлініп шығып, мырыштың үстіне қонғанын көреміз. Реакция теңдеуін жазсақ:
0 +2 0 +2
Zn+Pb(NO 3 ) 2 =Pb+Zn(NO 3 ) 2
иондық түрі:
Zn+Pb ·· =Pb+Zn · · +
Бұл әрекеттесу де тотығу-тотықсыздану реакциясына жатады. Мырыш атомы өзінің 2 электронын қорғасынның екі валентті оң ионына беріп тотығады, қорғасын ионы ол электрондарды қосып алып тотықсызданады. Осыған керісінше, мырыш нитраты электролитін алып, оған қорғасын таяқшасын салсақ, ешбір реакцияның болмайтынын байқар едік. Осының өзі-ақ қорғасынмен салыстырғанда мырыштың актив екендігін, бақаша айтқанда мырыш атомы қорғасынға қарағанда өз электрондарын оңай беріп, ал ионы - электрондарды әлсіздеу қосып алатындығын көрсетеді.
Дәл осылайша, қорғасын мен мыстың өзара активтігін салыстырсақ, біріншісінің екіншісіне қарағанда басым болып, мысты тұзының құрамынан қорғасын ығыстырып шығарып, орнын басатындығын анықтаймыз:
Pb+Cu ·· =Pb ·· +Cu
Салыстыруға алынған металдар - мырыш, қорғасын, мыс үшеуінің ішіндегі ең активті мырыш, ал қорғасын активтігі одан төмендеу, ең пассивті мыс болып шықты.
Бір металдың екінші металды оның қосылыстарынан ығыстырып шығаруын алғаш рет егжей-тегжейлі зерттеген орыстың әйгілі ғалымы Н. Н. Бекетов болды. Ол металдардың активтігіне сай орналасқан қатарын жасап, «Ығыстыру қатары» деп атады.
Электродтық потенциал. Гальвани элементі туралы түсінік.
Таза суға мырыш пластинкасын батырсақ, оның беткі қабатындағы кристалдық тор көздерінің түйінідегі оң иондарының біразы полюсті су молекулаларының әсерінен үзіліп ерітіндіге өтеді. Иондар ерітіндіде су молекулаларымен ұстасып гидраттанады. Металдың иондарынан айырылған беткі қабатындағы электрондары бос қалып оны теріс зарядтайды. Міне, осы теріс зарядталған қабат ерітіндідегі оң иондар қабатымен электростатикалық тартылыста болғандықтан, ол иондар қайтадан металл бетіне келіп қонып та жатады және бүкіл гидраттанған оң иондар қабаты алысқа кетпей бетке жақын орналасады. Барған сайын металдың беткі қабатының еруі азайып, еріген иондардың қайта келуі молаяды, ақыры жүйедегі металдың еру жылдамдығы мен оның металға қайта келіп қону жылдамдығы теңесіп тепе-теңдік қалыпқа келеді.
Металл + су ↔︎ гидраттанған металл ионы + электрондар
(ерітіндіде) (металл кристалында)
металл мен ерітіндінің түйіскен жерінде түзілген қабатты электрлік қос қабат деп атайды (1-сурет), қабаттар арасындағы потенциалдар айырымын металдың электродтық потенциалы дейді (латынша potentia - мүмкіндік, қуат) .
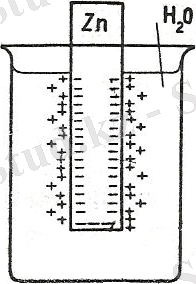
1-сурет. Металл-сұйық түйіскен жеріндегі электрлік қос қабат
Егер таза суға металдың ерімтал тұздарының бірін қоссақ, қабаттар арасындағы тепе-теңдік күй өзгереді. Ерітіндіде еріген металл иондарының көбеюі оның металл бетіне барып қайта қонуын арттырады. Неғұрлым еріген тұздың концентрациясы молайса, соғұрлым металдың еруі азая береді. Жоғары концентрлі тұз ерітіндісіне малынған металл ерімей, зарядталған қабат түзілмеуі де мүмкін.
Металл активтігі төмен болып, ерітіндідегі иондарының мөлшері жеткілікті болса, керісінше оң иондар ерітіндіден бөлініп, металл бетіне барып жабылады да, ерітінді теріс, металл оң зарядталады. Мұнда да белгілі бір электродтық потенциал айырымы туады. Өз тұздарының ерітіндісіне малынған электродтар активтігіне сай теріс (өте актив металдар), немесе оң (активтігі тым төмен металдар) зарядталып отырады.
Іс жүзінде суға яки электролит ерітіндісіне батырылған кез келген металды электрод деп ала береді.
Айта кетерлік бір жай, металды өз тұзының ерітіндісіне салғанда ерітіндіге ауысатын иондар мөлшері тым аз, оны химиялық әдіспен оп-оңай анықтау мүмкін де емес, бірақ қос электр қабатының арасында туатын потенциалдар айырымын қашанда арнаулы құралдармен өлшеуге жетерліктей болады.
Электродтық потенциал дегеніміз металл (электрод) мен сұйық фазаның (су яки электролит ерітіндісі) түйіскен жерінде туатын электростатикалық потенциал болып табылады.
Металл мен сұйықтың арасында тұрақталған тепе-теңдік күйді қолдан өзгертуге болады, ол үшін металл бетіне жиналған артық электрондарды үздіксіз алып кетіп отырса болғаны. Дәл осы негізде жұмыс істейтін химиялық энергияны электр энергиясына айналдырып отыратын гальвани элементтері болады.
Гальвани элементтерінің қарапайымдарының бірі мыс-мырыш гальвани элементтің схемасы 2-суретте көрсетілген. Мұндағы өз тұздары ZnSO 4 пен CuSO 4 ерітіндісіне батырылған мырыш пен мысты гальвани элементінің электродтары деп атайды. Екі тұздың ерітіндісі өзара кеуек тоспамен бөлініп тұрады.
Актив металл мырыш пластинкасының бетінде электрондар қалатындықтан теріс, ал активтігі төмен мыс пластинкасына оң иондар жиналатындықтан оң зарядталады. Егер осы екі пластинканы өзара сыммен жалғастырсақ мырыштағы артық электрондар тобы электрондар жетпей тұрған мысқа қарай ағады, нәтижесінде сыртқы тізбекте электр тогы туады.
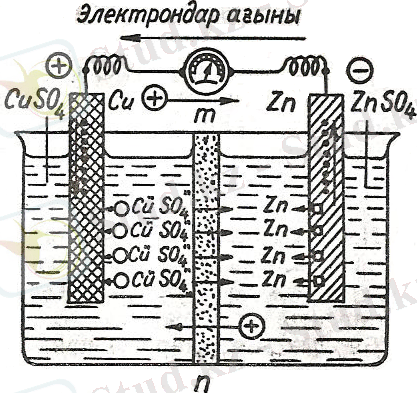
2-сурет. Даниель-Якоби элементінде электр қозғаушы күшінің туу схемасы
Мысқа ағылып келген электрондар оның бетіндегі мыс тұзының ерітіндісінен келген Cu - иондарын нейтралдап (зарядын жойып) отырады, ал жаңа түзілген нейтрал атомдар мыс электродтың бетіне жабысып жинала береді, CuSO 4 молекуласынан бөлініп жеке қалған SO 4 ’’ - сульфат иондары кеуек тоспадан өтіп мырыш пластинкадан келген мырыштың оң ионы (Zn) мен әрекеттесіп ерітіндіде ZnSO 4 түзеді. Дәл осылайша Zn ·· - иондары да мыс сульфатының ерітіндісіне қарай өтіп ондағы SO 4 ’’ - иондарымен қосылып ZnSO 4 түзеді.
Мырыш пластинкасының еруі өзінен2 электрон беріп тотығуы, мыс иондарының бейтараптануы өзіне 2 электрон қосып алып тотықсыздануы болып
табылады:
Zn - 2е = Zn ·· Cu ·· + 2е = Cu
Элементте жүретін тотығу-тотықсыздану процесі бір мезгілде өтаді, оның жалпы реакция теңдеуі мынадай:
Zn + Cu ·· = Zn ·· + Cu
Тотығу процесі жүретін электрод анод, ал тотықсыздану процесі жүретіні - катод деп аталады. Біз қарастырып отырған гальвани элементіндегі анод-мырыш, катод-мыс.
Гальвани элементінің негізіне алынған химиялық тізбекті арнайы схемамен белгілейді:
(+) Cu (CuSO 4 ) (ZnSO 4 ) Zn (-)
Мұндағы ерітіндіге оң иондарын беретін мырыш электрод теріс полюс, ерітіндіден оң иондарды жинайтын мыс оң полюсті көрсетеді; екі ерітіндіні бөлгіш тоспа - айырып тұрады.
Гальвани элементтірін өз тұздарына батырылған кез келген екі металдан жасауға болады. Өйткені электр тогы туу үшін екі электродта белгілі бір потенциалдар айырмасы туу жеткілікті ғой. Мәселен, мырыш пен темірді өз тұздарына батырғанда екеуі де теріс зарядталады, соған қарамастан электродтарды өзара қосқанда активтірек мырышқа жиналған электрондар, одан активсіздеу темірдегімен салыстырғанда молырақ болғандықтан біріншісінен екіншісіне қарай ағылып электр тогын тудырады. Бұл элементте жүретін реакция теңдеуі мынадай:
Zn + Fe ·· = Fe + Zn ··
Неғұрлым электрод ретінде алынған металдардың химиялық активтік айырымы алшақ болса, соғұрлым гальвани элементтерінде өтетін тотығу-тотықсыздану реакциясы қуаттырақ болып, мол электр тогы туады.
Барлық металдардың иондарының ерітіндідегі концентрациясын бірдей етіп алып, потенциалдарының мөлшерін анықтау олардың активтігін өзара салыстыруға мүмкіндік береді. Әдетте, әрбір жеке электродтың абсолюттік потенциалын өлшеу тым қиын, сондықтан іс жүзінде электродтардың салыстырмалы потенциалын тауып пайдаланады. Ол үшін бір металдың потенциалы екінші бір белгілі металдың (электродтың) потенциалынан қаншалықты артық немесе қаншалықты кем екендігін анықтайды.
Потенциалдарды салыстыруға арналған стандартты электрод ретінде
қалыпты сутек электродын алады (3-сурет) . Ол сутек иондарының концентрациясы 1000 г суда 1 моль болып келген 2 н. күкірт қышқылының ерітіндісіне батырылған, беті ұсақ платина түйіршіктерімен кеуектеу етіп, қапталған платина пластинкадан тұрады. Осы ерітіндіден 25 о С-та 101, 3 кПа қысым мен таза газ күйіндегі сутек үзбей жіберіліп тұрады. Ол кеуек бетке сіңіріліп бүкіл электрод сутектен жасалғандай әсер етеді. Электродтағы сутектен оң иондар ерітіндіге өтеді: H 2 + 2e = 2H + . Сонда электрод пен ерітінді арасында туатын сутек электродының потенциалын шартты түрде келісіп нөлге тең деп алған.
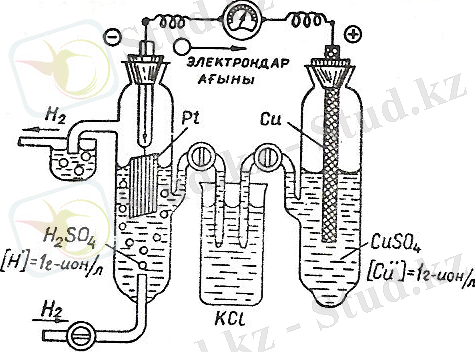
3-сурет. Мыстың қалыпты потенциалын анықтауға арналған қондырғының схемасы
Кез келген металдың салыстырмалы потенциалын табу үшін бірі стандартты сутекті электродтан, екіншісі сол металдың өзінен жасалған гальваникалық элемент құру қажет. Және ол металдың өз тұзындағы иондарының концентрациясы 1 моль 1 л болуы шарт. Рсында анықталатын салыстырмалы потенциал металдың қалыпты (стандартты) электродтық потенциалы болып аталады.
Қалыпты электродтық потенциалдың шамасы түрлі таңбамен белгіленеді. Ол таңба біздің және басқа біраз елдерде мынадай шартпен алынады: егер металл - стандартты сутек электроды жұбындағы металда тотығу процесі жүрсе теріс, тотықсыздану процесі жүрсе оң таңбалы болады. Минус таңба алынған металдың сутекпен салыстырғанда оңай тотығатындығын, ал металл иондары сутек иондарымен салыстырғанда қиындау тотықсызданатынын, көрсетеді. Керісінше металл сутекке қарағанда қиындау тотығып, оның иондары сутек
иондарынан оңай тотықсызданса электродтық потенциал мөлшері плюс таңбасымен алынады.
Стандартты сутек электроды мен 1 л судағы Zn иондары концентрациясы 1 моль/л болып келген ZnSO 4 ерітіндісіндегі мырыш электродының потенциалдарының айырымы 0, 76 В. Бұл мырыш металының қалыпты электродтық потенциалы, оны былайша суреттейді:
Е о Zn/Zn = - 0. 76 B
Мұндағы гальвани тізбегінің иондық схемасы мынадай:
(+) H 2 2H + Zn 2+ Zn
0 -0. 76 B
Гальвани элементінің электр қозғаушы күші
Металдарды, сутекті қоса, электродтар потенциалдарының алгебралық шамасының артуына сай орналастырса Н. Н. Бекетов тапқан кернеу қатарына сай келетін химиялық активтігі бірінен-бірі кеми орналасқан қалыпты электродтық потенциалдар қатары шығады (1-кесте) . Одан металдың қалыпты электродтық потенциалының алгебралық мөлшері неғұрлым кіші болса, соғұрлым химиялық активтігі жоғары болатындығын көреміз.
1-кесте
Металдардың кернеу қатары. Стандартты электродтық потенциалдар Е о , 25 о С
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz