Молекулярно-генетические основы биотехнологии: учебное пособие для магистрантов


Габдуллина Е. Ж., Лесова Ж. Т., Сейдахметова З. Ж.
Молекулярно-генетические основы биотехнологии
2019
удк
ббк
г
Габдуллина Е. Ж., Лесова Ж. Т., Сейдахметова З. Ж.
Молекулярно-генетические основы биотехнологии: учебное пособие. - алматы, 2019. - 95с.
Данное пособие по дисциплине «Молекулярно-генетические основы биотехнологии» предназначено для магистрантов ВУЗов, обучающихся по образовательной программе 7М05101 по специальности «Биотехнология» для изучения теоретических основ молекулярной генетики.
Молекулярно-генетические основы биотехнологии» рассматривает вопросы современной молекулярной биологии, принципы структурной организации ДНК и РНК, механизмы репликации, репарации и рекомбинации ДНК, механизмы транскрипции, посттранскрипционной модификации РНК и сплайсинга, структурно-функциональную организацию нуклеиновых кислот, современные представления о молекулярных механизмах репликации ДНК и функционирования генома, регуляцию экспрессии генов и технологии рекомбинантных ДНК.
удк
ббк
Рецензенты:
Доктор медицинских наук Демченко Г. А.
Кандидат биологических наук Абдрешов С. Н.
ISBN
Рекомендовано к печати Учебно-методическим советом АТУ
Габдуллина Е. Ж., 2019
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
История изучения ДНК насчитывает более века - с момента открытия в ядрах клеток вещества, названного нуклеином. Полвека назад было доказано, что именно ДНК является носителем наследственности, а затем установлена ее принципиальная молекулярная структура - двойная спираль. В настоящее время молекулярная генетика, то есть изучение того, каким образом хранится и реализуется записанная в молекуле ДНК наследственная информация, является одной из наиболее бурно развивающихся областей науки вообще и биологии в частности. Для полной расшифровки генетического текста человека создана крупнейшая биологическая программа нашего времени. Только в США ежегодный объем финансирования по программе составляет около 200 млн. долларов. Сотни лабораторий в мире вовлечены в работу. В России исследования по этому направлению выполняются в рамках государственной научно-технической программы "Геном человека".
С появлением молекулярной генетики методы генетических исследований принципиально обогатились. От привычных по школьным учебникам морфологических (цвет глаз, цвет семян) и биохимических (группа крови) признаков перешли к непосредственному изучению собственно молекулы ДНК. Такой переход связан с созданием хитроумных методов и подходов, позволяющих работать с признаками, выявляемыми на уровне исследования самой молекулы ДНК. А это не так уж просто: ДНК простенькой бактерии содержит миллионы пар нуклеотидов, а геном человека - более трех миллиардов пар. Вся ядерная ДНК в клетке человека содержится в виде 23 пар молекул, соответствующих хромосомам. Хромосомы каждой пары называются гомологичными. Линейные последовательности генов в них одинаковы, размер соответствующих гомологичным хромосомам молекул ДНК один и тот же. Исключение составляют половые хромосомы X и Y. Они сильно отличаются друг от друга по размеру и содержанию генов.
Геном человека содержит от 50 до 100 тысяч генов. Гомологичные гены (то есть гены, находящиеся в гомологичных хромосомах в одних и тех же локусах) определяют один и тот же признак (например, цвет глаз или группу крови), но могут находиться в разных аллельных состояниях, определяющих различные фенотипические проявления данного признака (глаза могут быть карими или голубыми и т. п. ) . Аллельные гены отличаются небольшими изменениями последовательности нуклеотидов в ДНК, которые в одних случаях приводят к изменению кодируемого геном продукта и соответствующему изменению фенотипа, а в других случаях никакого заметного влияния на фенотип организма не оказывают.
Уникальное сочетание аллельных состояний всех пар генов и определяет биологическую индивидуальность каждого человека. Например, последовательности ДНК автора и читателя (а также любых двух людей, кроме монозиготных близнецов) почти одинаковы - они различаются только одним нуклеотидом из трехсот. Эти различия на молекулярном уровне определяют то, чем мы друг от друга отличаемся внешне, - цвет волос, глаз, кожи, отчасти рост, вес. Выявление таких замен, определение их значения для развития того или иного признака организма в норме и патологии составляют предмет фундаментальных исследований в этой области науки. Полученные при этом результаты уже имеют множество практических приложений.
Данное учебное пособие позволяет обучающимся специальности «Биотехнология» ознакомиться с основными методами молекулярно-генетических исследований
Определение молекулярной биологии как науки
Молекулярная биология исторически появилась как раздел биохимии. Датой рождения молекулярной биологии принято считать апрель 1953 года, когда в английском журнале «Natur» появилась статья Джеймса Д. Уотсона и Фрэнсиса Крика с предложением пространственной модели молекулы ДНК. Основанием для построения этой модели послужили работы по рентгеноструктурному анализу, в которых участвовали также Морис Х. Ф. Уилкинсон и Розалинда Франклин.
Это основополагающее открытие было подготовлено длительным этапом исследований генетики и биохимии вирусов и бактерий.
В 1928 году Фредерик Гриффит впервые показал, что экстракт убитых нагреванием болезнетворных бактерий может передавать признак патогенности неопасным бактериям. Исследование трансформации бактерий в дальнейшем привело к очистке болезнетворного агента, которым, вопреки ожиданиям, оказался не белок, а нуклеиновая кислота. Сама по себе нуклеиновая кислота не опасна, она лишь переносит гены, определяющие патогенность и другие свойства микроорганизма.
В 50-х годах XX века было показано, что у бактерий существует примитивный половой процесс, они способны обмениваться внехромосомной ДНК, плазмидами. Открытие плазмид, как и трансформации, легло в основу распространённой в молекулярной биологии плазмидной технологии. Ещё одним важным для методологии открытием стало обнаружение в начале XX века вирусов бактерий, бактериофагов. Фаги тоже могут переносить генетический материал из одной бактериальной клетки в другую. Заражение бактерий фагами приводит к изменению состава бактериальной РНК. Если без фагов состав РНК сходен с составом ДНК бактерии, то после заражения РНК становится больше похожа на ДНК бактериофага. Тем самым было установлено, что структура РНК определяется структурой ДНК. В свою очередь, скорость синтеза белка в клетках зависит от количества РНК-белковых комплексов. Так была сформулирована центральная догма молекулярной биологии: ДНК ↔︎ РНК → белок.
Дальнейшее развитие молекулярной биологии сопровождалось как развитием её методологии, в частности, изобретением метода определения нуклеотидной последовательности ДНК (У. Гилберт и Ф. Сенгер, Нобелевская премия по химии 1980 года), так и новыми открытиями в области исследований строения и функционирования генов (см. История генетики) . К началу XXI века были получены данные о первичной структуре всей ДНК человека и целого ряда других организмов, наиболее важных для медицины, сельского хозяйства и научных исследований, что привело к возникновению нескольких новых направлений в биологии: геномики, биоинформатики и др.
Молекулярная биология изучает основные свойства и проявления жизни на молекулярном уровне. Важнейшими направлениями в Молекулярной биологии являются исследования структурно-функциональной организации генетического аппарата клеток и механизма реализации наследственной информации (молекулярная генетика), исследование молекулярных механизмов взаимодействия вирусов с клетками (молекулярная вирусология), изучение закономерностей иммунных реакций организма (молекулярная иммунология), исследование появления разнокачественности клеток в ходе индивидуального развития организмов и специализации клеток (Молекулярная биология развития) и т. д. Молекулярная биология выделилась из биохимии и сформировалась как самостоятельная наука в 50-х годах. Рождение Молекулярной биологии часто относят к 1953, когда была опубликована работа Дж. Уотсона и Ф. Крика о пространственной структуре молекулы ДНК (т. н. двойной спирали), причём биологическая функция этой молекулы была увязана с её химическим строением (ещё в 1944 О. Эйвери с сотр. установил, что ДНК является носителем наследственной информации) . В становлении Молекулярной биологии сыграли большую роль идеи и методы классической генетики, микробиологии, вирусологии, использование достижений точных наук - физики, химии, математики, кристаллографии, особенно рентгено-структурный анализ) . Основными объектами исследования в Молекулярной биологии являются вирусы, в т. ч. бактериофаги, клетки и субклеточные структуры (ядра, митохондрии, рибосомы, хромосомы, клеточные мембраны), а также макромолекулы (белки, нуклеиновые кислоты) . Наиболее крупные достижения Молекулярной биологии это - расшифровка структуры некоторых белков и установление связи между их структурой и функцией (М. Перуц, Дж. Кендрю, Ф. Сенгер, К. Анфинсен и другие) ; определение структуры и механизма биологической функции нуклеиновых кислот и рибосом (Дж. Уотсон, ф. Крик, Р. Холли и другие) ; расшифровка генетического кода (М. Ниренберг, С. Очоа) ; открытие обратной транскрипции (X. Темин, Д. Балтимор) ; механизма основных этапов биосинтеза белковой молекулы (Ф. Крик, Ф. Жакоб, Ж. Mn) и нуклеиновых кислот (А. Корнберг, С. Очоа) ; установление структуры вирусов и механизмов их репликации, разработка методов генетической инженерии (П. Берг, В. Арбер, Г. О. Смит, Д. Натане) ; синтез гена (X. Корана) и т. д.
Советским учёным принадлежит формулирование принципа матричного синтеза биополимеров (Н. К. Кольцов), формирование основ современной биоэнергетики и механохимии (В. А. Энгельгардт), доказательство существования ДНК у высших растений (Н. А. Белозерский), создание вирусогенетической теории возникновения рака (Л. А. Зильбер), установление последовательности нуклеотидов в транспортной РНК (А. А. Баев), открытие и изучение информосом (А. С. Спирин) и др. Молекулярная биология имеет важное практическое значение в развитии сельского хозяйства (направленное и контролируемое изменение наследственного аппарата животных и растений для получения высокопродуктивных пород и сортов), микробиологической промышленности (бактериальный синтез биологически активных полипептидов и белков, аминокислот и др. ) и как теоретическая основа различных разделов медицины (вирусология, иммунология и др. ) . Перед Молекулярной биологией стоят задачи решения проблем молекулярных основ злокачественного роста, предупреждения наследственных заболеваний, выяснения молекулярных основ катализа, действия гормонов, токсичных и лекарственных веществ, познания механизмов памяти, природы нервных процессов. Большое значение приобретает развитие генной инженерии, позволяющей целенаправленно оперировать генетическим аппаратом животных организмов. Молекулярная биология вместе с биохимией, биофизикой, биоорганической химией часто объединяют в одно общее направление - физико-химическую биологию.
Молекуля́рная биоло́гия - раздел биологии, изучающий структуры и процессы, свойственные живым организмам, на уровне молекул. Молекулярная биология стремится объяснить важнейшие явления жизнедеятельности (наследственность, изменчивость, рост, развитие, движение, обмен веществ и энергии, чувствительность, иммунитет и др. ) строением, свойствами и взаимодействием входящих в состав организмов химических веществ. В любом организме в каждый момент его существования проходит огромное число биохимических реакций, в которых участвуют молекулы большие и малые, простые и сложные, органические и неорганические. Все эти реакции строго упорядочены и, в зависимости от условий и потребностей организма, подвергаются настройке и регулировке. Решающая роль в организации этих процессов принадлежит двум классам больших молекул - белкам и нуклеиновым кислотам. Эти биополимеры и служат главным объектом исследования в молекулярной биологии.
С самого начала молекулярная биология развивалась как научная область, родственная, прежде всего биохимии и биофизике, а также генетике, микробиологии, вирусологии. В 30 - 40-е гг. 20 века для установления пространственной структуры важнейших белков стали применять рентгеноструктурный анализ, сыгравший впоследствии решающую роль и в установлении строения ДНК. Внедрение в эти годы в биологию методов и идей физики и химии заложило основы для развития «молекулярного» направления. Во многом его будущие успехи предопределил интерес физиков и химиков к проблеме наследственности. В 1944 г. вышла книга одного из создателей квантовой механики Э. Шрёдингера «Что такое жизнь? С точки зрения физика», содержавшая краткое изложение основ генетики. Многими представителями точных наук эта работа была воспринята как призыв сосредоточить усилия на решении загадки «вещества наследственности».
Через 9 лет Дж. Уотсон и Ф. Крик решили эту задачу. Ко времени выхода в свет их статьи (апрель 1953 г. ), в которой предлагалась модель молекулы ДНК (так называемая двойная спираль), принято относить рождение молекулярной биологии. Модель Уотсона-Крика ярко выражала главную направленность новой науки: биологические функции макромолекулы можно было объяснить её структурой (см. кислоты) . При этом молекулярный уровень (двухцепочные ДНК) логично увязывался с субклеточным (репликация хромосом), клеточным (митоз, мейоз) и организменным (наследование признаков) .
Близкий подход встречался и в более ранних работах. Ещё в 1927 г. Н. К. Кольцов высказал гипотезу о «наследственных молекулах», способных воспроизводиться путём матричного синтеза, а В. А. Энгельгардту в 1939 г. удалось связать строение мышечных белков с их ролью в мышечном сокращении. Однако только после «двойной спирали» началось бурное развитие молекулярной биологии, ставшей лидером естествознания. Помимо многочисленных конкретных достижений (расшифровка генетического кода, раскрытие механизмов биосинтеза белка, пространственной структуры ферментов и других белков, строения и роли в клеточных процессах биологических мембран и т. д. ), молекулярная биология выявила некоторые общие принципы, на основе которых осуществляются самые различные биологические процессы. Так, комплементарность взаимодействующих молекул (их взаимодополняемость, взаимное соответствие как «ключа и замка»), приводящая к образованию нековалентных химических связей между ними, лежит в основе процессов, требующих биологической специфичности (избирательности, «узнавания»), начиная от синтеза ДНК и белков и кончая образованием комплексов между ферментом и субстратом, антителом и антигеном, самосборкой вирусных частиц и цитоскелета. Точно так же принцип матричного синтеза используется клетками не однократно, а на разных этапах реализации генетической информации.
Контрольные вопросы:
- Каковы перспективы развития молекулярной биологии?
- Каково строение, функции белков и нуклеиновых кислот?
- Генетическая роль нуклеиновых кислот?
- Развитие и перспективы роста молекулярной биологии в Казахстане?
- Каковы задачи молекулярной биологии?. Какие методы молекулярной биологии наиболее широко используются?
Структура и функции белков
Белки или протеины количественно преобладают над всеми другими макромолекулами живой клетки. Белки участвуют во всех биологических процессах, выполняя разнообразные функции: ферментативный катализ; транспорт и накопление; сокращение и движение; иммунная защита; передача информации в клетку; регуляция метаболизма; механическая опора и пр. Каждый белок имеет уникальную, свойственную лишь ему структуру и в такой же мере уникальную функцию, отличающуюся от функций других белков.
Структура белка
Белки - это высокомолекулярные соединения (полимеры), состоящие из a-аминокислот - мономерных звеньев, соединенных между собой пептидными связями. Все 20 аминокислот, встречающиеся в белках, это a-аминокислоты, общим признаком которых является наличие аминогруппы -NН2 и карбоксильной группы -СООН у α-углеродного атома. α-аминокислоты отличаются друг от друга структурой группы R и, следовательно, свойствами. Все аминокислоты можно сгруппировать на основе полярности R-групп, т. е. их способности взаимодействовать с водой при биологических значениях рН (рисунок 1) .
Аминокислоты.
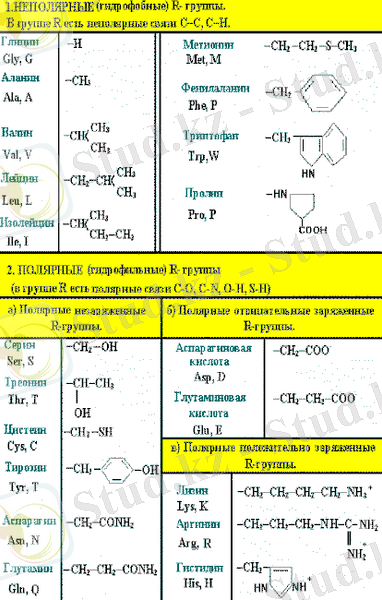
Рисунок 1 - Перечень известных аминокислот
Пептидные связи образуются при взаимодействии α-аминогруппы одной аминокислоты с α-карбоксильной группой другой аминокислоты: Пептидная связь - это амидная ковалентная связь, соединяющая аминокислоты в цепочку (рисунок 2) . Следовательно, пептиды - это цепочки аминокислот. Полипептидная цепь имеет определенное направление, так как у неё разные концы - либо свободная a-аминогруппа (N-конец), либо свободная α-карбоксильная группа (С-конец) :
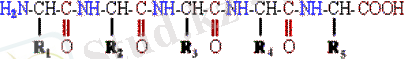
Рисунок 2 - Пептидная связь в последовательности аминокислот
Изображение последовательности аминокислот в цепи начинается с N-концевой аминокислоты. С неё же начинается нумерация аминокислотных остатков. В полипептидной цепи многократно повторяется группа: -NH-H--. Эта группа формирует пептидный остов. Следовательно, полипептидная цепь состоит из остова (скелета), имеющего регулярную, повторяющуюся структуру, и отдельных боковых цепей R-групп. Первичная структура характеризуется порядком (последовательностью) чередования аминокислот в полипептидной цепи. Даже одинаковые по длине и аминокислотному составу пептиды могут быть разными веществами потому, что последовательность аминокислот в цепи у них разная. Последовательность аминокислот в белке уникальна и детерминируется генами. Даже небольшие изменения первичной структуры могут серьезно изменять свойства белка. Было бы неправильно заключить, что каждый аминокислотный остаток в белке необходим для сохранения нормальной структуры и функции белка. Например, были выявлены многие варианты последовательностей гемоглобина, функционирующие нормально. Объяснение этого заключается в понимании конформации белка и будет дано позднее.
Конформация полипептидных цепей
Функциональные свойства белков определяются их конформацией, т. е. расположением полипептидной цепи в пространстве (рисунок 3) . Уникальность конформации для каждого белка определяется его первичной структурой. В белках различают два уровня конформации пептидной цепи - вторичную и третичную структуру. Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: =…. HN.
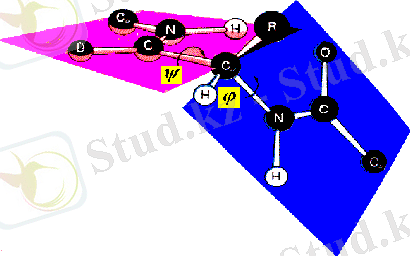
Рисунок 3 - Расположение полипептидной цепи в пространстве
По обеим сторонам жесткой пептидной связи возможно вращение: y и j-углы, характеризующие вращение относительно одинарных связей С a- и a-N.
Пептид стремится принять конформацию с максимумом водородных связей. Однако возможность их образования ограничивается тем, что пептидная связь имеет частично двойной характер, поэтому вращение вокруг нее затруднено. Пептидная цепь приобретает не произвольную, а строго определенную конформацию, фиксируемую водородными связями. Известны несколько способов укладки полипептидной цепи: α-спираль - образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и -группой четвертого от нее остатка; β-структура (складчатый лист) - образуется межцепочечными водородными связями или связями между участками одной полипептидной цепи изогнутой в обратном направлении; беспорядочный клубок - это участки, не имеющие правильной, периодической пространственной организации. Но конформация этих участков также строго обусловлена аминокислотной последовательностью (рисунок 4, 5) . Содержание α-спиралей и β -структур в разных белках различно: у фибриллярных белков - только α -спираль или только β -складчатый лист; а у глобулярных белков - отдельные фрагменты полипептидной цепи: либо α -спираль, либо β -складчатый лист, либо беспорядочный клубок.
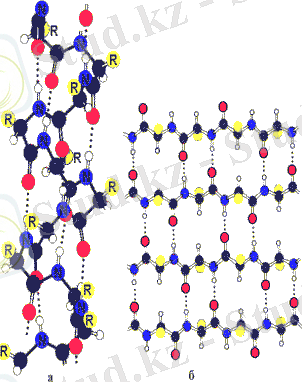
Рисунок 4 - Конформация полипептидных цепей: а - α -спираль, б - β -складчатый лист.
В одном и том же белке могут присутствовать все три способа укладки полипептидной цепи:

- Информатика
- Банковское дело
- Оценка бизнеса
- Бухгалтерское дело
- Валеология
- География
- Геология, Геофизика, Геодезия
- Религия
- Общая история
- Журналистика
- Таможенное дело
- История Казахстана
- Финансы
- Законодательство и Право, Криминалистика
- Маркетинг
- Культурология
- Медицина
- Менеджмент
- Нефть, Газ
- Искуство, музыка
- Педагогика
- Психология
- Страхование
- Налоги
- Политология
- Сертификация, стандартизация
- Социология, Демография
- Статистика
- Туризм
- Физика
- Философия
- Химия
- Делопроизводсто
- Экология, Охрана природы, Природопользование
- Экономика
- Литература
- Биология
- Мясо, молочно, вино-водочные продукты
- Земельный кадастр, Недвижимость
- Математика, Геометрия
- Государственное управление
- Архивное дело
- Полиграфия
- Горное дело
- Языковедение, Филология
- Исторические личности
- Автоматизация, Техника
- Экономическая география
- Международные отношения
- ОБЖ (Основы безопасности жизнедеятельности), Защита труда


